Acide propionique : propriétés, réactions, production et utilisations
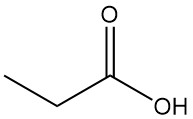
Qu’est-ce que l’acide propionique ?
L’acide propionique est un acide carboxylique à chaîne courte d’origine naturelle dont la formule est CH3CH2COOH. Il s’agit d’un liquide incolore à l’odeur piquante, souvent décrite comme ressemblant à de la sueur ou du fromage.
L’acide propionique a été décrit pour la première fois par J. Gottlieb en 1844 et classé comme acide gras par J.J. Dumas en 1848. Son nom provient des mots grecs « protos » (premier) et « pion » (gras), reflétant sa position de premier acide gras isolable d’une solution aqueuse par relargage.
L’acide propionique existe naturellement, principalement sous forme d’esters dans les huiles essentielles. Il peut également se former sous forme d’acide libre par divers processus enzymatiques et de fermentation. C’est un produit de la fermentation anaérobie des glucides dans l’estomac des ruminants. Les dérivés de l’acide propionique sont utilisés comme intermédiaires dans plusieurs cycles physiologiques.
L’acide propionique est utilisé dans la production d’esters de cellulose, de dispersions plastiques et d’herbicides, et il trouve une utilisation limitée dans les produits pharmaceutiques, les arômes et les parfums.
Il est également utilisé comme conservateur alimentaire en raison de ses propriétés fongicides et bactéricides, et il est de plus en plus utilisé pour prévenir la moisissure et la détérioration bactérienne dans les céréales fourragères, les aliments pour animaux, les produits de boulangerie et le fromage.
Table des matières
1. Propriétés physiques de l’acide propionique
L’acide propionique est un liquide incolore à l’odeur piquante. L’acide propionique solide cristallise dans le système monoclinique et se dilate de 12,2 % en volume lorsqu’il est fondu. Comme ses homologues inférieurs, l’acide acétique et l’acide formique, une partie importante des molécules d’acide propionique se dimérisent dans les phases liquide et gazeuse.
L’acide propionique est miscible à l’eau et à la plupart des solvants organiques dans toutes les proportions. Il forme des mélanges azéotropiques avec divers liquides, dont l’eau (82,3 % en poids d’eau, point d’ébullition 99,98 °C à 101,3 kPa).
Les tableaux 1, 2 et 3 fournissent des données dépendantes de la température pour l’acide propionique, notamment la pression de vapeur, la densité et la viscosité dynamique, respectivement.
| Température (°C) | Pression (kPa) |
|---|---|
| 0,7 | 0,1 |
| 13,5 | 0,25 |
| 24,0 | 0,5 |
| 35,0 | 1,0 |
| 50,8 | 2,5 |
| 64,5 | 5,0 |
| 79,3 | 10,0 |
| 100,9 | 25 |
| 120,1 | 50 |
| 140,9 | 100 |
| 159,5 | 200 |
| 185,7 | 500 |
| 203,0 | 1 000 |
| 219,7 | 2 000 |
| Température (°C) | Densité (g/cm³) |
|---|---|
| -20 | 1,038 |
| -10 | 1,027 |
| 0 | 1,016 |
| 10 | 1,005 |
| 20 | 0,9935 |
| 30 | 0,9827 |
| 40 | 0,9719 |
| 50 | 0,9611 |
| 60 | 0,9503 |
| 70 | 0,9395 |
| Température (°C) | Viscosité (mPa·s) |
|---|---|
| 0 | 154,1 |
| 20 | 109,4 |
| 50 | 73,8 |
| 100 | 45,0 |
| 150 | 31,0 |
D’autres propriétés physiques de l’acide propionique sont répertoriées dans le tableau suivant :
| Propriété | Valeur |
|---|---|
| CAS | [79-09-4] |
| Formule | CH3CH2COOH |
| Poids moléculaire | 74,08 g/mol |
| Point de fusion | -20,8 °C |
| Point d'ébullition | 141,3 °C |
| Indice de réfraction | 1,3865 |
| Tension superficielle par rapport à l'air à | |
| 20 °C | 26,7 × 10-3 N/m |
| 90 °C | 19,7 × 10-3 N/m |
| Conductivité thermique à | |
| 0 °C | 153 W m-1 K-1 |
| 20 °C | 150 W m-1 K-1 |
| 50 °C | 144 W m-1 K-1 |
| 100 °C | 136 W m-1 K-1 |
| Conductivité électrique à 2 °C | 10-4 μS/cm |
| Constante diélectrique dynamique à | |
| 10 °C | 3,30 |
| 40 °C | 3,44 |
| Moment dipolaire électrique, μ | 1,75 D ± 5 % |
| Constante de dissociation dans H2O à | |
| 0 °C | 1,274 × 10-5 mol/L |
| 20 °C | 1,338 × 10-5 mol/L |
| 40 °C | 1,284 × 10-5 mol/L |
| 60 °C | 1,160 × 10-5 mol/L |
| Potentiel d'ionisation | 10,24 ± 0,03 eV |
| Chaleur de fusion | 101,65 kJ/kg |
| Chaleur de vaporisation | 418,7 kJ/kg |
| Chaleur de formation | -164,5 kJ/mol |
| Chaleur de combustion | -1 528,3 kJ/mol |
| Chaleur spécifique (liquide), à | |
| 0 °C | 2,077 kJ kg-1 K-1 |
| 50 °C | 2,299 kJ kg-1 K-1 |
| 100 °C | 2,516 kJ kg-1 K-1 |
| Chaleur spécifique (vapeur), à | |
| 100 °C | 2,823 kJ kg-1 K-1 |
| 200 °C | 3,245 kJ kg-1 K-1 |
| 300 °C | 3,647 kJ kg-1 K-1 |
| Compressibilité isentropique à 20 °C | 0,750 GPa |
| Température critique | 338,9 °C |
| Pression critique | 5,37 MPa |
| Volume critique | 0,322 kg/L |
| Point d'éclair | 50 °C |
| Température d'inflammation | 485 °C |
| Limites d'explosion dans l'air à 20 °C | 2,1–12,0 vol% |
2. Réactions de l’acide propionique
L’acide propionique est le troisième membre de la série des acides monocarboxyliques aliphatiques, qui possède la réactivité caractéristique de ces acides. Il forme facilement des sels, des amides, des halogénures d’acides et des anhydrides.
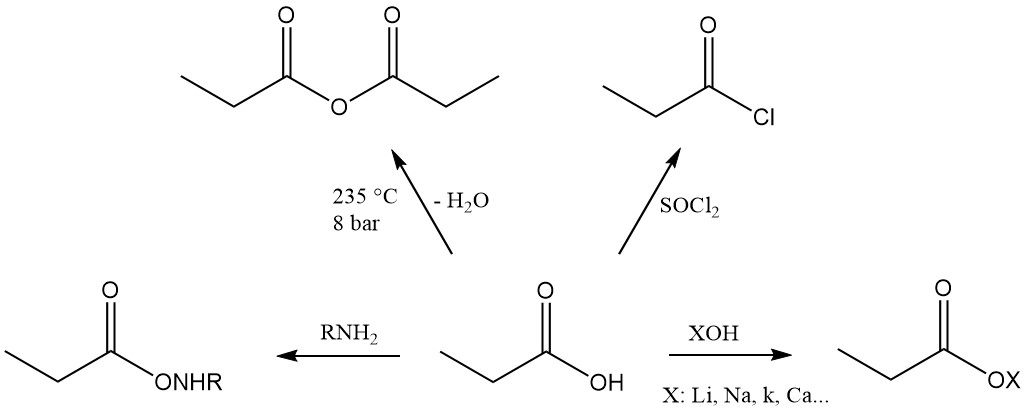
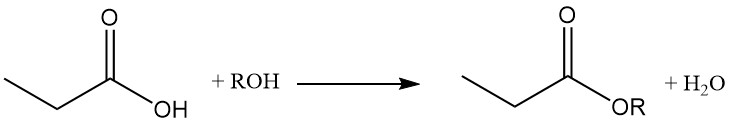
Les esters d’acide propionique sont formés par réaction avec des alcools et des oléfines, tandis que la réaction avec des acétylènes donne les esters vinyliques correspondants.
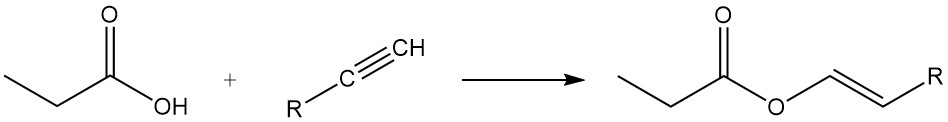
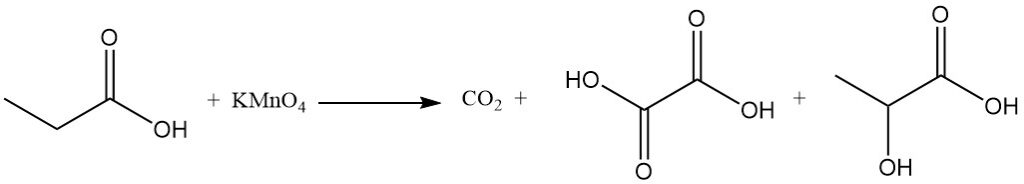
La réactivité de l’acide propionique est différente de celle de l’acide acétique en raison de l’effet inductif du groupe méthylène. Cela rend l’acide propionique plus sensible aux attaques des solutions alcalines de permanganate que l’acide acétique. Le processus de dégradation est non sélectif, ce qui donne un mélange de dioxyde de carbone, d’acide oxalique et d’acide lactique.
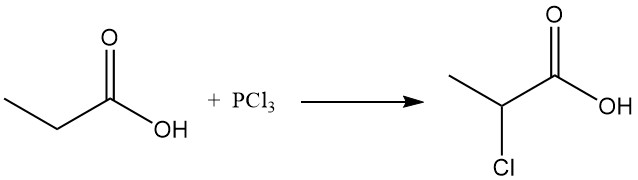
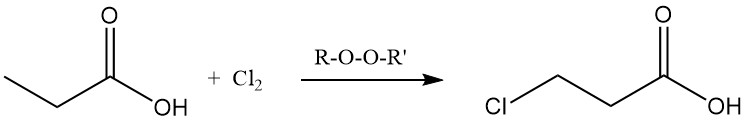
Les réactions de substitution ionique présentent également une préférence pour le groupe méthylène. La chloration à l’aide de réactifs de transfert d’halogène, tels que PCl3, conduit à la formation d’acide α-chloropropionique, tandis que la chloration radicalaire induite par des peroxydes ou des rayons UV produit de l’acide β-chloropropionique.
Ces deux produits sont utilisés comme intermédiaires dans la production d’herbicides et de produits pharmaceutiques.
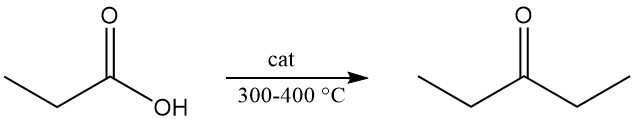
La décomposition thermique de la vapeur de propionate de calcium ou d’acide propionique passée sur des oxydes métalliques à 300–400 °C produit de la diéthylcétone, un solvant industriel largement utilisé.
3. Production industrielle d’acide propionique
L’acide propionique est produit industriellement par carbonylation de l’éthylène ou par oxydation du propanal.
Il peut également être produit comme sous-produit de la synthèse de sels d’hydroxylamine à partir de 1-nitropropane, par distillation du bois, par oxydation nitrique du 1-propanol, par fusion alcaline de mélanges de n-propanol et d’isopropanol, et par carbonylation d’éthanol et d’acide acétique. Cependant, toutes ces méthodes sont obsolètes.
D’autres sources potentielles, mais économiquement non viables, d’acide propionique comprennent :
- Formation de sous-produits : l’acide propionique peut être formé comme sous-produit au cours de processus tels que la carbonylation du méthanol et l’oxydation du n-butène, mais le rendement est relativement faible.
- Réaction directe à l’éthylène : la réaction directe de l’éthylène, du monoxyde de carbone et de l’eau sur des catalyseurs spécifiques a du potentiel mais n’est pas encore compétitive.
- Procédés C1 : des réactions en deux étapes utilisant du gaz de synthèse et des catalyseurs au rhodium ont été décrites pour la production d’acide propionique, mais la disponibilité actuelle des ressources les rend moins attrayantes.
Pour les applications nécessitant de l’acide propionique « naturel », notamment dans les arômes et les parfums, des procédés microbiologiques et enzymatiques basés sur la fermentation de l’amidon ou des sucres ont été développés. Cependant, le coût de production élevé limite son utilisation à des applications spécialisées.
3.1. Production d’acide propionique par carbonylation de l’éthylène (procédé BASF)
Le procédé BASF de production d’acide propionique utilise la synthèse de Reppe. Cette réaction implique la réaction de l’éthylène avec du monoxyde de carbone et de l’eau sous haute pression, en utilisant Ni(CO)4 comme catalyseur.
C2H4 + CO + H2O → CH3CH2COOH
Ce procédé offre plusieurs avantages, tels que des coûts de matières premières faibles, une conversion et un rendement élevés de l’acide propionique et une procédure de traitement simple.
Une description simple du procédé industriel est présentée dans la Figure 1.
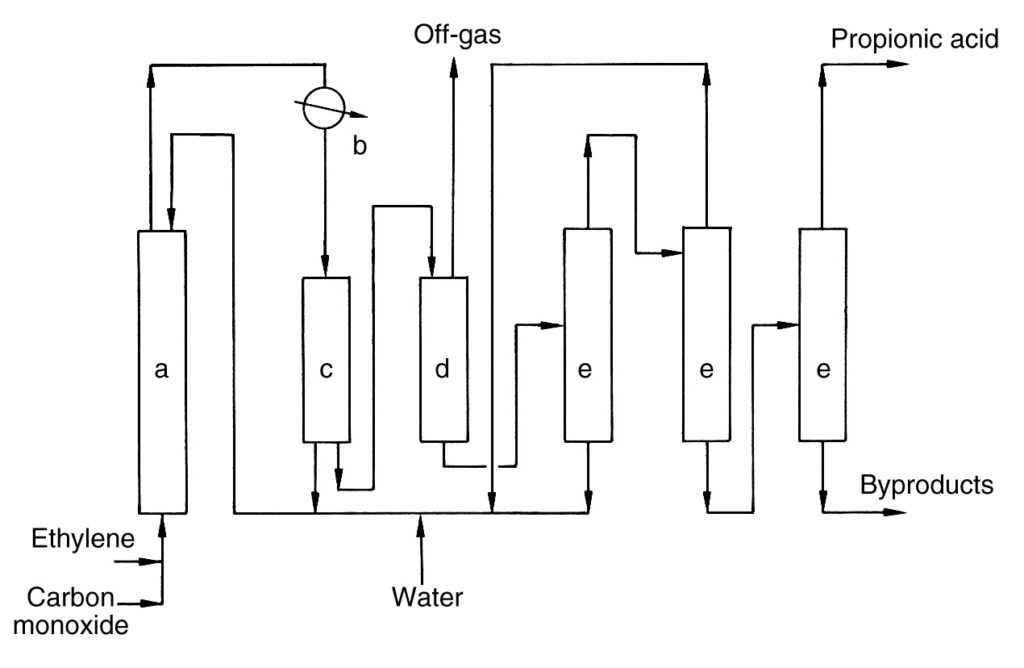
a) Réacteur haute pression ; b) Échangeur de chaleur ; c) Séparateur ; d) Vase d'expansion ; e) Colonne de distillation
L’éthylène et le monoxyde de carbone sont comprimés et alimentés en continu avec un flux de recyclage dans le réacteur haute pression (a). La réaction se déroule à 100–300 bars et 250–320 °C. De l’acide propionique brut est formé et retiré de la tête du réacteur.
Le produit brut est refroidi dans un échangeur de chaleur (b), générant de la vapeur. Une partie du produit refroidi est recyclée vers le réacteur (c) pour le contrôle de la température, tandis que le flux principal est dépressurisé (d).
Le flux dépressurisé se sépare en un flux de gaz de dégagement et un flux d’acide brut. Le catalyseur au nickel est récupéré du gaz de dégagement et recyclé vers le réacteur. Le gaz de dégagement est incinéré avec récupération de chaleur.
L’acide brut est déshydraté et purifié davantage via plusieurs colonnes de distillation (e). Les sels de nickel formés au cours du processus sont recyclés. La distillation finale donne de l’acide propionique pur et le résidu de produit est éliminé du processus.
L’acide borique est censé améliorer la vitesse de réaction et empêcher la précipitation du sel catalyseur.
3.2. Production d’acide propionique par oxydation du propanal
L’acide propionique est produit commercialement par oxydation du propanal. Ce processus comprend deux étapes : la production de propanal et la carbonylation catalysée.
Le propanal est formé comme intermédiaire lors de la production de n-propanol par hydroformylation de l’éthylène. Contrairement aux aldéhydes supérieurs, les mélanges d’isomères n/iso ne se forment pas. Il est produit industriellement par carbonylation catalysée par le cobalt à haute pression ou par carbonylation catalysée par le rhodium/iridium à basse pression.
Le propanal facilement obtenu est ensuite oxydé sélectivement en acide propionique dans des conditions douces (40–50 °C).
Cette méthode en deux étapes garantit l’utilisation des installations existantes pour la production de propanal et l’oxydation ultérieure. Des entreprises comme Dow (anciennement Union Carbide) et Eastman aux États-Unis utilisent cette méthode pour la production d’acide propionique.
3.3. Production d’acide propionique par oxydation directe d’hydrocarbures
Historiquement, une part importante de l’acide propionique était produite par oxydation directe d’hydrocarbures, principalement du naphta. Ce procédé, principalement utilisé pour la production d’acide acétique, générait également de l’acide formique, de l’acide propionique, un mélange d’isomères d’acide butyrique et de la méthyléthylcétone comme sous-produits.
Bien que cette méthode offre des avantages en termes de coût des matières premières, le processus présente des défis importants :
- Mélange de produits complexe : le processus d’oxydation produit un mélange complexe de divers acides organiques, nécessitant un processus de séparation sophistiqué et coûteux.
- Contrôle limité des produits : les conditions de réaction offrent un contrôle minimal sur les ratios spécifiques des produits formés, ce qui rend difficile l’adaptation aux demandes fluctuantes du marché.
- Consommation énergétique élevée : le processus de séparation associé à cette technologie entraîne une consommation énergétique élevée.
Ces inconvénients ont finalement conduit à la abandon complet de cette technologie. En 2009, toutes les usines opérationnelles utilisant ce procédé avaient été fermées, la dernière étant l’usine de Celanese à Pampa, au Texas.
Une description du procédé BP Chemicals (Figure 2), un exemple historique d’oxydation directe d’hydrocarbures, est fournie à titre de référence.
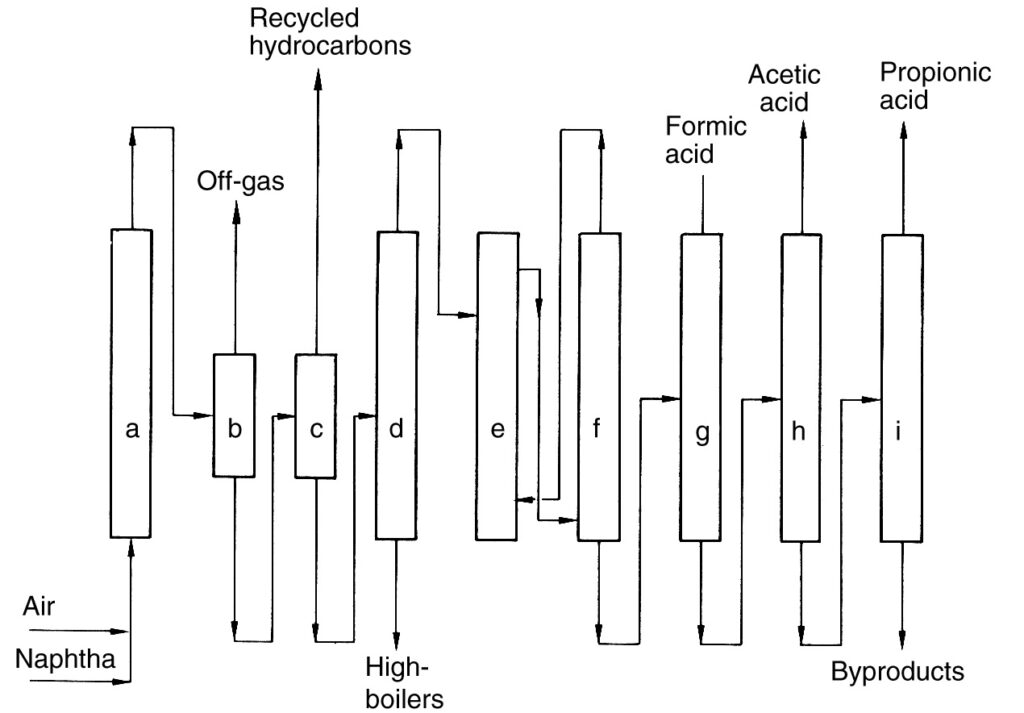
a) Réacteur ; b) Séparateur gaz-liquide ; c) Séparateur liquide-liquide ; d) Colonne de distillation ; e) Extraction ; f) Séparation de l'agent d'extraction ; g) Distillation d'acide formique ; h) Distillation d'acide acétique ; i) Distillation d'acide propionique
Dans ce procédé, le naphta a été préchauffé puis oxydé avec de l’air à pression élevée (40-45 bars) dans une série de réacteurs (a). La réaction a généré de la chaleur, qui a été utilisée pour la production de vapeur.
L’effluent refroidi du réacteur a été séparé du gaz de réaction dans un séparateur (b). Le liquide récupéré a été recyclé vers les réacteurs, tandis que le gaz de réaction a été incinéré. Le produit liquide restant a ensuite été séparé en une phase organique (hydrocarbures n’ayant pas réagi) et une phase aqueuse contenant le mélange de produits (c). Les hydrocarbures n’ayant pas réagi ont été recyclés.
La phase aqueuse a subi une séparation des composants à bas et haut point d’ébullition, suivie d’une déshydratation par extraction (e) pour obtenir l’acide brut. Enfin, les étapes de distillation fractionnée (g) à (i) ont été utilisées pour isoler les acides carboxyliques en C1 à C4.
3.4. Production d’acide propionique par fermentation
Alors que les procédés pétrochimiques dominent la production industrielle d’acide propionique, la fermentation à l’aide d’espèces de Propionibacterium offre une alternative biosourcée. Ces bactéries Gram positives, non mobiles et en forme de bâtonnets sont généralement reconnues comme sûres (GRAS), ce qui rend l’acide propionique obtenu adapté à des applications telles que l’alimentation humaine et animale, les produits pharmaceutiques et les cosmétiques.
Les bactéries propioniques utilisent la voie de l’acide dicarboxylique pour convertir le glucose (ou d’autres sources de carbone) en acide propionique. Cette voie implique le pyruvate comme intermédiaire clé. Le pyruvate peut être soit carboxylé en oxaloacétate, conduisant à la biosynthèse de l’acide propionique, soit décarboxylé en acétyl-CoA, conduisant à la biosynthèse de l’acide acétique.
La coproduction d’acides propionique et acétique maintient l’équilibre redox.
Théoriquement, 1,5 mole de glucose peut donner 2 moles de propionate, 1 mole d’acétate et 1 mole de CO2 par la voie Embden-Meyerhof-Parnas (EMP). Cela se traduit par un rendement maximal en acide propionique de 0,548 g/g de glucose et un rapport acide propionique/acide acétique de 2.
La voie des pentoses phosphates (HMP) peut conduire à des rendements en acide propionique plus élevés (jusqu’à 0,68 g/g) avec une production d’acide acétique moindre. L’acide succinique est un sous-produit courant de ce processus.
Le rendement réel en acide propionique dépend fortement du substrat choisi et des conditions de fermentation.
La fermentation de l’acide propionique se produit généralement dans des conditions anaérobies (purgées avec de l’azote gazeux) à 30–32 °C et à un pH de 6,0–7,0. Le milieu de fermentation nécessite un tampon (par exemple, du CaCO3) ou l’ajout d’une base (par exemple, de l’hydroxyde d’ammonium) pour neutraliser les acides produits, car la croissance des bactéries propioniques cesse en dessous de pH 4,5.
Le milieu comprend généralement une source de carbone (par exemple, du glucose), une source d’azote (par exemple, de l’ammoniac), des minéraux et des vitamines. Les bactéries propioniques peuvent utiliser diverses sources de carbone, notamment les sucres, le lactate, le glycérol et le sorbitol.
Les procédés industriels utilisent souvent des matières premières à faible coût comme le perméat de lactosérum, la mélasse ou le glycérol résiduaire du biodiesel, complétés par des sources d’azote comme l’extrait de levure.
L’acide propionique lui-même agit comme un inhibiteur de fermentation, réduisant les taux de croissance et de production à des concentrations supérieures à 10 g/L. Les procédés de fermentation conventionnels prennent généralement 3 jours pour atteindre environ 20 g/L d’acide propionique avec un rendement de 0,4 g/g de glucose ou moins.
Des recherches approfondies se sont concentrées sur l’amélioration du rendement, de la concentration et du taux de production grâce au développement de souches et à l’optimisation des procédés.
4. Utilisations de l’acide propionique
4.1. Utilisations de l’acide propionique comme conservateur pour les aliments et les aliments pour animaux
L’acide propionique et ses sels (propionates) sont largement utilisés comme conservateurs en raison de leur capacité à inhiber les bactéries, les champignons, les insectes, les virus et les acariens.
Le mécanisme d’action exact est encore à l’étude, mais on pense que la forme non dissociée de l’acide propionique (dominante à pH acide) est responsable de l’effet conservateur. Cette forme pénètre dans les cellules comme un nutriment et perturbe les enzymes essentielles du métabolisme des glucides.
Les propionates nécessitent une hydrolyse pour libérer la forme acide active, ce qui les rend plus lents et moins efficaces que l’acide propionique lui-même.
L’acide propionique présente un large spectre d’activité contre divers micro-organismes, avec une concentration minimale inhibitrice (CMI) de 0,05 à 0,50 % en poids contre les champignons, de 0,25 à 0,50 % en poids contre les bactéries et de 0,10 à 1,0 % en poids contre les levures.
Il est efficace contre les moisissures de détérioration dans les aliments et les aliments pour animaux et plus efficace contre les bactéries Gram-négatives (par exemple, E. coli, Salmonella). Il inactive également les virus comme le virus de la vaccine à des concentrations supérieures à 1,0 % en poids et tue les acariens et les coléoptères du maïs dans les céréales.
L’acide propionique a une forte odeur, ce qui limite son utilisation dans la conservation des aliments. Les propionates (sels de calcium, de sodium et d’ammonium) sont préférés dans les aliments en raison de leur goût et de leur odeur presque neutres.
Les deux formes sont utilisées dans la conservation des aliments, les animaux préférant souvent le goût acide des aliments conservés à l’acide propionique.
L’acide propionique et ses sels sont généralement reconnus comme sûrs (GRAS) pour diverses applications alimentaires aux États-Unis et en Europe. La FAO/OMS n’a pas de limites spécifiques quant à leur consommation quotidienne.
4.2. Autres utilisations
L’acide propionique est utilisé dans d’autres industries telles que le caoutchouc, les polymères, les solvants, les arômes, les parfums, les produits pharmaceutiques et les herbicides.
Les propionates de zinc, de cadmium, de plomb et de mercure peuvent être utilisés comme régulateurs de vulcanisation, influençant le processus de renforcement du caoutchouc pendant la production.
L’acide propionique est utilisé comme intermédiaire, souvent sous sa forme anhydride, pour la production d’esters précieux tels que l’acétate de cellulose propionate et le propionate de vinyle.
Les propionates de méthyle, d’éthyle, de propyle et de butyle sont utilisés comme solvants pour les résines et les peintures, et divers esters de propionate possèdent des arômes fruités caractéristiques, ce qui en fait des ingrédients précieux dans les formulations d’arômes et de parfums.
De petites quantités d’acide propionique sont converties en chlorure de propionyle, une molécule réactive utilisée pour introduire le « groupe propionyle » lors de la synthèse de certains produits pharmaceutiques.
Jusqu’à la fin des années 1980, une part importante de l’acide propionique était utilisée pour produire des herbicides chlorés. Cependant, le développement d’herbicides plus puissants et polyvalents a entraîné un déclin de cette application.
5. Toxicologie de l’acide propionique
L’acide propionique présente une faible toxicité aiguë et est rapidement métabolisé dans l’organisme. Cependant, il a des effets irritants/corrosifs sur la peau et les yeux. Une exposition chronique à des concentrations élevées peut provoquer des modifications locales de l’épithélium du préestomac de certaines espèces animales.
L’acide propionique, ou sa forme activée, le propionyl-CoA, est un intermédiaire naturel du métabolisme humain. Il est facilement absorbé et métabolisé par le foie.
L’acide propionique présente une faible toxicité orale et par inhalation. Les propionates de sodium et de calcium sont encore moins toxiques. Le contact avec la peau peut provoquer une irritation ou une corrosion.
L’exposition à long terme à des concentrations élevées (> 0,4 %) chez le rat peut provoquer des modifications de la muqueuse du préestomac. Cependant, les chiens beagle, qui n’ont pas de préestomac, n’ont pas montré ces effets.
Les études n’ont montré aucune preuve que l’acide propionique ou les propionates provoquent des mutations génétiques. Les études sur les animaux gravides n’ont révélé aucune anomalie du développement causée par l’exposition à l’acide propionique.
Des études limitées sur l’homme suggèrent que l’acide propionique est bien toléré par voie orale à faible dose. Les solutions de propionate de sodium ont été utilisées en toute sécurité pour le traitement des yeux.
Référence
- Propionic Acid and Derivatives; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a22_223.pub4
Je suis un chimiste organique passionné et j'apprends continuellement divers procédés de chimie industrielle et produits chimiques. Je m'assure que toutes les informations contenues sur ce site Web sont exactes et méticuleusement référencées à des articles scientifiques.
