Acide oxalique: production, réactions et utilisations

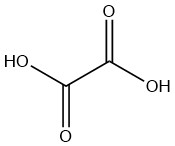
L’acide oxalique est l’acide dicarboxylique saturé le plus simple. Le composé existe sous forme anhydre ou sous forme de dihydrate.
L’acide anhydre ne se trouve pas dans la nature et doit être préparé à partir du dihydrate même lorsqu’il est produit industriellement.
L’acide oxalique est largement répandu dans le règne végétal et animal (presque toujours sous la forme de ses sels) et a diverses applications industrielles. C’est l’un des plus anciens acides connus et a déjà été identifié dans le sel de potassium d’oseille par WIEGLEB en 1769.
Table des matières
1. Production d’acide oxalique
Il existe de nombreux procédés industriels de production d’acide oxalique, qui ont été réalisés par un grand nombre d’entreprises et sont en partie encore utilisés aujourd’hui. Généralement, seules trois classes de composés sont employées comme matières premières pour la production d’acide oxalique. Ceux-ci sont:
- glucides (y compris l’éthylène glycol et la mélasse)
- oléfines
- monoxyde de carbone
Dans tous les procédés industriels, l’acide oxalique est produit sous forme de dihydrate cristallin. Dans les sections suivantes, quatre méthodes sont décrites qui sont actuellement utilisées industriellement. Trois d’entre eux sont basés sur une oxydation de l’acide nitrique et un est une synthèse utilisant du monoxyde de carbone.
1.1. Oxydation des glucides
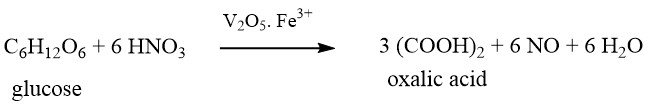
Cette méthode, la plus ancienne des productions chimiques, a été en principe découverte par SCHEELE il y a plus de 200 ans (1776). Il a oxydé le sucre avec de l’acide nitrique concentré en acide oxalique.
Cependant, ce n’est que vers ca. 1940 que ce procédé a acquis une importance industrielle lorsque les oxydes d’azote produits dans la réaction ont pu être récupérés et recyclés. En Allemagne, I.G. Farben produisait 2000 t d’acide oxalique par an par ce méthode jusqu’en 1944.
Ce procédé est employé au Brésil, en Chine et dans plusieurs pays d’Europe de l’Est. Les matières premières utilisées dans ce procédé comprennent le sucre, le glucose, le fructose, l’amidon de maïs, l’amidon de blé, l’amidon récupéré, l’amidon de pomme de terre, les épis de maïs, le tapioca et la mélasse.
Le choix du matériau de départ dépend de la disponibilité et du prix et de l’optimisation du processus de réaction impliqué. Par exemple, selon les matériaux de départ, de la mousse, des graisses, de la boue et des rendements variables peuvent être attendus et doivent être traités en conséquence.
La mélasse et les autres déchets agricoles ont acquis une importance croissante en tant que matières premières. Ces matériaux sont non seulement peu coûteux, mais doivent être transformés dans tous les cas pour des raisons environnementales.
La mélasse contient, en tant que résidu de production du raffinage du sucre, de nombreux composés azotés, qui sont cependant pour la plupart éliminés lors de l’oxydation de l’acide nitrique. Ceci explique les difficultés rencontrées avec la formation excessive de mousse lors de la production qui doivent être surmontées.
Si des produits amylacés sont utilisés comme matières premières, ils doivent être hydrolysés en glucose dans une étape supplémentaire par lots avant l’oxydation proprement dite.
La solution de glucose est placée dans un réacteur avec env. Acide sulfurique à 50 %, pentoxyde de vanadium (0,001 – 0,05 % en poids) et sulfate de fer (III) (0,39 – 0,8 % en poids), sur la base de la masse totale du mélange.
L’acide nitrique (65 %) est puis ajouté lentement sous agitation vigoureuse dans une plage de température étroitement contrôlée autour de 70 ° C, la plage de température diffère selon la matière première utilisée. La réaction fortement exothermique doit être bien refroidie.
L’air est simultanément insufflé dans le réacteur pour soutenir la réaction et éliminer le NO et les autres oxydes d’azote à faible indice d’oxydation. Les oxydes d’azote expulsés sont collectés dans un système d’adsorption et sont recyclés après oxydation.
L’acide oxalique brut est obtenu après refroidissement et centrifugation du mélange réactionnel. L’acide brut est à nouveau dissous dans de l’eau chaude, passé dans un séparateur de graisse et recristallisé. Après une seconde centrifugation et séchage, on obtient de l’acide oxalique dihydraté avec une pureté >99 %.
1.2. Oxydation de l’éthylène glycol
L’oxydation de l’éthylène glycol avec de l’acide nitrique est un processus en une étape. Un mélange oxydant de 30 à 40 % d’acide sulfurique et de 20 à 25 % d’acide nitrique est utilisé.
L’oxydation est réalisée en présence de pentoxyde de vanadium et de sels de fer (III), à 50-70 °C et à pression atmosphérique. Seul le CO2 est formé comme sous-produit.
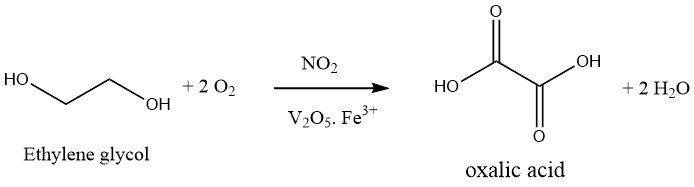
Ce procédé original a été amélioré par la Mitsubishi Gas Company et au Japon la plupart de l’acide oxalique est produit de cette façon. Le procédé amélioré fonctionne à environ 10 bars dans un réacteur sous pression, dans lequel env. L’acide nitrique à 60 % et éventuellement aussi l’acide sulfurique à 80 °C, est pressurisé avec de l’oxygène à 3 – 10 bar.
L’éthylène glycol est ensuite pompé en continu et la température et la pression sont maintenues par addition d’oxygène. La réaction exothermique doit être maintenue à une température de 50 à 70 °C par un refroidissement efficace. Le rendement en acide oxalique, basé sur l’éthylène glycol, est de 90 à 94 % de la valeur théorique.
L’acide nitrique utilisé peut être récupéré presque entièrement. Cela indique que les oxydes d’azote et l’acide nitrique n’agissent que comme catalyseurs et que l’oxydation proprement dite a été effectuée par l’oxygène.
D’autres matières de départ appropriées sont le propylèneglycol, l’acétaldéhyde ou l’acide glycolique. Les composés de vanadium (0,001 à 0,1 % en poids) sont recommandés comme promoteurs. Le nitrite de sodium, l’acide formique ou le formaldéhyde sont recommandés comme initiateurs.
1.3. Oxydation du propène
Le deuxième processus industriel le plus important pour la production d’acide oxalique (après l’oxydation des glucides) est la réaction du propène avec l’acide nitrique. La production mondiale d’acide oxalique par cette méthode en 1978 était de 65 000 t/a. Du propène pur ou des fractions riches en propène provenant de raffineries pétrochimiques peuvent être utilisées comme matières premières.
Cette réaction développée plus tôt a été considérablement améliorée par Rhône-Poulenc en France grâce à des améliorations techniques d’ingénierie et de construction et au strict respect des conditions de réaction.
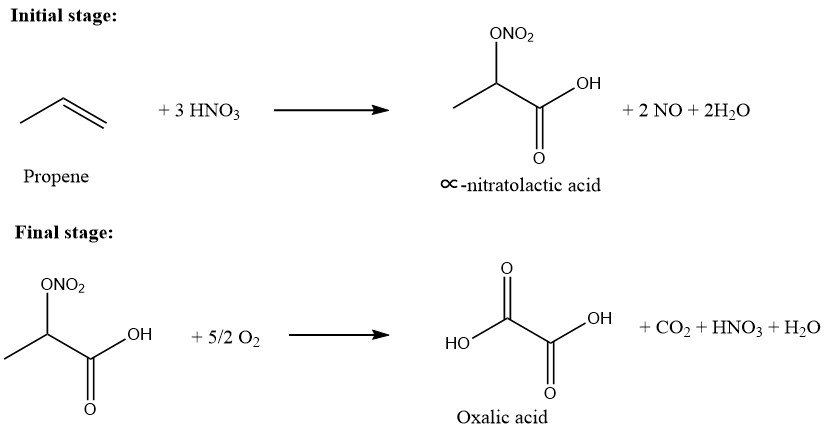
Le propène est introduit dans une solution d’acide nitrique (50 – 75 % en poids) dans le premier réacteur à 10 – 40 °C, tout en maintenant le rapport molaire du propène à l’acide nitrique à 0,01/1,0 – 0,5/1,0 pour produire des intermédiaires hydrosolubles de ∝-acide nitrolactique et acide lactique. Dans la deuxième étape, la solution de ces produits partiellement oxydés est traitée avec de l’oxygène à 45 – 100 °C en présence d’un catalyseur.
L’acide oxalique est formé, cristallisé et filtré. Le rendement global basé sur le propène serait d’env. 90 % et la conversion du propène est d’env. 100 %. Les oxydes d’azote sont évacués du second réacteur et récupérés. La consommation d’acide nitrique est de 1,2 kg par kg d’acide oxalique dihydraté produit.
Une amélioration du rendement est obtenue par l’ajout de catalyseurs (sels ou composés contenant Fe, Al, Cr, Sn, Bi ou I). Dans l’industrie chimique, le nitrate de chrome (III), le nitrate de fer (III) ou le chlorure d’étain (II) sont utilisés en quantités de 0,4 à 0,5 % en poids (par rapport au métal) et dissous dans de l’acide nitrique à 65 %.
1.4. Production à partir de monoxyde de carbone
Le plus récent procédé de production industrielle d’acide oxalique a été développé par Ube Industries. Leur synthèse s’effectue en deux étapes. Dans la première étape, du CO et un alcool inférieur sont mis à réagir sous pression et en présence d’un catalyseur pour former le diester correspondant de l’acide oxalique.
Ce diester est hydrolysé dans la deuxième étape en acide oxalique et en alcool d’origine qui est ensuite recyclé. Le palladium sur charbon et les nitrites d’alkyle sont utilisés comme catalyseurs et la réaction est effectuée à 10 – 11 MPa. Le n-butanol est l’alcool préféré et est simultanément utilisé comme solvant.
Ce procédé a l’avantage d’avoir des matières premières peu coûteuses, cependant, il est désavantageux en ce qui concerne l’investissement en capital (haute pression) et les coûts d’utilité beaucoup plus élevés.
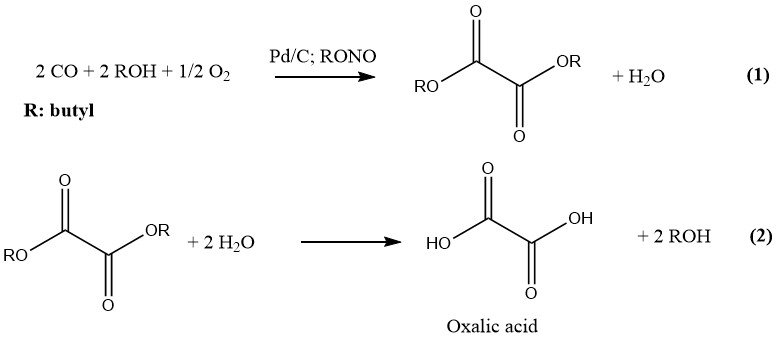
Le nitrite de butyle et le nitrite de méthyle sont les nitrites d’alkyle préférés à des fins industrielles. La première usine utilisant du nitrite de butyle dans la production d’acide oxalique a été construite en 1978 (6000 t/an d’acide oxalique). Les avantages de l’utilisation du nitrite de butyle sont les suivants :
1. Il fonctionne non seulement comme composant de réaction mais aussi comme agent déshydratant. Le nitrite de butyle a un point d’ébullition plus élevé que l’eau et le nitrite de butyle et l’eau forment un mélange azéotropique avec un point d’ébullition plus bas que le nitrite de butyle. Ainsi, l’eau formée peut être éliminée sous la forme d’un mélange azéotropique et la majeure partie du butylnitrite reste dans le système. Le nitrite de butyle est récupéré du mélange azéotropique et réutilisé.
2. Le nitrite de butyle est finalement hydrolysé en butanol qui peut être facilement séparé de la solution d’acide oxalique par séparation de phases.
Un liquide de circulation contenant du nitrite de butyle, du butanol et le catalyseur au palladium et un gaz de circulation contenant du monoxyde de carbone et de l’oxygène sont mis sous pression et introduits dans une tour de réaction. Ici, l’oxalate de dibutyle est formé et le nitrite de butyle est consommé. Le butylnitrite est régénéré simultanément.
Les deux réactions sont exothermiques. La sélectivité pour l’oxalate de dibutyle augmente avec l’augmentation de la pression de réaction et la diminution de la température de réaction ; cependant, la vitesse de la réaction augmente avec l’augmentation de la température. Ainsi, la réaction est conduite industriellement à 10 –11 MPa et 90 – 100 °C.
Une circulation de gaz est effectuée afin de maintenir la concentration en oxygène en dessous de la limite d’explosivité pendant la réaction et d’améliorer l’utilisation du monoxyde de carbone et le taux de contact gaz-liquide.
La solution libérée de la tour est flashée pour évaporer le dioxyde de carbone gazeux formé comme sous-produit. L’eau de réaction est éliminée par distillation azéotropique avec du nitrite de butyle et la majeure partie de la solution est recyclée vers la tour de réaction.
Une partie de la solution est ensuite traitée : elle est d’abord filtrée pour séparer les catalyseurs ; puis le nitrite de butyle et le butanol sont éliminés pour donner de l’oxalate de dibutyle pur.
Le catalyseur au palladium, le nitrite de butyle et le butanol sont récupérés et renvoyés dans le liquide de circulation, qui est également alimenté en butanol et en acide nitrique d’appoint. Le liquide de circulation est ensuite pressurisé et renvoyé à la tour de réaction.
L’oxalate de dibutyle raffiné est mélangé avec la liqueur mère de la cristallisation de l’acide oxalique et hydrolysé à environ 80 °C en acide oxalique et butanol. La solution d’acide oxalique et le butanol sont séparés par séparation de phases. Ensuite, l’acide oxalique dihydraté est cristallisé à partir de la solution d’acide oxalique et le butanol est recyclé dans le procédé après raffinage.
2. Réactions chimiques de l’acide oxalique
L’acide oxalique présente un comportement unique en raison de l’interaction des groupes carboxylate voisins. Il en résulte une augmentation de la valeur de la constante de dissociation et de la facilité de décarboxylation : lors d’un chauffage rapide à 100 °C, l’acide oxalique se décompose en monoxyde de carbone, dioxyde de carbone et eau avec de l’acide formique comme intermédiaire isolable.
En solution aqueuse, la décomposition est induite par la lumière et, dans une bien plus grande mesure, par les rayons γ ou X (en monoxyde de carbone, dioxyde de carbone, acide formique et parfois hydrogène). Cette décomposition est catalysée par les sels de métaux lourds, par exemple par les sels d’uranyle.
L’acide oxalique ne peut pas former d’anhydride intramoléculaire. Lors d’un chauffage à plus de 190 ° C ou d’un réchauffement dans de l’acide sulfurique ou phosphorique concentré, l’acide oxalique se décompose en monoxyde de carbone, dioxyde de carbone et eau. cette décomposition n’est pas exothermique.
Les propriétés réductrices de l’acide oxalique (qui est lui-même oxydé en dioxyde de carbone et en eau, produits finaux inoffensifs) constituent la base de la variété des applications pratiques.
L’acide oxalique est également oxydé relativement facilement en dioxyde de carbone par de nombreux autres agents oxydants en plus de l’air, en particulier en présence de sels de métaux lourds. L’acide oxalique est facilement estérifié, de sorte que deux types, les diesters acides mono ou neutres peuvent en résulter.
Ces esters sont appliqués comme intermédiaires dans les synthèses chimiques. Ils réagissent relativement facilement avec l’eau, l’ammoniac ou les amines pour donner les dérivés acylés correspondants.
Des caractéristiques chimiques importantes sont également démontrées par les sels métalliques de l’acide oxalique. Ceux-ci existent en deux types – les sels acides et neutres. Les sels de métaux alcalins et de fer (III) sont facilement solubles dans l’eau.
Tous les autres sels sont peu solubles dans l’eau. L’insolubilité presque complète des sels alcalino-terreux de l’acide oxalique, en particulier de l’oxalate de calcium, trouve quelques applications dans l’analyse quantitative.
Lorsqu’ils sont chauffés, tous ces sels métalliques perdent du monoxyde de carbone. D’autres sels plus facilement décomposables perdent en plus du dioxyde de carbone. Les sels alcalins et alcalino-terreux forment des carbonates dans ces conditions.
Les sels de manganèse, de zinc et d’étain forment des oxydes; les sels de fer, de cadmium, de mercure et de cuivre forment des mélanges d’oxydes et de métaux. Les sels de nickel, de cobalt et d’argent donnent des métaux purs. La fusion anhydre d’oxalates avec des carbonates de rendement alcalin et de l’hydrogène.
3. Utilisations de l’acide oxalique
Outre l’application de l’acide oxalique comme intermédiaire de synthèse, les propriétés de l’acide oxalique ou de ses sels ont généralement été exploitées comme agents réducteurs (auquel cas les produits finaux inoffensifs du dioxyde de carbone et de l’eau sont formés), comme précipitants pour les ions calcium, ou comme agents complexants des sels de métaux lourds.
3.1. Traitement des métaux
Les oxalates de sodium, de potassium ou d’ammonium forment des sels doubles solubles avec les métaux lourds, notamment le fer. L’oxalate de fer (III) est le seul sel de métal lourd facilement soluble.
Les sels d’acide oxalique sont donc utilisés pour l’élimination de la rouille, par exemple des systèmes de refroidissement (radiateurs d’automobiles), des chaudières ou des plaques d’acier avant phosphatation, pour l’élimination des veines de fer dans le marbre, comme constituant des nettoyants métalliques avec protection contre la rouille, en particulier pour une utilisation sur le cuivre, l’argent ou l’aluminium, dans l’anodisation de l’aluminium, pour la formation de revêtements de protection très durs contre l’abrasion et la corrosion, où, grâce à l’utilisation d’additifs, différentes couleurs de surface peuvent être conférées à l’aluminium.
L’acide oxalique est également utilisé pour le nettoyage des matériaux des appareils électroniques et comme revêtements pour la protection de l’acier inoxydable, des alliages de nickel, du chrome, des aciers alliés et du titane.
3.2. Traitement des textiles
L’acide oxalique est utilisé comme mordant pour l’impression et la teinture de la laine et du coton. Il sert d’agent de décapage pour les couleurs de laine pour les effets de motifs spéciaux, comme auxiliaire dans l’impression par décharge caustique à l’indigo, et est utilisé dans la teinture en cuve comme agent réducteur pour le bichromate de potassium.
Dans les blanchisseries, l’acide oxalique est utilisé pour éliminer les taches de rouille et neutraliser l’alcalinité. Il a également un effet antibactérien. L’acide oxalique peut être utilisé comme catalyseur pour la réticulation d’agents de finition textile dans le pressage permanent de tissus cellulosiques et pour l’ignifugation.
3.3. Agents de blanchiment
L’acide oxalique est utilisé dans le tannage et le blanchiment du cuir, et dans le blanchiment du liège, du bois (en particulier du bois plaqué), de la paille, du jonc, des plumes ainsi que des cires naturelles et synthétiques.
La majorité de l’acide oxalique est utilisée pour le blanchiment du bois à pâte. Dans le traitement du cuir, l’acide oxalique est utilisé pour blanchir à la place du dithionite de sodium.
Références
- Oxalic Acid; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a18_247.pub2
