Acétone: production, réactions et utilisations

L’acétone, également connu sous le nom de 2-propanone, est un liquide incolore et inflammable avec une odeur âcre et une faible viscosité. C’est la cétone la plus simple, de formule C3H6O. L’acétone est miscible à l’eau, ce qui signifie qu’elle se mélange facilement à l’eau dans n’importe quelle proportion.
Il est principalement utilisé comme solvant et intermédiaire dans la synthèse de divers produits chimiques, tels que le bisphénol A, le méthacrylate de méthyle, les produits chimiques aldols (alcool diacétonique, oxyde de mésityle et méthylisobutylcétone) et d’autres produits.
Historiquement, l’acétone était produit commercialement par distillation sèche de l’acétate de calcium jusqu’au début des années 1900.
L’acétone est également présent dans la nature, comme dans les arbres et les plantes, et elle est également produite métaboliquement dans le corps humain, principalement à partir de la dégradation des graisses. De plus, l’acétone est facilement biodégradable.
Table des matières
1. Production d’acétone
Aujourd’hui, la voie du cumène est de loin le procédé de production dominant pour l’acétone, avec une production mondiale de plus de 6 millions de tonnes d’acétone par an. Le taux de production des autres routes est aujourd’hui inférieur à 5 % de la capacité mondiale.
1.1. Production d’acétone par procédé Cumene
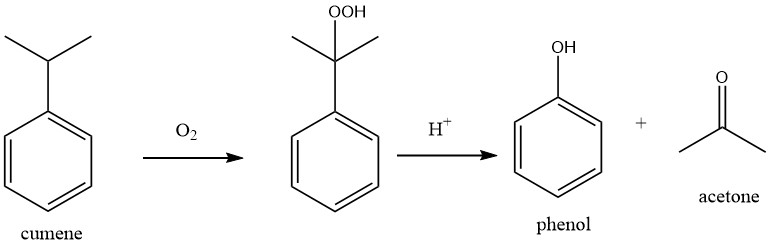
Le processus global de production d’acétone à partir de benzène et de propène comprend deux étapes principales.
Dans la première étape, le cumène est produit à partir de benzène et de propène dans le procédé au cumène par alkylation de Friedel-Crafts. Le propane et les autres hydrocarbures contenus dans la charge de propène sont séparés en tant que composants à bas point d’ébullition dans l’unité de distillation du cumène.
Les composants à haut point d’ébullition, principalement les polyisopropylbenzènes, sont séparés sous forme de résidu.
Il n’y a qu’une petite quantité d’eau de procédé, qui est générée à partir de l’eau dissoute dans les charges d’alimentation de benzène et de propène.
Dans la deuxième étape (oxydation du cumène, procédé Hock), le cumène est d’abord oxydé avec l’oxygène atmosphérique en hydroperoxyde de cumène (CHP). Le CHP est ensuite clivé en phénol et acétone en utilisant un acide minéral fort comme catalyseur.
Les cétones, principalement des sous-produits de l’acétone, sont séparées en tant que composants à bas point d’ébullition lors de la distillation.
Les composants à haut point d’ébullition, qui sont principalement formés dans l’unité d’oxydation et de clivage, sont séparés sous forme de résidu.
Une certaine quantité d’eau de procédé est générée dans le procédé phénol-acétone et doit être traitée ultérieurement dans une station d’épuration biologique.
La réaction globale peut être considérée comme une double oxydation : le benzène est oxydé en phénol et le propène est oxydé en acétone.
1.2. Production d’acétone par déshydrogénation du 2-propanol

Une autre voie vers l’acétone est la déshydrogénation du 2-propanol (isopropanol), formé par hydratation du propène. La déshydrogénation est une réaction endothermique.
En 1970, environ 50 à 60 % de la production totale d’acétone aux États-Unis provenait de cette voie. De nos jours, le procédé d’oxydation du Cumène avec l’acétone comme coproduit est la principale source d’acétone dans le monde.
Dans la littérature, plusieurs catalyseurs sont décrits pour la déshydrogénation du 2-propanol.
Le produit secondaire principal est le propène formé par déshydratation de l’alcool correspondant avec des aldéhydes et de l’oxyde de mésityle.
Le produit de déshydrogénation contenant des aldéhydes, de l’oxyde de mésityle, de l’eau et du 2-propanol avec de l’acétone est d’abord lavé avec de la soude caustique aqueuse à 35 % pour éliminer les aldéhydes, puis distillé en plusieurs étapes pour éliminer les chaudières légères et l’acétone de l’alcool et de l’eau.
1.3. Production d’acétone par oxydation du propène

Une méthode élégante de fabrication d’acétone est le procédé Wacker-Hoechst dans lequel le propène est oxydé avec de l’air ou de l’oxygène en acétone à 110–120 ° C et 10–14 bar.
Le procédé est caractérisé par l’utilisation d’un système catalytique constitué de PdCl2 et de CuCl2.
PdCl2 agit comme catalyseur et CuCl2 réoxyde Pd° à l’état bivalent. Le chlorure de cuivre (I) peut facilement être oxydé en chlorure de cuivre (II) avec de l’oxygène.
La sélectivité à l’acétone est de 92 % ; le propionaldéhyde est formé comme sous-produit avec des composés chlorés comme la monochloracétone et la 1,1-dichloroacétone.
Comme dans le procédé à l’acétaldéhyde, deux procédés différents d’oxydation directe sont possibles :
1. Le catalyseur est traité avec du propène et de l’oxygène en une seule étape.
2. Le catalyseur est traité avec du propène dans un premier temps et est ensuite régénéré dans un second temps avec de l’oxygène.
Le procédé en deux étapes est privilégié car un mélange propène-propane peut être utilisé comme alimentation. Le propane est inerte à l’oxydation et ne participe pas à la réaction.
2. Réactions chimiques de l'acétone
L’acétone pure est très sensible aux agents oxydants puissants comme le peroxyde d’hydrogène et les peroxydes organiques. En cas de peroxyde d’hydrogène et en présence d’acide dilué, un trimère de peroxyde d’acétone se forme.
L’acétone réagit avec les agents réducteurs puissants avec dégagement de chaleur et risque d’explosion.
De la chaleur est également libérée lorsque l’acétone réagit avec un alcali fort. Les mélanges d’acétone avec du chloroforme en présence d’alcali peuvent également réagir violemment.
La réactivité chimique de l’acétone est basée sur la liaison CO, dans laquelle l’atome d’oxygène attire les électrons de la double liaison. Cet effet peut être décrit par la structure mésomère du groupe carbonyle.
En raison de cette polarisation, l’attaque nucléophile sur l’atome C du groupe carbonyle est le mécanisme de réaction carbonyle le plus courant.
L’attaque nucléophile s’accompagne souvent d’une protonation de l’atome d’oxygène.
Un exemple typique d’une telle addition nucléophile est la formation de cyanohydrine d’acétone à partir de la réaction de l’acétone avec HCN en présence d’une base comme KOH. L’ion cyanure formé à partir de HCN et de KOH est responsable de l’attaque nucléophile.
L’addition de nucléophiles faibles peut être catalysée par des acides. La protonation de l’atome d’oxygène du groupe carbonyle entraîne la formation d’un carbocation, qui peut être plus facilement attaqué par le nucléophile.
Un exemple de réaction catalysée par un acide est celle d’un alcool avec l’acétone avec formation d’un hémicétal ou d’un cétal.
D’autres réactions nucléophiles connues de la littérature sont :
- Réaction avec les réactifs de Grignard (RmgX) avec formation d’alcools tertiaires.
- Réaction avec LiAlH4 ou NaBH4 formant du 2-propanol.
- Réaction avec les composés azotés. Une amine primaire forme une imine, l’hydroxylamine forme une oxime et l’hydrazine forme une hydrazone. Dans le cas de la phénylhydrazine, une phénylhydrazone se forme.
Une autre caractéristique de l’acétone est l’acidité de l’atome d’hydrogène a par rapport au groupe carbonyle. La présence du groupe carbonyle améliore la polarisation des électrons et conduit à un atome d’hydrogène plus électropositif. L’anion résultant est stabilisé par dislocation mésomérique de la charge négative entre l’atome de carbone et l’atome d’oxygène du carbonyle.
La formation d’alcool diacétonique par la réaction de deux molécules d’acétone en présence d’alcali est un exemple typique d’une réaction d’aldol catalysée par une base.
3. utilisations de l'acétone
L’acétone est principalement utilisé comme intermédiaire chimique dans la fabrication d’acétone cyanohydrine formethylmethacrylate (MMA), de bisphénol A et de produits chimiques aldol comme le diacétone alcool (DAA), l’oxyde de mésityle (MOX) et la méthyl isobutyl cétone (MIBK).
L’acétone est également utilisé comme solvant pour une multitude d’applications. La production mondiale d’acétone est supérieure à 6 millions de t/a.
En 2010, les applications directes de solvants représentaient 29 %, suivies par l’acétone cyanohydrine/MMA à 24 % et le bisphénol A à 22 %.
Référence
Acetone; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a01_079.pub4
