Acetaldehído: Propiedades, Reacciones y Usos
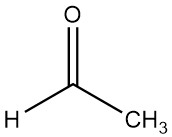
El acetaldehído (etanal), con la fórmula química CH3CHO, fue observado por primera vez por SCHEELE en 1774 cuando el dióxido de manganeso negro y el ácido sulfúrico reaccionaron con el alcohol. Su composición fue explicada posteriormente por LIEBIG en 1835, quien obtuvo acetaldehído puro oxidando etanol con ácido crómico.
El acetaldehído es un líquido volátil, de bajo punto de ebullición y altamente inflamable que se caracteriza por su fuerte olor.
Debido a su notable reactividad química, el acetaldehído desempeña un papel importante como intermediario en la fabricación de diversos compuestos, incluidos ácido acético, anhídrido acético, acetato de etilo, ácido peracético, butanol, 2-etilhexanol, pentaeritritol, acetaldehídos clorados (cloral), glioxal. , alquilaminas, piridinas y otras sustancias químicas.
Su aplicación comercial inicial implicó la producción de acetona mediante síntesis de ácido acético, que tuvo lugar entre 1914 y 1918 en Alemania (Wacker-Chemie y Hoechst) así como en Canadá (Shawinigan).
El acetaldehído también está presente en los procesos metabólicos de plantas y animales, aunque en pequeñas cantidades. Niveles más altos de acetaldehído pueden alterar los procesos biológicos.
Se encuentra naturalmente en pequeñas cantidades durante la fermentación alcohólica, lo que contribuye al sabor de bebidas como la cerveza, el vino y las bebidas espirituosas. Además, se ha detectado acetaldehído en jugos de plantas, aceites esenciales, café tostado y humo de tabaco.
Se emplean varios métodos comerciales para producir acetaldehído. Estos incluyen la deshidrogenación u oxidación de etanol, la adición de agua al acetileno, la oxidación parcial de hidrocarburos y la oxidación directa de etileno.
Table of Contents
2. Propiedades físicas del acetaldehído
El acetaldehído, de fórmula molecular C2H4O y masa molar de 44,054 g/mol, es un líquido transparente que se caracteriza por un olor fuerte y asfixiante. Cuando se diluye desprende un aroma ligeramente afrutado.
El acetaldehído es totalmente soluble en agua y en la mayoría de los disolventes orgánicos. No forma azeótropos con agua, metanol, etanol, acetona, ácido acético o benceno.
Sin embargo, forma azeótropos binarios con butano (punto de ebullición -7 °C, que contiene 84% en peso de butano) y éter dietílico (punto de ebullición 18,9 °C, que contiene 23,5% en peso de éter).
Algunas propiedades físicas del acetaldehído se enumeran a continuación:
- Punto de ebullición a 101,3 kPa = 20,16 °C
- Punto de fusión = -123,5 °C
- Temperatura crítica = 181,5 °C
- Densidad relativa (t) = 0,8045-0,001325.t (t en °C)
- Índice de refracción (t) = 1,34240-0,0005635.t (t en °C)
- Viscosidad del líquido a 20 °C = 0,21 mPa.s
3. Reacciones químicas y usos del acetaldehído
El acetaldehído es un compuesto notablemente reactivo que exhibe todas las reacciones características de los aldehídos, así como aquellas asociadas con un grupo alquilo en el que los átomos de hidrógeno se activan por la presencia de un grupo carbonilo en la posición α.
Cuando se calienta a temperaturas superiores a 420 °C, el acetaldehído se descompone, dando como resultado la formación de metano y monóxido de carbono.
3.1. Reacciones de adición
El acetaldehído reacciona fácilmente con el agua y forma un hidrato inestable. Sin embargo, se sabe que los hidratos sólidos aislables sólo existen con acetaldehídos clorados. Los alcoholes pueden agregarse al acetaldehído, produciendo hemiacetales que, en presencia de ácidos y la posterior eliminación de agua, pueden formar acetales cuando se combinan con alcohol adicional.
Los dioles conducen a la formación de acetales cíclicos. Por ejemplo, el etilenglicol y el acetaldehído producen 2-metil-1,3-dioxolano, mientras que el 1,3-propanodiol y el acetaldehído producen 2-metil-1,3-dioxano.

La reacción entre acetaldehído y una solución acuosa de bisulfito de sodio produce un aducto cristalino, a partir del cual se puede liberar acetaldehído.
El amoníaco seco reacciona con el acetaldehído, dando como resultado la formación de acetaldehído amoníaco cristalino.
El acetaldehído y el ácido cianhídrico reaccionan para producir lactonitrilo (α-hidroxipropionitrilo), que es un posible intermediario en la producción de acrilonitrilo.
La reacción entre acetaldehído y anhídrido acético produce diacetato de etilideno, un intermedio en el proceso de acetato de vinilo llevado a cabo por Celanese Corp.
3.2. Derivados de la adición aldólica
En presencia de catalizadores alcalinos o con un calentamiento suave, dos moléculas de acetaldehído se combinan para formar acetaldol. A temperaturas más altas, el agua se elimina fácilmente del acetaldol, lo que da lugar a la formación de crotonaldehído. Sin embargo, la importancia industrial de una mayor condensación para formar resinas aldehídicas, como por ejemplo goma laca sintética, ha disminuido.
La urea y el acetaldehído pueden condensarse en presencia de H2SO4, lo que lleva a la formación de crotonilidendiurea (6-metil-4-ureidohexahidropirimidin-2-ona), que se utiliza como fertilizante nitrogenado a largo plazo.

El acetaldehído sirve como intermediario en la síntesis de butadieno. Comienza con acetileno y continúa con acetaldol y su producto de hidrogenación, 1,3-butanodiol. Este proceso se introdujo a principios del siglo XX y todavía se practica a escala comercial en ciertos países de Europa del Este.
La acroleína se obtiene mediante la condensación aldólica de acetaldehído y formaldehído, seguida de eliminación de agua, similar a la formación de crotonaldehído. Sin embargo, este método carece de importancia comercial contemporánea. Por el contrario, la producción de pentaeritritol a partir de acetaldehído y una cantidad cuádruple de formaldehído en presencia de Ca(OH)2 o NaOH tiene una gran importancia industrial.
3.3. Reacción con compuestos de nitrógeno
Las aminas primarias reaccionan con acetaldehído para formar bases de Schiff, representadas como CH3CH=NR. Los compuestos de nitrógeno como hidroxilamina, hidrazina, fenilhidrazina y semicarbazida pueden reaccionar con acetaldehído, produciendo compuestos fácilmente cristalizables que se utilizan para la determinación analítica y caracterización de aldehídos.
Los ejemplos incluyen semicarbazona (pf 162 – 163 °C), p-nitrofenilhidrazona (pf 128,5 °C), 2,4-dinitrofenilhidrazona (pf 168 °C) y oxima (pf 47 °C).
Se pueden emplear métodos similares para la caracterización de otros aldehídos y cetonas, ya que sus derivados análogos generalmente poseen puntos de fusión distintos y bien definidos.
La síntesis de piridina y derivados de piridina ha adquirido una importancia cada vez mayor. La 5-etil-2-metilpiridina se puede obtener haciendo reaccionar amoníaco acuoso con acetaldehído en presencia de iones fluoruro. También se puede utilizar paraldehído, que libera gradualmente el monómero. Se forma una mezcla de piridina y alquilpiridinas en presencia de formaldehído o acroleína.

3.4. Oxidación
Una parte importante del acetaldehído producido comercialmente se emplea en la fabricación de ácido acético mediante oxidación con oxígeno o aire.
El monooperacetato de acetaldehído es un producto intermedio que se descompone en ácido peracético y acetaldehído a temperaturas elevadas y en presencia de cantidades catalíticas de sales de hierro o cobalto. En presencia de sales de Mn2+, el ácido acético se puede obtener a partir del monooperacetato de acetaldehído. Además, se puede formar anhídrido acético empleando sales de Co2+ y Cu2+.

La oxidación con ácido nítrico da como resultado la formación de glioxal, mientras que los acetaldehídos halogenados se pueden preparar mediante halogenación.
Los mono, di y tricloroacetaldehído, así como el tribromoacetaldehído (bromal), encuentran utilidad en la producción de insecticidas (p. ej., DDT, DDD), productos farmacéuticos y colorantes.
3.5. Reducción
El acetaldehído se puede hidrogenar fácilmente para producir etanol. Antes de 1939, cuando el etileno producido petroquímicamente estuvo disponible en Europa, esta reacción se empleaba industrialmente para producir etanol a partir de acetaldehído y, en consecuencia, a partir de acetileno.
La monoetilamina, dietilamina y trietilamina se pueden sintetizar a partir de acetaldehído, amoníaco e hidrógeno en presencia de un catalizador de hidrogenación. Para obtener más información, consulte la producción de aminas alifáticas.
3.6. Reacciones varias
La reacción de Tishchenko del acetaldehído, catalizada por alcoholato de aluminio, da como resultado la producción del disolvente comercialmente importante acetato de etilo.
El acetaldehído sirve como «agente atrapador de radicales» en la polimerización de compuestos vinílicos, controlando la longitud de la cadena de los polímeros.
3.7. Polímeros de acetaldehído
3.7.1. paraldehído
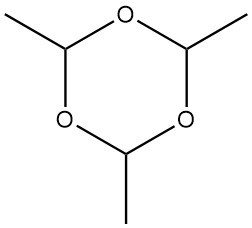
El paraldehído, 2,4,6-trimetil-1,3,5-trioxano con un peso molecular de 132,161, es un trímero cíclico de acetaldehído. Posee una apariencia incolora y emite un olor etéreo y penetrante.
El paraldehído se puede sintetizar a partir de acetaldehído en presencia de catalizadores ácidos, como ácido sulfúrico, ácido fosfórico, ácido clorhídrico o intercambiadores de cationes ácidos. En una reacción homogénea, se añade acetaldehído a paraldehído que contiene una pequeña cantidad de ácido sulfúrico mientras se agita y se enfría.
Una vez finalizado, la agitación continúa para establecer el equilibrio y el ácido sulfúrico se neutraliza precisamente utilizando una sal de sodio como acetato de sodio, carbonato de sodio o bicarbonato de sodio. La destilación fraccionada separa la mezcla de reacción en acetaldehído, agua y paraldehído.
Para la producción continua, se hace pasar acetaldehído líquido a temperaturas de 15 a 20 °C o vapor de acetaldehído a temperaturas de 40 a 50 °C a través de un intercambiador de cationes ácido, logrando una tasa de conversión superior al 90 %. Luego se emplea la destilación para separar el acetaldehído del paraldehído.
La despolimerización implica una destilación lenta de acetaldehído en presencia de catalizadores ácidos. Alternativamente, el paraldehído se puede descomponer en fase gaseosa utilizando catalizadores como HCl, HBr, H3PO4 o intercambiadores de cationes. La reacción de despolimerización sigue una velocidad de primer orden.
El paraldehído encuentra aplicaciones en la síntesis química como fuente de acetaldehído, eliminando la formación de resina y otras reacciones secundarias. Esta síntesis se utiliza en la producción de piridinas y la cloración del cloral.
Entre 1939 y 1945, el paraldehído se utilizó como combustible para motores.
3.7.2. metaldehído

El metaldehído es el tetrámero cíclico del acetaldehído. Forma prismas tetragonales con un punto de fusión de 246,2 °C (capilar cerrado) y una temperatura de sublimación de 115 °C. El calor de combustión a volumen constante es 3370 kJ/mol.
El metaldehído es insoluble en agua, acetona, ácido acético y disulfuro de carbono.
La despolimerización del metaldehído a acetaldehído comienza a 80 °C y se completa por encima de 200 °C. En el proceso de despolimerización se utilizan catalizadores ácidos como H2SO4 o H3PO4 diluidos.
El metaldehído no presenta la reactividad típica del acetaldehído. Está estabilizado por carbonato de amonio u otros compuestos débilmente básicos que neutralizan los posibles catalizadores ácidos.
El metaldehído se obtiene, junto con cantidades significativas de paraldehído, durante la polimerización de acetaldehído en presencia de HBr y bromuros de metales alcalinotérreos como CaBr2 a temperaturas inferiores a 0 °C.
Sin embargo, los rendimientos rara vez superan el 8%. Se han informado rendimientos más altos del 14 al 20 % cuando está presente del 7 al 15 % de un éter alifático o cíclico a temperaturas que oscilan entre 0 y 20 °C. A continuación se filtra el metaldehído insoluble.
A continuación, el acetaldehído se destila del filtrado después de la despolimerización del paraldehído y se puede reciclar de nuevo al proceso de polimerización. Sin embargo, este reciclaje de grandes cantidades de acetaldehído conduce a mayores costes de proceso debido a las pérdidas.
El metaldehído en forma de pellets está disponible comercialmente como combustible seco (Meta). Cuando se combina con cebo, el metaldehído se utiliza como molusquicida.
3.7.3. Poliacetaldehído
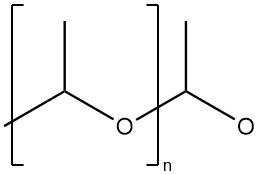
El poliacetaldehído es un polímero de alta masa molecular con estructura de acetal (estructura de polioximetileno).
Utilizando iniciadores catiónicos se obtiene principalmente un polímero amorfo. En este caso se prefieren temperaturas inferiores a -40 °C. Por encima de -30 °C se producen principalmente paraldehído y metaldehído.
La actividad del iniciador también depende del disolvente utilizado. Los iniciadores adecuados incluyen H3PO4 en éter y pentano, así como HCl, HNO3, CF3COOH, AlCl3 en éter y particularmente BF3 en etileno líquido. Al2O3 y SiO2 también parecen ser buenos iniciadores.
El polímero tiene una consistencia similar al caucho y es soluble en disolventes orgánicos comunes. Se despolimeriza a temperatura ambiente liberando acetaldehído. Se evapora completamente en unos pocos días o semanas. Los compuestos ácidos aceleran la despolimerización y las aminas (p. ej., piridina) estabilizan el poliacetaldehído hasta cierto punto.
3.8. Consumo
En Estados Unidos, a partir de 1993, el acetaldehído dejó de utilizarse en los procesos de fabricación de ácido acético, butanol y 2-etilhexanol, ya que ahora se emplean métodos alternativos para su producción.
Sin embargo, ha aumentado la demanda de acetaldehído para otras sustancias como el ácido peracético y las bases piridinas.
Consumo de acetaldehído (t) en 2003
| Productos | Consumo (t) |
|---|---|
| Ácido acético/anhídrido acético | 147.000 |
| Ésteres de acetato | 321.000 |
| Pentaeritritol | 80.000 |
| Piridina y bases piridinas | 83.000 |
| Ácido peracético | 23.000 |
| 1,3-butilenglicol | 14.000 |
| Otros | 98.000 |
Referencia
- Acetaldehyde; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a01_031.pub2
