Aminofenol: Producción, Reacciones y Usos

Los aminofenoles han ido ganando importancia comercial significativa, tanto como sustancias independientes como componentes cruciales en los sectores químico y de tintes.
Estos compuestos poseen propiedades anfóteras que muestran características de ácidos débiles o bases débiles, prevaleciendo típicamente la naturaleza básica.
En particular, el 2-aminofenol y el 4-aminofenol pueden oxidarse fácilmente, una característica que contribuye a sus aplicaciones principales como reveladores fotográficos. Sin embargo, el 3-aminofenol permanece relativamente estable cuando se expone al aire y no se oxida.
Tabla de contenido
1. Propiedades físicas de los aminofenoles
Las estructuras básicas de aminofenol existen en tres configuraciones isoméricas distintas, determinadas por la disposición espacial de los grupos hidroxilo y amino adyacentes al anillo de benceno. Estos compuestos normalmente se solidifican en estructuras cristalinas a temperatura ambiente normal.
Los compuestos de aminofenol disponibles en el mercado suelen ser impuros debido a una posible contaminación por subproductos de oxidación. Como resultado, pueden exhibir tonos que van desde el amarillo-marrón hasta el rosa-púrpura, siendo el 2 y 4-aminofenol más vulnerables a esta alteración del color en comparación con el 3-isómero.
1.1. Propiedades físicas del 2-aminofenol
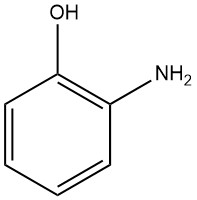
El 2-aminofenol, también conocido como 2-hidroxianilina o 2-amino-1-hidroxibenceno, tiene la fórmula química C6H7NO, una masa molar de 109,13 g/mol. Cuando cristaliza en agua o benceno, forma agujas bipiramidales ortorrómbicas blancas.
El punto de fusión de estos cristales es de 174°C y su densidad es de aproximadamente 1,328 g/cm3 (en algunas fuentes también se menciona 1,29 g/cm3). Bajo presión reducida (1,47 kPa), el 2-aminofenol se sublima rápidamente a 153°C sin descomposición.
En cuanto a sus propiedades ácido-base, las constantes de disociación son las siguientes: pK1 es 4,72 a 21°C en agua, y 4,66 a 25°C en una solución de etanol al 1% en agua; pK2 es 9,66 a 15°C y 9,71 a 22°C en agua.
El compuesto puede formar varias sales, incluida la sal clorhidrato, que aparece en forma de agujas y tiene un punto de fusión de 207°C; la sal formiato, que funde a 120°C; la sal de oxalato, que se descompone a 167,5°C; y la sal acetato, que funde a 150°C.
El 2-aminofenol es muy soluble en acetona, acetonitrilo, dimetilsulfóxido, etanol y acetato de etilo, soluble en agua caliente y éter dietílico y ligeramente soluble en cloroformo, benceno, tolueno y agua fría.
1.2. Propiedades físicas del 3-aminofenol

El 3-aminofenol, también conocido como 3-hidroxianilina o 3-amino-1-hidroxibenceno, tiene la fórmula química C6H7NO con una masa molar de 109,13 g/mol. Este compuesto forma prismas blancos al cristalizar en agua o tolueno, y su punto de fusión oscila entre 122 y 123°C.
Los cristales ortorrómbicos exhiben una disposición tetramolecular y poseen una densidad de aproximadamente 1,195 g/cm3 (también se han informado valores alternativos de 1,206 y 1,269). Cuando se somete a presión reducida (1,47 kPa), el 3-aminofenol hierve a 164°C con ligera descomposición.
En cuanto a sus propiedades ácido-base, las constantes de disociación son las siguientes: pK1 es 4,17 a 21°C en agua y 4,31 a 25°C en una solución que contiene etanol acuoso al 1%; pK2 es 9,87 a 22°C en agua.
El 3-aminofenol puede formar diversas sales, incluida la sal clorhidrato, que toma forma de prismas y se funde a 229°C; la sal bromhidrato, también prismática, con un punto de fusión de 224°C; la sal yodhidrato, también prismática, con un punto de fusión de 209°C; la sal sulfato se presenta en forma de placas o agujas y se funde a 152°C; y la sal de oxalato, con un punto de fusión de 275°C.
El 3-aminofenol es muy soluble en acetona, acetonitrilo, dimetilsulfóxido, etanol, acetato de etilo y agua caliente, soluble en agua fría y éter dietílico y ligeramente soluble en cloroformo, benceno y tolueno.
1.3. Propiedades físicas del 4-aminofenol
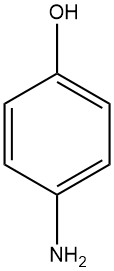
El 4-aminofenol, conocido como 4-hidroxianilina o 4-amino-1-hidroxibenceno, tiene una fórmula química de C6H7NO con un peso molecular de 109,13 g/mol. Toma la forma de placas blancas al cristalizar en agua y tiene un rango de fusión de 189 a 190°C (se produce descomposición).
Los cristales existen en dos formas distintas. La forma «α» más estable (obtenida del alcohol, agua o acetato de etilo) tiene una estructura piramidal ortorrómbica con cuatro moléculas dentro de cada celda unitaria. Tiene una densidad de aproximadamente 1,290 g/cm3 (alternativamente, se informa 1,305 g/cm3).
La forma «β» menos estable (cristalización en acetona) se presenta como cristales aciculares, que se convierten a la forma «α» con el tiempo. Los cristales de la forma «β» son bipiramidales o piramidales ortorrómbicos y exhiben una disposición hexamolecular.
A presión reducida (40 Pa), el 4-aminofenol se sublima a 110°C con ligera descomposición. Los puntos de ebullición bajo diversas presiones son los siguientes: 284 °C (101,3 kPa), 174 °C (1,47 kPa), 167 °C (1,07 kPa), 150 °C (0,4 kPa) y 130,2 °C (0,04 kPa). generalmente ocurre descomposición.
Las constantes de disociación ácido-base para este compuesto son las siguientes: pK1 es 5,50 a 21°C en agua, 4,86 a 30°C en agua y 5,48 en una solución que contiene etanol acuoso al 1% a 25°C; pK2 es 10,30 a 22°C en agua y 10,60 a 30°C en agua.
Se pueden formar varias sales de 4-aminofenol, incluida la sal clorhidrato, que se presenta como prismas y sufre descomposición al alcanzar los 306°C; la sal hidrosulfato, que aparece como agujas con un punto de fusión de 272°C; la sal de oxalato, que funde a 183°C; la sal acetato, que funde a 183°C; la sal de cloroacetato forma agujas con un punto de fusión de 148°C; y la sal tricloroacetato, en forma de agujas con un punto de fusión de 166°C.
El 4-aminofenol es muy soluble en dimetilsulfóxido, soluble en acetona, acetonitrilo, acetato de etilo y agua caliente y éter dietílico, ligeramente soluble en etanol, éter dietílico, tolueno y agua fría e insoluble en benceno y cloroformo.
2. Reacciones químicas de los aminofenoles
Las discusiones detalladas sobre los atributos químicos y las respuestas de los aminofenoles están ampliamente documentadas en referencias establecidas en el campo. Aquí se proporciona una descripción concisa.
La presencia de un grupo amino en el anillo de benceno suprime la acidez de los fenoles, siendo el 4-aminofenol el que muestra el efecto más pronunciado. Los aminofenoles actúan como bases débiles, formando sales con ácidos tanto orgánicos como inorgánicos.
Los aminofenoles son anfolitos sin estructura de zwitterión. Existen como moléculas neutras, cationes de amonio o aniones de fenolato según el pH de la solución.

Sin embargo, las desviaciones de las curvas teóricas de titulación ácido-base han llevado a la hipótesis de cationes complejos de media sal B2+, formados al asociar un catión de amonio, B+, con una molécula neutra, B. Este fenómeno es especialmente notable en el 4-aminofenol y es también demostrado por otros isómeros.
Los aminofenoles son químicamente reactivos y participan en reacciones que involucran tanto al grupo amino aromático como al resto hidroxilo fenólico, así como en la sustitución del anillo de benceno.
La oxidación conduce al desarrollo de estructuras quinoides poliméricas de colores vibrantes. El 2-aminofenol sufre una serie de reacciones de ciclación.
2.1. Alquilación de aminofenoles
Se pueden formar todos los aminofenoles mono, di y trimetilados. La monoalquilación se produce al calentar el aminofenol con un haluro de alquilo apropiado, un alcohol en presencia de níquel Raney o aldehídos y cetonas como alternativas al alcohol.
La alquilación directa del grupo hidroxilo para producir metoxianilinas (anisidinas) o etoxianilinas (fenetidinas) es compleja debido a la reactividad del grupo amino, y a menudo produce productos alquilados mixtos.
La metilación del 3-aminofenol en condiciones alcalinas produce 3-metoxianilina, aunque un enfoque más común implica la protección del grupo amino seguida de la metilación de 3-acetilanilinas y la posterior hidrólisis.
Otras anisidinas y fenetidinas suelen producirse indirectamente mediante reducción de análogos nitro:

2.2. Acilación de aminofenoles
La acilación de aminofenoles, empleando anhídrido acético en álcali o piridina, cloruro de acetilo y piridina en tolueno o cetena en etanol, generalmente produce productos N-acilados. El uso excesivo de reactivos, especialmente con 2-aminofenol, conduce a productos O,N-diacilados.
Los aminofenilcarboxilatos (aminofenoles O-acilados) se producen normalmente mediante la reducción de los correspondientes nitrofenilcarboxilatos, un proceso de particular importancia para los derivados de 4-aminofenol.
La migración del grupo acilo de las posiciones O a N se observa en productos acilados tanto con 2 como con 4-aminofenol.
Un ejemplo de reordenamiento es la formación de carbamato de 2-hidroxifenilo mediante el tratamiento lento de carbonato de 2-aminofeniletilo en ácido diluido. Las derivadas para no muestran ninguna transformación.

2.3. Formación de sal de diazonio
Los grupos amino aromáticos de los aminofenoles se pueden convertir en sales de diazonio mediante tratamiento con nitrito de sodio en condiciones acuosas ácidas. Pueden surgir desafíos con los aminofenoles fácilmente oxidables o escasamente solubles.
Las sales cristalinas de diazonio se aíslan utilizando formas de clorhidrato o sulfato del correspondiente aminofenol en condiciones anhidras. Estos derivados diazo encuentran un uso generalizado en la industria de los tintes.
2.4. Reacciones de ciclación de aminofenoles
Debido a la estrecha proximidad de los grupos amino e hidroxilo en el 2-aminofenol, este isómero es especialmente susceptible a reacciones de ciclación y condensación. La oxidación con cloruro de hierro (III), enzimas, luz o autooxidación sobre placas de capa fina de sílice produce 2-aminofenoxazin-3-ona (4).
La oxidación posterior con cianuro de hierro (III) o el calentamiento con hidróxido de potasio en etanol genera una estructura de cinco anillos, trifenoxdioxazina (benzoxazinofenoxazina) (5).

El 2-aminofenol y sus derivados sirven como materiales de partida valiosos para sintetizar fenoxazonas, fenoxazinas, benzoxazoles y tiobenzoxazoles, y la mayoría de estas reacciones implican calentamiento a 200 – 300 °C con un catalizador apropiado.
2.5. Reacciones de condensación
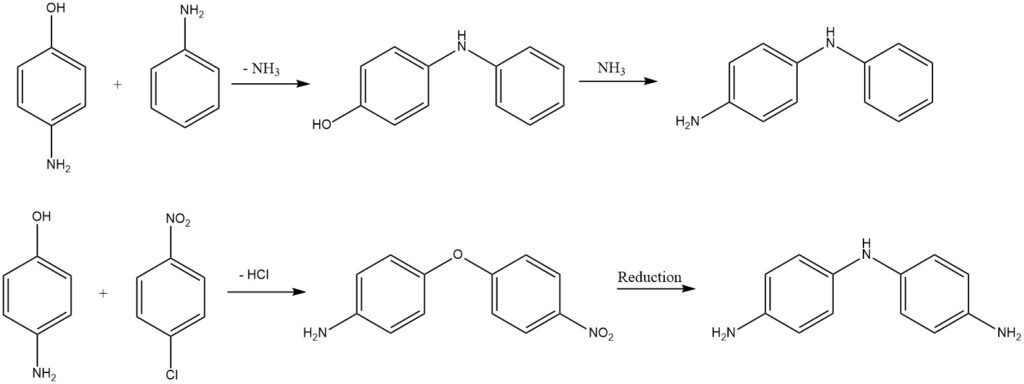
Las difenilaminas sustituidas o los éteres de difenilo se obtienen a partir de aminofenoles mediante eliminación de amoníaco o cloruro de hidrógeno.
2.6. Reacciones del anillo de benceno
Tanto el grupo amino como el hidroxilo funcionan como restos donadores de electrones, lo que lleva a la formación de diversos derivados sustituidos. Las interacciones controladas entre los aminofenoles y el cloro o el bromo en el ácido acético glacial producen un espectro de productos halogenados.
El ácido sulfúrico concentrado u oleum, con o sin calor, genera ácidos sulfónicos aromáticos. El grupo ácido sulfónico entra predominantemente en las posiciones orto o para con respecto al grupo hidroxilo. Un tratamiento adicional con oleum da como resultado compuestos disulfonados.
La carboxilación del m-aminofenol produce ácido p-aminosalicílico.
3. Producción de Aminofenoles
Los aminofenoles se sintetizan mediante dos rutas principales: reducción de nitrofenoles o reacciones de sustitución. La reducción se puede lograr utilizando hierro o hidrógeno en presencia de un catalizador. Hoy en día, este último método es la opción preferida para producir 2- y 4-aminofenol.
3.1. Reducción de compuestos nitro
3.1.1. Reducción de hierro
La reducción de nitrofenoles mediante virutas de hierro se produce en una solución o suspensión ligeramente ácida. Después de la reducción, el lodo de hierro-óxido de hierro se separa de la solución. Para mejorar la solubilidad en agua, se agrega hidróxido de sodio, lo que produce aminofenolato de sodio.
Debido a la susceptibilidad a la oxidación en solución acuosa, se recomiendan varios métodos de purificación. Posteriormente, los aminofenoles se precipitan a partir de soluciones ácidas mediante neutralización básica, mientras que a menudo se incorporan agentes reductores.
Sin embargo, la reducción del 2-nitrofenol con hierro genera lacas de color insolubles como subproductos, disminuyendo el rendimiento. Como resultado, la importancia industrial de la reducción de hierro para el 2-nitrofenol es limitada.
3.1.2. Reducción Catalítica
La reducción catalítica se produce principalmente en solución, emulsión o suspensión dentro de autoclaves o recipientes presurizados. Después de la adición del catalizador, se introduce hidrógeno presurizado en el recipiente. Los disolventes preferidos incluyen agua y metanol, complementándose el agua con hidróxido alcalino, carbonato alcalino o ácido.
Se emplean catalizadores como níquel, en particular níquel Raney, o metales preciosos soportados como platino o paladio sobre carbón activo o sus óxidos.
Agregar solventes orgánicos inmiscibles al agua puede extender la vida útil del catalizador, disminuir el consumo y mejorar la calidad del producto.
Normalmente, una presión de hidrógeno de 2 MPa es óptima, aunque se pueden utilizar presiones atmosféricas o superiores, de hasta 6 MPa. Las temperaturas de reacción se mantienen por debajo de 100 – 110 °C.
3.1.3. Reducción de nitrobenceno
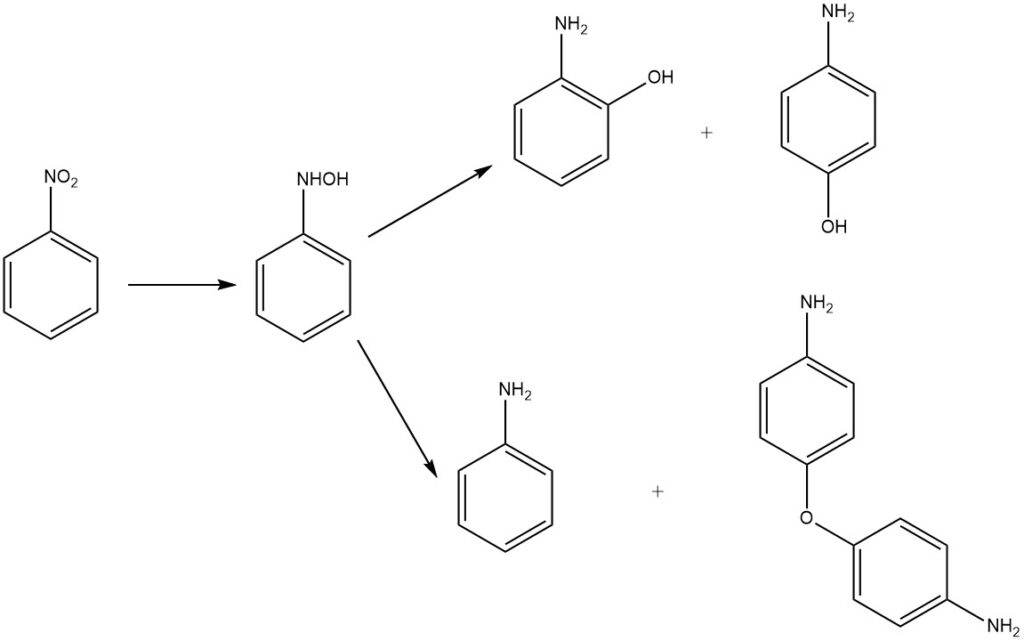
La reducción del nitrobenceno en medio ácido produce 2- y 4-aminofenol mediante la transposición del intermedio fenilhidroxilamina. El producto principal es el 4-aminofenol, junto con los subproductos 2-aminofenol, anilina y 4,4′-diaminodifenil éter.
Históricamente, los metales en ácido sulfúrico diluido sirvieron como agentes reductores. Actualmente se emplean hidrógeno y catalizadores de metales preciosos como paladio o platino. Los catalizadores adicionales incluyen sulfuro de molibdeno y platino y un catalizador mixto de platino y rutenio, a menudo en forma de óxido o soportado sobre carbón activado.
El ácido mineral acuoso diluido actúa como medio de reacción, y un proceso de dos pasos que involucra cobre Raney reduce selectivamente el nitrobenceno a fenilhidroxilamina, que se reorganiza en 4-aminofenol tras la adición de ácido sulfúrico diluido.
Los agentes humectantes, particularmente las sales de amonio cuaternario con grupos alquilo considerables, aumentan el rendimiento de aminofenol. Normalmente, la reacción se produce por debajo de 100 °C y puede utilizar presión atmosférica o superior. La adición de hidrógeno se produce a medida que se consume y los disolventes orgánicos inertes pueden aumentar los rendimientos.
En un método alternativo, la reducción del nitrobenceno se detiene al 88%, creando una mezcla de dos fases que contiene nitrobenceno sin reaccionar y el catalizador de metal precioso. Para el procesamiento es suficiente una separación de fases, recirculándose la fase de nitrobenceno.
La fase acuosa de ácido sulfúrico contiene 4-aminofenol y anilina, que se elimina tras la neutralización. La purificación y cristalización producen 4-aminofenol.
3.1.4. Reducción electrolítica
La reducción electrolítica ofrece una alternativa menos contaminante a los sistemas de metal-ácido, pero su implementación industrial sigue siendo limitada. La electrólisis de nitrobenceno, fenilhidroxilamina o azoxibenceno en soluciones ácidas produce específicamente 4-aminofenol.
3.2. Sustitución
La sustitución de grupos amino o hidroxilo en lugar de otros grupos diversos no tiene importancia industrial significativa para la producción de 2- y 4-aminofenol. Sin embargo, este tipo de reacción resulta útil en la síntesis de derivados de 2 y 4-aminofenol.
Por el contrario, la ruta de reducción sencilla no produce fácilmente 3-aminofenol. Su producción implica principalmente la reacción entre el ácido 3-aminobencenosulfónico y el hidróxido de sodio o la reacción del resorcinol con amoníaco.
La sustitución del grupo ácido sulfónico en el ácido 3-aminobencenosulfónico se logra mediante un proceso de fusión con sosa cáustica (que dura de 5 a 6 horas a 240 a 245 °C), seguido de destilación al vacío para purificar el producto.
Un método alternativo implica la reacción de resorcinol con amoníaco, potencialmente en presencia de fosfato diamónico y pentóxido de arsénico o sulfito de amonio, lo que da como resultado la formación de 3-aminofenol.
Además, se puede obtener 3-aminofenol mediante hidrólisis de 3-aminoanilina.
3.3. Purificación de Aminofenoles
Los aminofenoles se purifican por sublimación a temperaturas elevadas y presión reducida.
Para el 3-aminofenol, la destilación al vacío es un método de purificación adecuado, donde la adición de dióxido de azufre durante la destilación o la recogida del destilado bajo una capa de un líquido inerte de menor densidad, como el agua, ayuda a obtener un producto incoloro.
Un enfoque de purificación alternativo implica tratar las soluciones acuosas de aminofenoles con carbón activado. Durante este proceso, la inclusión de sustancias como sulfito de sodio, ditionito de sodio o etilendiaminotetraacetato de disodio sirve para mejorar la calidad y estabilidad de los productos al tiempo que quela iones de metales pesados que podrían facilitar la oxidación.
También se recomienda la adición de ditionito de sodio, hidracina o hidrosulfito de sodio durante la precipitación o cristalización de aminofenoles.
Para los aminofenoles, particularmente el 4-aminofenol producido por reducción catalítica, los contaminantes a menudo pueden reducirse o eliminarse empleando diversos procedimientos. Estos métodos incluyen el tratamiento con 2-propanol, cetonas alifáticas, cicloalifáticas o aromáticas, aminas aromáticas, tolueno o acetatos de alquilo de bajo peso molecular, así como el uso de ácido fosfórico, ácido hidroxiacético, ácido hidroxipropiónico o ácido cítrico.
La extracción con cloruro de metileno, cloroformo o nitrobenceno también puede ser eficaz para mitigar o eliminar contaminantes.
4. Usos de los aminofenoles
Tanto el 2-aminofenol como el 4-aminofenol son potentes agentes reductores, lo que los hace valiosos como reveladores fotográficos, reconocidos por nombres comerciales como Atomal y Ortol para el 2-aminofenol, y Activol, Azol, Certinal, Citol, Paranol, Rodinal, Unal y Ursol P para 4-aminofenol.
Estas sustancias encuentran aplicación individualmente o junto con la hidroquinona. La forma de oxalato del 4-aminofenol se comercializa con el nombre comercial Kodelon.
La versatilidad de los aminofenoles los convierte en intermediarios esenciales en la síntesis de casi todos los tipos de tintes y tintes. Además, el 2-aminofenol se emplea específicamente para realzar los tonos del cuero, la piel y el cabello, desde tonos grises y marrones hasta tonos marrón amarillentos.
Para diversos fines, el 3-aminofenol sirve como colorante para el cabello y agente acoplante en formulaciones de tintes para el cabello. Mientras tanto, el 4-aminofenol es parte integral de la síntesis farmacéutica, ya que contribuye a la producción de tintes para madera que otorgan un tinte rosado a la madera y actúa como agente teñido de pieles y plumas.
Dada la estrecha proximidad de los grupos amino e hidroxilo en el anillo de benceno, junto con su predisposición a la condensación con reactivos apropiados, el 2-aminofenol es un precursor clave en la síntesis de sistemas heterocíclicos como oxiquinolinas, fenoxaminas y benzoxazoles que se utilizan como inhibidores de la inflamación. inhibidores.
Respecto al 3-aminofenol, sus aplicaciones abarcan la estabilización de termoplásticos que contienen cloro, aunque su función principal es la de ser un intermediario para la producción de ácido 4-amino-2-hidroxibenzoico, un agente tuberculostático.
De manera similar, los derivados de 4-aminofenoles sustituidos con nitrógeno han sido reconocidos desde hace mucho tiempo por sus propiedades antipiréticas y analgésicas, lo que contribuye significativamente a la utilización del 4-aminofenol.
5. Toxicología de los aminofenoles
Los aminofenoles se clasifican como irritantes. Su clasificación de toxicidad varía de leve a moderada; sin embargo, la exposición prolongada o repetitiva puede provocar diversos efectos adversos, como picazón general, sensibilización de la piel, dermatitis y respuestas alérgicas.
La exposición al 2- y 4-aminofenol puede provocar la producción espontánea de conjugados inmunogénicos. Otra posible preocupación es la formación de metahemoglobina, lo que provoca cianosis.
La inhalación de 4-aminofenol puede desencadenar esta reacción y también provocar asma bronquial. En particular, el 3-aminofenol presenta un riesgo menor en comparación con los otros isómeros. La irritación causada por los derivados sulfonados es más leve en comparación con los compuestos no sulfonados.
El 2-aminofenol tiene propiedades neuroactivas e induce descargas puntuales cuando se introduce en el cerebroventrículo de las ratas. Por otro lado, el 4-aminofenol es nefrotóxico e inhibe significativamente la función tubular proximal.
En las mitocondrias del riñón de rata, el 4-aminofenol inhibe la respiración, la fosforilación oxidativa y la actividad ATPasa. Si bien el 3-aminofenol no es tan peligroso, tanto el 2-aminofenol como el 4-aminofenol presentan efectos teratogénicos en los hámsteres.
El impacto del 4-aminofenol se extiende a la inhibición de la síntesis de ADN y a la alteración de la estructura del ADN en los linfoblastos humanos. Además, los aminofenoles han sido identificados como agentes genotóxicos, como lo demuestra la inducción de intercambios de cromátidas hermanas y pruebas de micronúcleos.
Claramente, es esencial manipular estos compuestos con precaución y se debe minimizar la exposición prolongada. Se recomienda quitarse rápidamente la ropa contaminada y lavar minuciosamente la zona afectada con agua corriente durante un mínimo de 10 minutos.
Referencias
- Aminophenols; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a02_099
- Aminophenols; Kirk-Othmer Encyclopedia of Chemical Technology. – https://onlinelibrary.wiley.com/doi/abs/10.1002/0471238961.0113091413092003.a01.pub2
