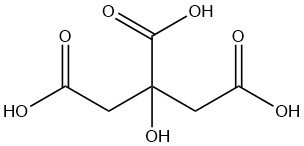
El ácido cítrico es un ácido orgánico débil que se encuentra naturalmente en las frutas cítricas, especialmente en los limones y las limas. Es un sólido cristalino incoloro a temperatura ambiente con la fórmula C6H8O7.
El ácido cítrico, un ácido tricarboxílico, fue obtenido inicialmente y cristalizado en 1784 por SCHEELE, mediante precipitación de citrato de calcio con lima del jugo de limón. Los tres grupos carboxilo y uno hidroxilo de la molécula fueron identificados por LIEBIG en 1838.
En el Reino Unido, el ácido cítrico se preparó por primera vez a partir de citrato de calcio en 1860, y en 1880, su producción a partir de citrato de calcio había comenzado en Francia, Alemania y Estados Unidos.
Las frutas cítricas son fuentes abundantes de ácido cítrico, y las frutas contienen entre un 5% y un 9% de ácido cítrico en el jugo. Además, el ácido cítrico está presente en varias otras frutas y se encuentra en casi todas las especies de plantas y animales.
El ciclo del ácido cítrico, también llamado ciclo de Krebs o ciclo del ácido tricarboxílico, es crucial en la oxidación de azúcares y acetatos a dióxido de carbono y agua, liberando energía para funciones fisiológicas.
Tabla de contenido
1. Producción de ácido cítrico
El ácido cítrico se obtiene tradicionalmente a partir de cítricos inmaduros desde hace aproximadamente 50 años.
En el sur de Italia se dedicó a este fin toda una industria con huertos e instalaciones de procesamiento. El procedimiento consistió en exprimir el jugo de frutas verdes y mezclarlo con cal (CaO) para precipitar el citrato de calcio.
Luego se trató el sólido con ácido sulfúrico para precipitar el sulfato de calcio y formar una solución a partir de la cual se cristalizó el ácido cítrico.
El rendimiento de producto purificado fue de aproximadamente 2-3% en peso de fruta y también se obtuvieron aceites cítricos. Sin embargo, este método ahora ha sido reemplazado por la fermentación.
1.1. Producción de ácido cítrico por fermentación
La fermentación ha sido el método más rentable para producir ácido cítrico desde la década de 1930. En este proceso se emplean cepas de A. niger para convertir los carbohidratos en ácido cítrico.
Tanto la fermentación superficial como la fermentación sumergida se utilizan en plantas de producción a gran escala.
Algunas plantas más pequeñas utilizan fermentación en estado sólido basada en carbohidratos presentes en desechos o subproductos agrícolas.
Los procesos bioquímicos que conducen a la excreción de ácido cítrico han sido objeto de estudio por parte de numerosos investigadores durante más de un siglo.
El rendimiento teórico de monohidrato de ácido cítrico a partir de 100 kg de sacarosa es de 123 kg o 112 kg de ácido anhidro. Sin embargo, en el proceso de fermentación, A. niger utiliza algo de azúcar para crecer y respirar, lo que da como resultado un rendimiento industrial real inferior al rendimiento teórico.
El rendimiento varía entre el 60 y el 85% del teórico, dependiendo de factores como la pureza del sustrato, la cepa específica de A. niger y el control de la fermentación.
1.1.1. Fermentación en estado sólido
La fermentación en estado sólido para la producción de ácido cítrico implica esparcir en zanjas un residuo agrícola que contiene carbohidratos y humedecerlo con agua.
Se pueden utilizar como sustratos potenciales para la producción de ácido cítrico diversos residuos agrícolas, como orujo de manzana, bagazo de yuca, cáscara de café, mazorcas de maíz, orujo de uva, desechos de kiwi, okara, naranja, piña y caña de azúcar.
Se pueden agregar nutrientes al agua para favorecer el crecimiento microbiano. Luego se inocula la zanja con una cepa de Aspergillus adecuada capaz de convertir los carbohidratos en ácido cítrico.
Una vez agotados los carbohidratos, el medio se lava con agua para extraer ácido cítrico. Luego, el ácido cítrico se somete a un proceso adecuado de recuperación y purificación.
1.1.2. Fermentación superficial
La fermentación superficial es un método ampliamente utilizado para la producción de ácido cítrico, que implica el crecimiento de Aspergillus niger sobre un sustrato líquido en recipientes apilados verticalmente dentro de una cámara esterilizada.
El sustrato de fermentación, normalmente melaza o jarabe de azúcar, contiene una concentración variable de azúcar y se añaden nutrientes inorgánicos, como nitrato de amonio, fosfato de potasio, sulfato de magnesio, sulfato de zinc y ferrocianuro de potasio.
El pH se ajusta entre 3 y 7 dependiendo de la fuente de carbohidratos. La inoculación del sustrato estéril se realiza con esporas de A. niger, que germinan y forman una estera de moho sobre la superficie del líquido. Después de dos o tres días, comienza la producción de ácido cítrico y continúa a un ritmo constante hasta que se haya consumido aproximadamente entre el 80 y el 90 % del azúcar.
La fermentación avanza lentamente durante cuatro a diez días más antes de vaciar los recipientes y separar el micelio del líquido. El micelio normalmente se comercializa como ingrediente alimentario, mientras que el líquido se somete a un proceso de recuperación para una mayor purificación del ácido cítrico.
La cámara y los recipientes se esterilizan con vapor y se introduce aire húmedo y estéril a una temperatura controlada para enfriar la cámara durante la fermentación.
El sustrato podrá introducirse de forma manual o automática, pudiendo complementarse con nutrientes según sea necesario.
La esterilización puede ser por lotes o continua; este último método consume menos energía y es más rápido.
1.1.3. Fermentación sumergida
La fermentación sumergida se lleva a cabo en grandes recipientes de fermentación, que se han convertido en el proceso preferido para nuevas inversiones desde la segunda mitad del siglo XX debido a menores costos de mano de obra y de inversión, así como áreas de construcción más compactas.
Los tanques de fermentación suelen ser altos y estrechos para maximizar la transferencia de oxígeno y pueden estar equipados con dispositivos de mezcla.
La mezcla es especialmente importante cuando se hidroliza la materia prima de carbohidratos en el recipiente de fermentación. Para materias primas líquidas menos viscosas, los recipientes de fermentación aéreos son más económicos.
Los rociadores, que se encuentran en el fondo del recipiente o debajo del agitador, suministran aire que puede enriquecerse con oxígeno. El aire pasa a través de un filtro estéril y, si es necesario, se enfría.
Debido a que el proceso es exotérmico, el recipiente debe estar equipado con superficies de intercambio de calor, que pueden ser las paredes exteriores o los serpentines internos.
Se proporcionan puertos para introducir sustrato, inóculo y vapor u otros agentes esterilizantes; También se proporcionan puertos de muestreo y escape.
El sustrato se prepara en un tanque aparte y se ajusta su pH. Los micronutrientes se pueden añadir a este tanque o directamente al fermentador. El sustrato se esteriliza mediante operación por lotes o, más comúnmente, de forma continua.
El fermentador se esteriliza, se carga con sustrato y se inocula. El proceso de fermentación real se desarrolla en dos pasos. Una pequeña parte del sustrato se utiliza para llenar un fermentador de semillas, que normalmente contiene una décima parte del volumen de un fermentador principal.
Después de la esterilización y el enfriamiento a 25-35 °C, se añaden las esporas de A. niger. Las esporas germinan y los gránulos de micelio comienzan a desarrollarse en el primer día de operación. Mientras tanto, se llena un fermentador principal con sustrato, se esteriliza y se enfría.
El contenido del fermentador de semillas se bombea luego al fermentador principal, donde comienza inmediatamente la conversión de los carbohidratos. La fermentación en el fermentador principal requiere de 3 a 7 días, según el sustrato y las condiciones del proceso utilizados.
Una vez completada la fermentación, se detiene el suministro de aire para evitar que los microorganismos consuman el ácido cítrico. Luego, el contenido se bombea a filtros de vacío rotatorios o de prensa de cinta para separar el micelio del líquido.
Al igual que en el proceso de fermentación superficial, el micelio se lava y normalmente se comercializa como ingrediente alimentario.
Casi todo el ácido cítrico en todo el mundo se vende como productos cristalinos. Para producir cristales de ácido cítrico de calidad alimentaria, primero se aísla el ácido cítrico del caldo de fermentación y luego se purifica la solución de ácido cítrico crudo. Finalmente, la solución de ácido cítrico purificado se cristaliza y se envasa.
2. Reacciones químicas del ácido cítrico
A una temperatura de 175°C, el ácido cítrico se deshidrata para formar ácido aconítico, que puede perder aún más dióxido de carbono para producir anhídrido itacónico. Este último puede transformarse en anhídrido citracónico o puede agregarse agua para formar ácido itacónico.
De manera similar, el anhídrido citracónico se puede convertir en ácido citracónico mediante la adición de agua. El ácido mesacónico, el isómero trans del ácido citracónico, se puede obtener evaporando una solución de ácido citracónico en presencia de ácido nítrico.
Cuando se oxida el ácido cítrico utilizando permanganato de potasio, se obtiene ácido 1,3-acetondicarboxílico a 35°C, mientras que se forma ácido oxálico a 85°C. La fusión de ácido cítrico con hidróxido de potasio produce una mezcla de ácido oxálico y ácido acético.
El ácido cítrico puede formar sales mono, di y tribásicas con varios cationes, y el grado de hidratación de estas sales puede variar. Por ejemplo, el citrato trisódico puede cristalizar con 2 o 5,5 moléculas de agua. La combinación de diferentes cationes metálicos puede dar lugar a sales complejas, como ZnNa3H(C6H5O7)2 y ZnNa4(C6H5O7)2.
Numerosos metales pueden formar complejos estables con el ácido cítrico, pudiendo algunos complejos, como los citratos de ferroamonio, cristalizar.
El complejo formado por cobre y ácido cítrico se parece al complejo cobre-ácido tartárico de la solución de Fehling, y se han empleado varios métodos clásicos para estudiar estos complejos.
El ácido cítrico puede quelar muchos iones metálicos en solución formando enlaces entre los grupos carboxilo o hidroxilo de la molécula de ácido cítrico y el ion metálico.
A veces, más de una molécula de ácido cítrico participa en la interacción con el ion metálico. Esta propiedad es útil para prevenir la precipitación, alterar el potencial químico y modificar otras propiedades químicas.
El ácido cítrico se puede esterificar con muchos alcoholes en condiciones normales en presencia de un catalizador, como ácido sulfúrico, ácido p-toluenosulfónico o una resina ácida de intercambio iónico.
También es posible la esterificación sin catalizadores con alcoholes que hiervan por encima de 150°C. Por ejemplo, el cloruro de bencilo y el citrato de sodio pueden producir ésteres di- o tribencílicos, y los citratos de trimetilo, trietilo y tributilo se emplean a menudo como plastificantes en materiales de envasado de alimentos.
Los poliésteres se pueden formar haciendo reaccionar ácido cítrico con alcoholes dihídricos, fenoles dihídricos y alcoholes polihídricos como manitol, sorbitol y glicerol.
En ocasiones, la reacción de esterificación se puede detener antes de que se complete, dejando uno de los restos de ácido carboxílico libre para formar una sal. El poliéster resultante puede ser soluble en agua.
El ácido cítrico puede reaccionar con cloruros y anhídridos de ácido en el grupo hidroxilo, produciendo ésteres alílicos de ácido cítrico. Los bis(ésteres de ácido cítrico) se pueden obtener a partir de cloruros de ácidos dicarboxílicos.
Los epóxidos, incluidos el óxido de etileno, el óxido de propileno y el óxido de estireno, pueden formar polímeros al reaccionar con ácido cítrico o sus ésteres en los grupos hidroxilo y carboxilo disponibles.
El ácido cítrico puede reaccionar con amoníaco, aminas, amidas y carbamidas de manera similar a los ácidos carboxílicos simples. Los aldehídos también pueden formar aductos con ácido cítrico, como el ácido anhidrometilenocítrico 5-oxo-1,3-dioxolano-4,4-diacético.
3. Usos del ácido cítrico
El ácido cítrico y sus sales de sodio o potasio se usan comúnmente en diversos productos alimenticios, incluidas bebidas carbonatadas, bebidas envasadas secas, bebidas de frutas, mermeladas, jaleas y frutas enlatadas.
También desempeñan un papel crucial en la conservación del color, el sabor y el contenido vitamínico de las frutas y verduras frescas y congeladas, así como en la producción de aceites vegetales.
En aplicaciones farmacéuticas, el ácido cítrico se utiliza predominantemente como anticoagulante en el almacenamiento de sangre y en tabletas efervescentes.
El ácido cítrico se aplica ampliamente en procesos de limpieza, específicamente para eliminar incrustaciones de calderas e intercambiadores de calor debido a su capacidad quelante.
Numerosas aplicaciones industriales del ácido cítrico se benefician de su potente acción secuestrante con diversos metales de transición, como hierro, cobre, níquel, cobalto, cromo y manganeso.
El ácido cítrico se emplea comúnmente como mejorador de detergentes, particularmente en formulaciones líquidas. Además, sus soluciones pueden eliminar el dióxido de azufre de los gases y quelar los micronutrientes de los fertilizantes.
Los ésteres de ácido cítrico, como el citrato de trimetilo, trietilo y tributilo, se utilizan como plastificantes para recipientes de plástico aptos para alimentos.
Referencia
- Citric Acid; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a07_103.pub3

