Las aminas alifáticas, caracterizadas por la presencia de un grupo funcional amino unido a una cadena de carbono, exhiben diversas reacciones químicas debido al par de electrones solitarios en el átomo de nitrógeno y la tendencia de los átomos de hidrógeno unidos al nitrógeno a ser sustituidos por otros grupos.
Tabla de contenido
1. Formación de sales de amina
Un aspecto importante de las aminas alifáticas es su capacidad para formar sales cuando reaccionan con ácidos. Debido a los sustituyentes alquilo que llevan, las aminas alifáticas son bases más fuertes que el amoníaco. En consecuencia, reaccionan fácilmente con ácidos para formar sales solubles en agua que son insolubles en disolventes orgánicos.

Esta propiedad convierte a las aminas en excelentes aceptores de ácidos y disolventes útiles en procesos de extracción y depuración de gases (p. ej., en la síntesis de penicilinas semisintéticas).
En particular, las aminas terciarias como trimetilamina, tributilamina y etildiisopropilamina se emplean ampliamente como aceptores de protones y catalizadores en síntesis orgánica porque pueden eliminarse de la mezcla orgánica después de la reacción.
2. Conversión a Carboxamidas
La reacción entre aminas y ácidos carboxílicos, así como sus ésteres, cloruros y anhídridos, conduce a la producción de carboxamidas sustituidas:

Esta transformación generalmente da como resultado altos rendimientos, particularmente cuando se emplean cloruros de ácido carboxílico, que es una reacción altamente exotérmica. Cuando se reacciona con ácidos carboxílicos, la reacción a menudo cesa con la formación de la sal de amonio inicial.
Este tipo de reacción encuentra una importante aplicación industrial, como en la síntesis de diversos herbicidas que poseen una estructura de amida ácida.
Cuando una alquilamina reacciona con una lactona mediante este proceso, se genera una lactama. Un ejemplo notable de esta reacción es la formación de 1-etil-2-pirrolidona a partir de la combinación de etilamina y γ-butirolactona.
3. Conversión de aminas en sulfonamidas
La reacción de aminas alifáticas con cloruro de bencenosulfonilo se utiliza para distinguir entre aminas primarias, secundarias y terciarias, comúnmente conocida como prueba de Hinsberg. Además, esta reacción se puede emplear para la separación preparativa de estos tipos de aminas.
En esta prueba, las aminas primarias producen N-alquilbencenosulfonamidas solubles en álcalis, mientras que las aminas secundarias producen N,N-dialquilbencenosulfonamidas insolubles en álcalis. Por el contrario, las aminas terciarias no presentan ninguna reactividad en estas condiciones específicas.
Cabe señalar que pueden surgir limitaciones con las aminas primarias de cadena larga, ya que pueden permanecer insolubles en álcalis a pesar de la presencia de hidrógeno ácido. Las aminas terciarias también pueden sufrir cuaternización con cloruro de sulfonilo, lo que altera los resultados de la reacción.

Las sulfonamidas alguna vez desempeñaron un papel vital como productos farmacéuticos en el tratamiento de infecciones bacterianas, salvando innumerables vidas durante la Segunda Guerra Mundial. Sin embargo, desde entonces han sido reemplazados por alternativas más seguras como la penicilina y otros antibióticos.
4. Reacción de aminas con compuestos carbonílicos
En determinadas condiciones de reacción y con compuestos adecuados, los compuestos carbonílicos pueden reaccionar con aminas, dando lugar a iminas (bases de Schiff) (2) o enaminas (3). Estos productos pueden sufrir una hidrogenación adicional para producir aminas más alquiladas. Esta reacción tiene una importancia significativa como método para sintetizar aminas superiores.
Vale la pena señalar que los hemiaminales intermedios (1) formados durante la reacción no suelen ser aislables. Los aldehídos generalmente reaccionan más rápido que las cetonas. Las aminas secundarias forman exclusivamente enaminas, mientras que las aminas terciarias no producen ninguno de los dos productos.

Una reacción que involucra una amina, un aldehído y un compuesto que posee un átomo de hidrógeno activado, como una cetona, conduce a la formación de una base de Mannich.
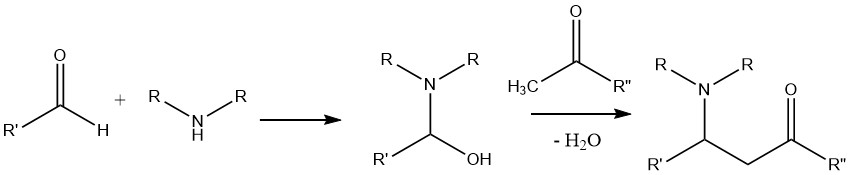
En esta reacción, el producto de condensación formado entre el aldehído y la amina es atacado por el compuesto ácido α-C—H, que se origina a partir de la cetona.
5. Reacción de aminas con dióxido de carbono y disulfuro de carbono
El ácido carbámico o ditiocarbámico generado durante esta reacción presenta inestabilidad, pero puede aislarse en forma de sal o éster.

Los ditiocarbamatos derivados de diversas aminas tienen una gran importancia como aceleradores de la vulcanización en la industria del caucho.
6. Reacción de aminas con epóxidos
Cuando las aminas primarias reaccionan con epóxidos, se forma una mezcla de derivados mono y dioxialquilados. Por el contrario, las aminas secundarias producen exclusivamente compuestos monooxialquilados, mientras que las aminas terciarias producen compuestos de amonio cuaternario.
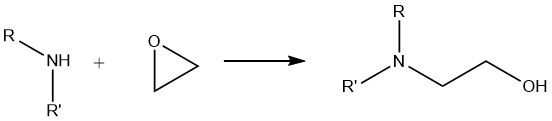
Esta reacción de alcoxilación es muy importante en la aplicación industrial de aminas alifáticas. Se utiliza ampliamente en la síntesis de floculantes, resinas para revestimientos de superficies, intermediarios farmacológicos y productos empleados en procesos de depuración de gases como la etanolamina y la propanolamina.
7. Alquilación de aminas
La reacción de aminas con haluros de alquilo y sulfatos de dialquilo conduce finalmente a la formación de compuestos de amonio cuaternario, que encuentran amplia aplicación en la química farmacéutica preparativa, así como en la síntesis de agentes anticorrosivos y biocidas.
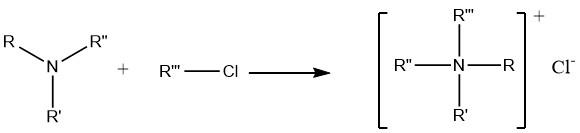
La reacción entre haluros de alquilo y amoníaco no es particularmente útil para la preparación de aminas primarias o secundarias. Esto se debe a la fuerte basicidad de las aminas primarias y secundarias, lo que hace que atacan preferentemente a los haluros en lugar de sufrir reacciones de sustitución.
Sin embargo, todavía se pueden preparar aminas terciarias mediante estas reacciones. En las síntesis a escala de laboratorio, las aminas primarias se pueden obtener utilizando hexametilentetramina, mientras que las aminas secundarias se pueden sintetizar utilizando cianamida.
8. Formación de isocianatos y ureas
De la reacción entre fosgeno y aminas primarias se obtiene inicialmente el correspondiente cloruro de carbonilo. La posterior escisión del cloruro de hidrógeno conduce a la formación de isocianato de alquilo. El exceso de amina reacciona entonces con el isocianato, dando como resultado la formación de ureas.
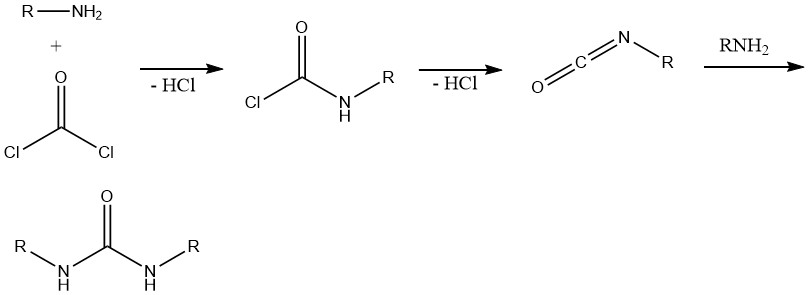
Esta reacción es importante en la síntesis de diversos herbicidas que contienen estructuras de urea, carbamato o tiocarbamato y en sistemas de aminas polifuncionales, principalmente química de poliuretano.
De manera similar, las aminas secundarias reaccionan con fosgeno a través de un cloruro intermedio análogo, lo que lleva a la formación de N,N’-tetraalquilureas.
9. Reacción de aminas con acrilonitrilo
La adición a escala industrial de una amina primaria o secundaria al acrilonitrilo, conocida como adición de 1,2-Michael, se usa ampliamente para la síntesis de diaminas y poliaminas superiores. Esta reacción se ve favorecida porque la funcionalidad nitrilo se puede hidrogenar fácilmente en la amina correspondiente.

10. Formación de isonitrilos
En condiciones básicas, las aminas primarias reaccionan con triclorometano para producir isonitrilos:
El olor fuerte y desagradable de los isonitrilos permite utilizar esta reacción como prueba para detectar la presencia de aminas primarias. Además, para aminas inferiores, esta reacción también se puede emplear como método sintético.
Un enfoque alternativo implica el uso de N-alquilformamidas como materiales de partida para la síntesis de isonitrilos.
11. Oxidación de aminas
Las aminas libres son sensibles a la oxidación, a diferencia de sus sales, dando lugar a la formación de diversos productos dependiendo del agente oxidante y del tipo de amina involucrada.
Las aminas terciarias, cuando se oxidan con peróxido de hidrógeno, forman óxidos de amina. Por otro lado, las aminas primarias y secundarias, tras la oxidación, producen las correspondientes hidroxilaminas o aldoximas mediante reacciones posteriores con los compuestos formados.

El uso de ácido nitroso para la oxidación sirve como medio para diferenciar entre aminas primarias, secundarias y terciarias. Las aminas primarias sufren diazotización, seguida de la eliminación de nitrógeno gaseoso y, finalmente, forman alcoholes mediante la reacción del ion carbenio intermedio con agua.
Las aminas secundarias reaccionan para producir N-nitrosoaminas amarillas. Normalmente, las aminas terciarias no presentan reactividad en estas condiciones.
La formación de nitrosaminas puede ser una preocupación importante, particularmente con las aminas secundarias, ya que son altamente mutagénicas. Si bien no suelen formarse durante el uso normal, se pueden formar trazas al entrar en contacto con nitritos u óxidos nitrosos, lo que genera problemas de manipulación. Por tanto, la contaminación del aire por aminas secundarias se considera problemática.
12. Desalquilación de aminas
Después de convertir las aminas terciarias en sales básicas de amonio cuaternario, se desalquilan al calentarlas. En los casos en los que sólo están presentes grupos metilo, se eliminan como metanol o dimetiléter. Sin embargo, cuando están presentes grupos alquilo superiores, producen alquenos, como se ejemplifica en la reacción:

Esta reacción, comúnmente conocida como degradación de Hofmann, no se emplea frecuentemente en aplicaciones sintéticas. Sin embargo, en el pasado desempeñó un papel importante a la hora de dilucidar las características estructurales de aminas desconocidas.
Referencia
- Amines, Aliphatic; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a02_001.pub2