Ácido malónico: propiedades, reacciones, producción y usos
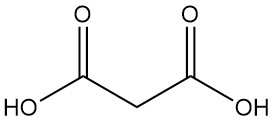
¿Qué es el ácido malónico?
El ácido malónico, también conocido como ácido propanodioico o ácido metanodicarboxílico, es un ácido dicarboxílico con la fórmula química C3H4O4. Es un sólido incoloro e higroscópico que sublima en el vacío. La forma ionizada del ácido malónico, así como sus ésteres y sales, se conocen como malonatos.
Tabla de contenido
1. Propiedades físicas del ácido malónico
El ácido malónico es un sólido blanco, higroscópico, muy soluble en agua (139 g en 100 g de agua a 22 °C) y soluble en piridina (15 g en 100 g de piridina a 15 °C). Es ligeramente soluble en etanol y éter dietílico e insoluble en benceno.
Las propiedades físicas del ácido malónico se enumeran en la Tabla 1.
| Propiedad | Valor |
|---|---|
| N.º de registro CAS | [141-82-2] |
| Fórmula molecular | C3H4O4 |
| Peso molecular | 104,06 g/mol |
| Punto de fusión | 134 – 138 °C |
| Punto de ebullición | Se descompone a 140 °C |
| Densidad | 1,62 g/cm³ |
| pKa1 | 2,83 |
| pKa2 | 5,70 |
| Punto de inflamación | 157 °C |
2. Reacciones del ácido malónico
El ácido malónico se encuentra en pequeñas cantidades en la remolacha azucarera y el trigo verde y se forma por la degradación oxidativa del ácido málico.
El ácido malónico exhibe reacciones típicas de los ácidos carboxílicos y una alta reactividad del grupo metileno central debido a la acidez de los átomos de hidrógeno en la posición 2.
El ácido malónico reacciona como la mayoría de los ácidos carboxílicos para producir amidas, ésteres, anhídridos y cloruros de ácido.
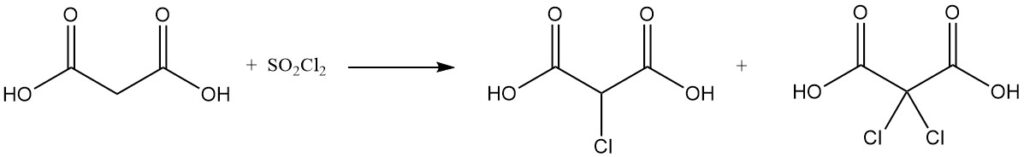
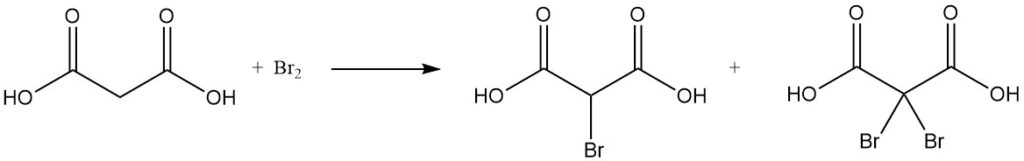
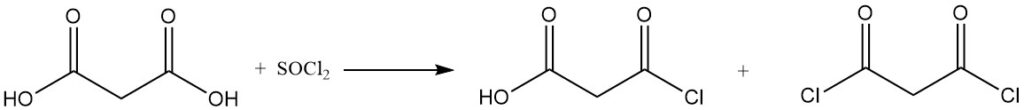
La reacción del ácido malónico con cloruro de sulfurilo o bromo produce derivados mono o dihalogenados, mientras que el cloruro de tionilo o el pentacloruro de fósforo forman cloruros mono o diacilo.
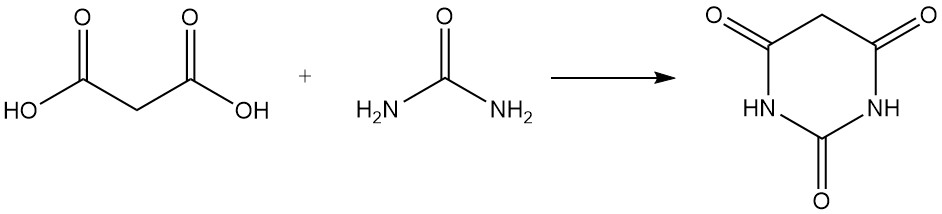
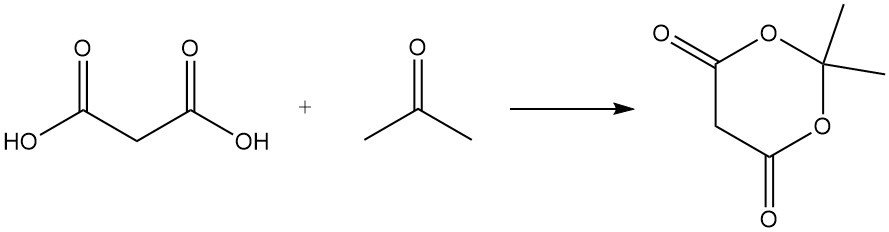
El ácido malónico reacciona con la urea para producir ácido barbitúrico, un precursor de varios fármacos, y con acetona para formar el ácido de Meldrum, un intermediario importante en la síntesis orgánica.
A diferencia de los ácidos carboxílicos típicos, calentar el ácido malónico con pentóxido de fósforo no produce un anhídrido sino subóxido de carbono, un gas tóxico que reforma fácilmente el ácido malónico al entrar en contacto con el agua.
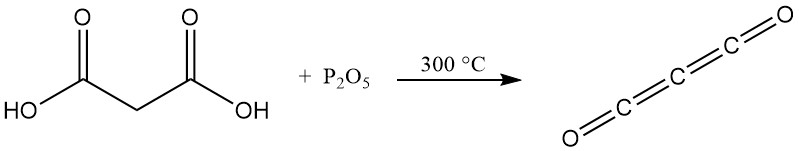
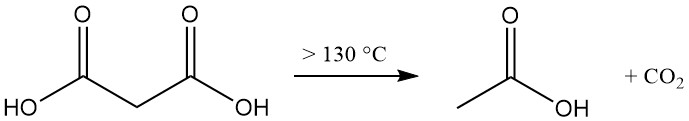
La descomposición térmica del ácido malónico por encima de 130 °C (ácido libre) o 70 °C (solución acuosa) produce ácido acético y dióxido de carbono.
Los mono y dianiones del ácido malónico son más estables en comparación con el ácido libre. En soluciones acuosas, el malonato monosódico se descompone a temperaturas superiores a los 90 °C, mientras que el malonato disódico se descompone a temperaturas superiores a los 130 °C.
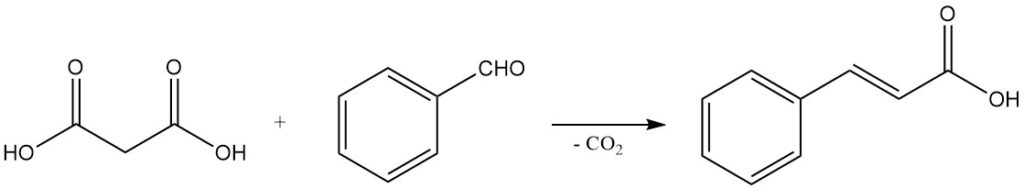
El comportamiento de descarboxilación suave, junto con la capacidad de sufrir condensaciones de Knoevenagel, hace del ácido malónico un reactivo importante para sintetizar ácidos carboxílicos α,β-insaturados. Por ejemplo, la reacción con benzaldehído produce ácido cinámico, y las reacciones con aldehídos alifáticos producen ácidos acrílicos.
La investigación también ha explorado los complejos de platino del ácido malónico y sus derivados como posibles agentes antitumorales.
3. Producción industrial de ácido malónico
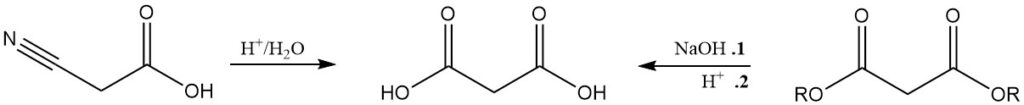
Aunque menos importante que la producción de malonato, el ácido malónico se produce comúnmente por hidrólisis del ácido cianoacético o por saponificación ácida de malonatos.
También se han descrito nuevos métodos para la producción de ácido malónico, que incluyen la ozonólisis del ciclopentadieno, la oxidación con aire catalizada por paladio del 1,3-propanodiol, la oxidación catalizada por metales del 3-hidroxipropionaldehído o del ácido 3-hidroxipropiónico y la conversión biocatalítica del malononitrilo utilizando una enzima nitrilasa.
La primera síntesis de ácido malónico en laboratorio, realizada en 1858, implicó la descomposición oxidativa del ácido málico utilizando dicromato de potasio. Este método no se utiliza comúnmente en la actualidad.
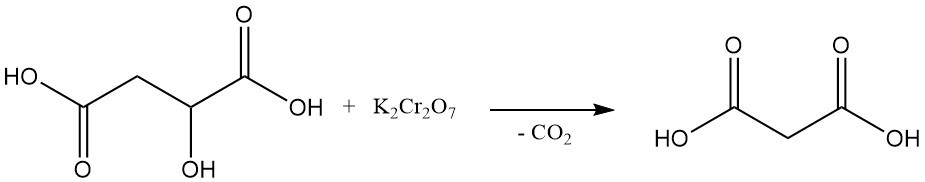
4. Usos del ácido malónico
El ácido malónico se utiliza como componente básico de diversos compuestos orgánicos debido a su capacidad de introducir una fracción de ácido acético en condiciones suaves mediante condensación de Knoevenagel seguida de descarboxilación. Algunos ejemplos de compuestos sintetizados a partir del ácido malónico son:
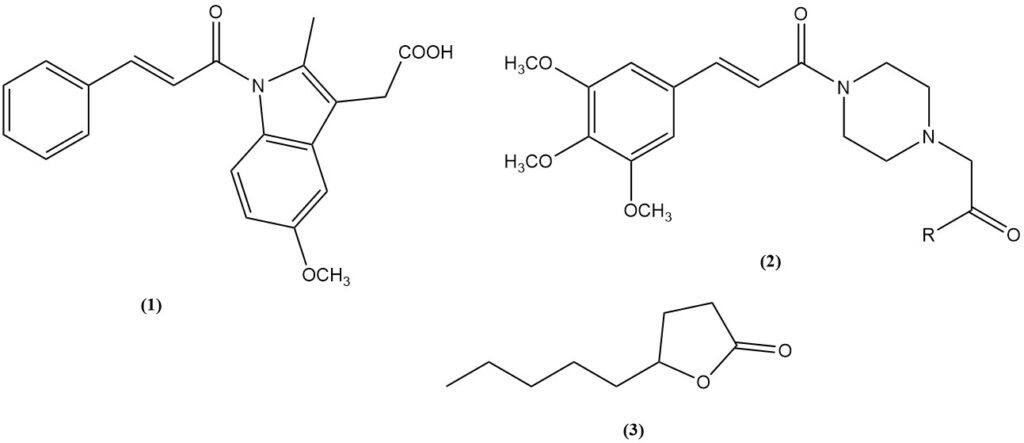
- El ácido cinámico es un precursor del fármaco antiinflamatorio cinmetacina (1).
- Ácido 3,4,5-trimetoxicinámico: un intermediario para los vasodilatadores cinepazet (2, R = OEt) y cinepazida (2, R = 1-pirrolidinilo).
- Lactona γ-nonanoica (3): un compuesto fragante obtenido a través de la condensación de Knoevenagel de ácido malónico con heptaldehído seguida de ciclización.
El ácido malónico también se utiliza en la producción de plásticos de ingeniería con propiedades deseadas, contenedores biodegradables, barbitúricos y recubrimientos.
5. Toxicología del ácido malónico
Se considera que el ácido malónico tiene una toxicidad moderada, que afecta principalmente a los ojos y la piel. Estos son los datos toxicológicos disponibles:
Toxicidad oral aguda: LD50 (oral, rata): 2750 mg/kg
El ácido malónico puede irritar la piel (irritación cutánea leve en conejos) y causar daños oculares graves en caso de contacto. Las hojas de datos de seguridad (SDS) recomiendan el uso de equipo de protección personal (EPP) adecuado para evitar el contacto.
No hay datos fácilmente disponibles sobre los efectos crónicos para la salud en humanos.
La inhalación de polvo de ácido malónico también puede ser perjudicial, aunque los datos específicos pueden ser limitados.
Los efectos específicos de la exposición al ácido malónico pueden variar según factores como la cantidad, la duración de la exposición y la vía de entrada (inhalación, ingestión, contacto con la piel).
Al igual que con cualquier producto químico, es fundamental manipular el ácido malónico de acuerdo con los protocolos de seguridad recomendados que se describen en las hojas de datos de seguridad (SDS).
Referencias
- Malonic Acid and Derivatives; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/abs/10.1002/14356007.a16_063.pub2
- Malonic acid. – https://www.acs.org/molecule-of-the-week/archive/m/malonic-acid.html
- The Knoevenagel Reaction. – https://www.sciencedirect.com/science/article/abs/pii/B9780080523491000330
- https://beta-static.fishersci.com/content/dam/fishersci/en_US/documents/programs/education/regulatory-documents/sds/chemicals/chemicals-m/S25416.pdf
