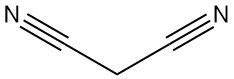
¿Qué es el malononitrilo?
El malononitrilo, también conocido como propanodinitrilo, dinitrilo de ácido malónico o dicianometano, es un compuesto orgánico con la fórmula química C3H2N2. Es un sólido incoloro o blanco que es un componente básico valioso que se utiliza ampliamente en la síntesis orgánica.
Tabla de contenido
1. Propiedades físicas del malononitrilo
El malononitrilo forma cristales incoloros que son solubles en solventes polares como el agua, alcoholes inferiores, acetonitrilo y éter dietílico, pero es insoluble en solventes no polares como el tetraclorometano, el éter de petróleo y el xileno.
El almacenamiento prolongado puede inducir un cambio de color, transformando los cristales de incoloros a amarillos o incluso a marrón oscuro sin comprometer su calidad.
El malononitrilo es tóxico si se ingiere y puede causar irritación grave en la piel y los ojos.
Las propiedades físicas del malononitrilo se enumeran en la Tabla 1.
| Propiedad | Valor |
|---|---|
| N.º de registro CAS | [109-77-3] |
| Fórmula molecular | C3H2N2 |
| Masa molecular | 66,06 g/mol |
| Punto de fusión | 31,6 °C |
| Punto de ebullición | 218 – 219 °C |
| Densidad (20 °C) | 1,19 g/mL |
| Índice de refracción (34 °C) | 1,4146 |
| Momento dipolar (25 °C) | 3,57 D |
| pKa | 11,2 |
| Densidad del vapor | 2,3 |
| Vapor Presión | 0,2 mmHg |
| Punto de inflamación | > 86 °C |
| Solubilidad (20 °C) | |
| Agua | 133 g/L |
| Éter dietílico | 200 g/L |
| etanol | 400 g/L |
2. Reacciones químicas del malononitrilo
El malononitrilo exhibe una reactividad versátil debido a la nucleofilia del anión malononitrilo, que se puede obtener por desprotonación con una base débil, y la naturaleza electrofílica de sus grupos ciano.
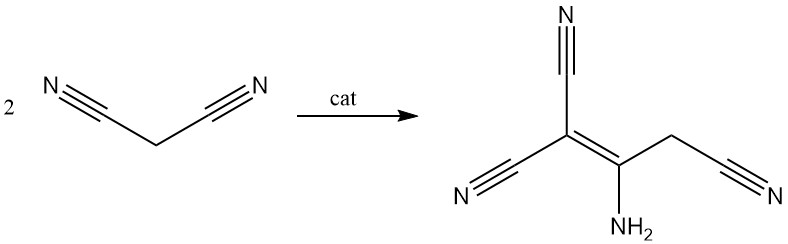
El malononitrilo se dimeriza en presencia de una base para producir 2-amino-1,1,3-triciano-2-propeno.
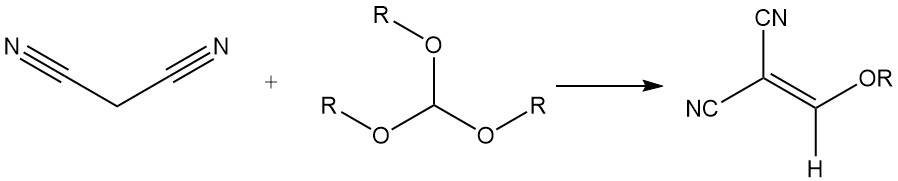
Reacciona con ortoformiatos de trialquilo para producir alcoximetilenomalonitrilos, que se utilizan para la síntesis de colorantes de estirilo.
Es posible la dialquilación del malononitrilo con haluros de alquilo y la acilación con cloruros/anhídridos de ácido.
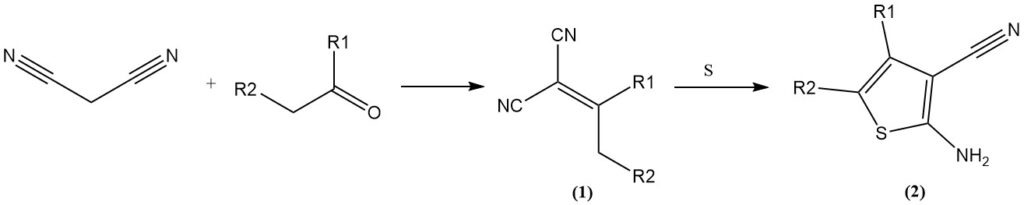
La condensación de Knoevenagel con aldehídos/cetonas produce ilidenmalonitrilos (1), que pueden sufrir reacciones posteriores. Algunos ejemplos incluyen la reacción con azufre elemental (reacción de Gewald) para formar 3-ciano-2-amino-tiofenos (2) o la cicloadición con azidas para producir tetrazoles.
El malononitrilo reacciona con el bromo para producir derivados mono o dibromados. La descomposición térmica del complejo de dibromuro produce tetracianoetileno.
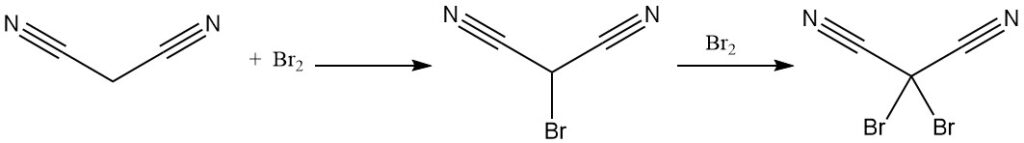
La reacción del dibromomalononitrilo con cianuro de potasio produce la sal de potasio del tricianometano, también producida a partir del malononitrilo y el cloruro de cianógeno. El tricianometano se utiliza en la síntesis de líquidos iónicos.
La reacción del malononitrilo con disulfuro de carbono en presencia de una base produce sales de (dimercaptometilen)malonitrilo, un precursor de los antimicrobianos. La dimetilación produce otro componente importante de los heterociclos.
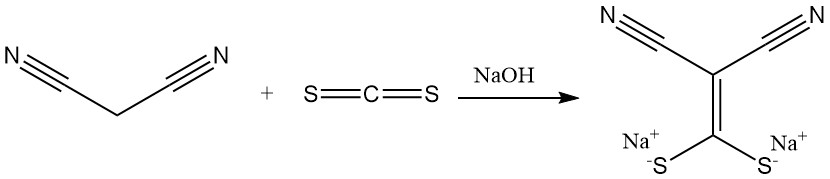
La cianotioacetamida se prepara por reacción con sulfuro de hidrógeno.
Las reacciones catalizadas por ácido del malononitrilo con alcoholes generan imidatos (3), que son materiales de partida para heterociclos de nitrógeno como 4,6-dimetoxipirimidinas (4) o bis(oxazolinas) (5).
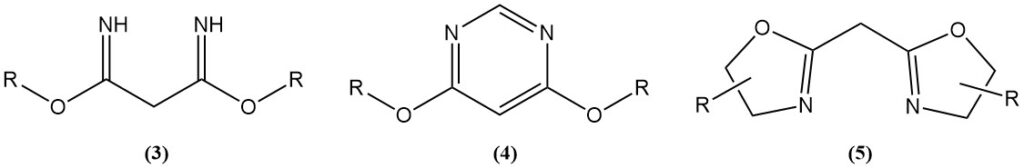
Las bis(oxazolinas) se producen mediante reacciones de tipo Ritter o mediante el uso de un catalizador. Las bis(oxazolinas) sintetizadas a partir de malononitrilo o sus derivados y aminoalcoholes quirales se utilizan como ligandos en reacciones catalizadas por metales de transición asimétricos.
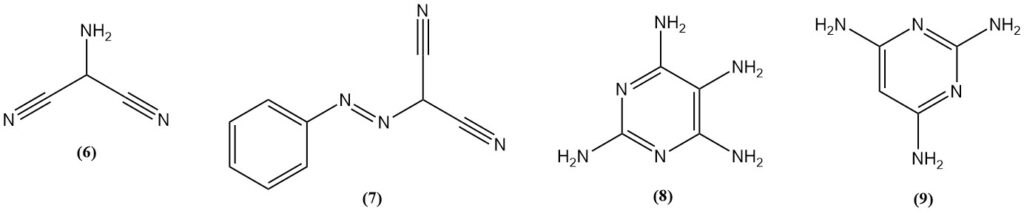
El 2-aminomalononitrilo (6) se obtiene por nitrosación de malononitrilo, seguida de hidrogenación o por reducción de (fenilazo)malononitrilo (7). El aminomalononitrilo reacciona con guanidina para producir 2,4,5,6-tetraaminopirimidina (8).
La 2,4,6-triaminopirimidina (9) se puede preparar mediante la reacción de malononitrilo y guanidina, mientras que la 2,4,6-triaminopirimidina se produce a partir de formamidina.
3. Producción de malononitrilo
Hasta la década de 1970, el malononitrilo se producía mediante un proceso discontinuo mediante la deshidratación de cianoacetamida utilizando pentacloruro de fósforo u oxicloruro de fósforo. Este método, aunque documentado mediante patentes incluso recientemente, ya no se utiliza comercialmente, excepto en algunas plantas chinas de pequeña escala.
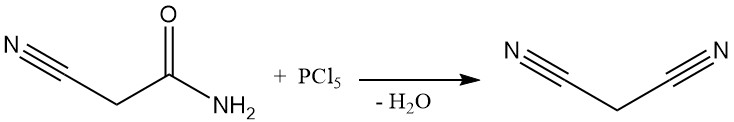
El método industrial dominante para la síntesis de malononitrilo en la actualidad es una reacción continua a alta temperatura entre acetonitrilo y cloruro de cianógeno. Este proceso utiliza un reactor tubular que opera a más de 700 °C y logra una conversión casi completa en una sola pasada, obteniéndose malononitrilo.
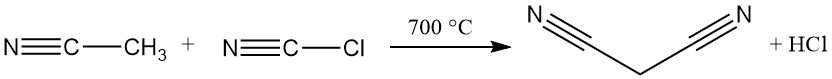
El producto deseado contiene como impurezas un exceso de acetonitrilo, ácido clorhídrico y trazas de ácidos maleico, succínico y fumárico.
El producto que sale del reactor se enfría rápidamente para detener la reacción y separar el cloruro de hidrógeno gaseoso, que luego se recupera mediante depuración. El exceso de acetonitrilo se elimina mediante una combinación de destilación al vacío y evaporación en película fina, lo que permite reciclarlo con una contaminación mínima.
La separación de los ácidos maleico y fumárico del malononitrilo crudo no es práctica debido a sus puntos de ebullición similares. Por lo tanto, estas impurezas se convierten en compuestos de mayor punto de ebullición mediante una reacción de Diels-Alder en un reactor separado. Finalmente, dos destilaciones al vacío eliminan estos subproductos, lo que da como resultado un rendimiento del 66 % de malononitrilo basado en ambos materiales de partida.
La primera planta industrial que utilizó este proceso fue operada en 1973 por Lonza en Visp, Suiza.
Si bien se han propuesto métodos alternativos para la producción de malononitrilo, como los que utilizan cianoacetatos, malonatos o reacciones con amoníaco y diversos catalizadores, ninguno de estos métodos se emplea actualmente a escala industrial.
4. Usos del malononitrilo
El malononitrilo se utiliza ampliamente como materia prima en la producción de vitaminas, productos agroquímicos, productos farmacéuticos y colorantes.
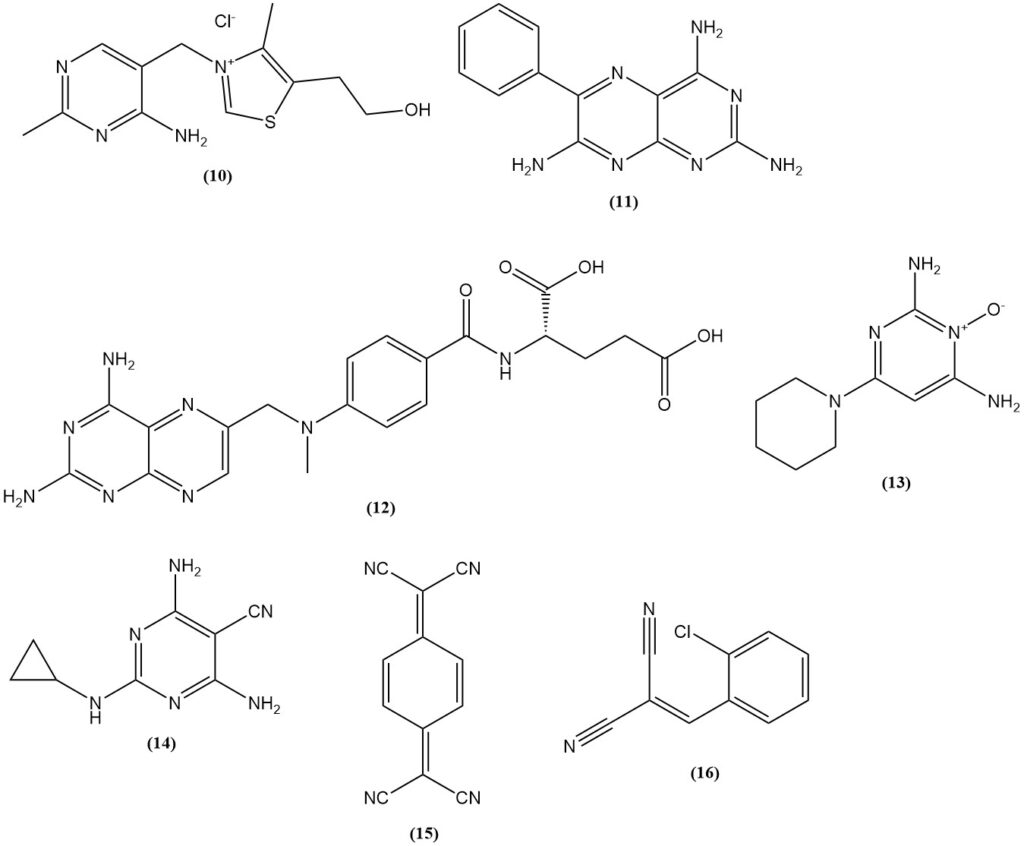
El malononitrilo se utiliza en la síntesis de tiamina (10) (vitamina B1), herbicidas de sulfonilurea basados en 2-amino-4,6-dimetoxipirimidina, como benzsulfurón-metil y halosulfurón-metil y productos farmacéuticos (el diurético triamtereno (11), el antagonista del ácido fólico metotrexato (12), el antihipertensivo minoxidil (13) y el pesticida diciclanil (14)).
Entre los ejemplos de colorantes y pigmentos producidos a partir de malononitrilo se incluyen los colorantes amarillos de metino con un grupo N,N-dialquilaminoarilo (aminoarilneutrocianinas) como C.I. Disperse Yellow 90; colorantes de aminoarilneutrocianina azul como C.I. Disperse Blue 354; y ácido 1,4,5,8-naftalenotetracarboxílico, que es un precursor de los pigmentos de perinona.
También se utiliza en la producción de conductores eléctricos como las sales de transferencia de carga de 7,7,8,8-tetracianoquinodimetano (15) (TCNQ) y el gas lacrimógeno (o-clorobencilideno)malonitrilo (16), que se puede producir a partir de la condensación de o-clorobenzaldehído con malononitrilo.
5. Toxicología del malononitrilo
El malononitrilo puede causar irritación ocular grave en conejos tras la exposición a 5 mg durante 24 horas.
El malononitrilo es altamente tóxico por diversas vías, con valores de LD50 oral que van desde 14 mg/kg a 69,8 mg/kg en ratas. Los efectos más comunes incluyen convulsiones, debilidad muscular, depresión respiratoria y cambios de comportamiento.
El contacto de la piel con el malononitrilo también puede ser letal en ratas en dosis de 350 mg/kg. Los datos disponibles sugieren efectos potenciales en varios órganos, incluidos los pulmones, la sangre y el sistema nervioso.
La exposición oral repetida en ratas a dosis más bajas (285 mg/kg/19 semanas) puede causar cambios en el hígado y el peso.
Existen límites de exposición ocupacional para regular las concentraciones de malononitrilo en el aire del lugar de trabajo (p. ej., Nivel de exposición recomendado por NIOSH: 3 ppm).
Referencias
- Malonic Acid and Derivatives; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/abs/10.1002/14356007.a16_063.pub2
- https://pubchem.ncbi.nlm.nih.gov/compound/Malononitrile
- https://www.cdc.gov/niosh-rtecs/OO3010B0.html




