Butanol: Propiedades, Reacciones, Producción y Usos
El butanol, también conocido como n-butanol o butan-1-ol, es un alcohol primario con la fórmula química C4H9OH. Es un líquido incoloro con un olor fuerte y desagradable, parecido al del whisky quemado.
El butanol existe naturalmente en formas ligadas y concentradas en aceites de fusel derivados de fermentación. Su producción industrial comenzó en 1912 con el descubrimiento de Clostridium acetobutylicum Weizmann, una bacteria que transforma los carbohidratos principalmente en acetona y 1-butanol.
La creciente demanda de 1-butanol impulsó el desarrollo de nuevos métodos de producción, que incluyen:
- Hidrogenación de crotonaldehído: se forma mediante acetaldehído aldolización.
- Síntesis de Reppe (carbonilación de propeno).
- Hidrogenación de n-butiraldehído: se obtiene fácilmente mediante hidroformilación de propeno, que es el método dominante actualmente.
Tabla de contenido
1. Propiedades físicas del 1-butanol
El n-butanol es un líquido incoloro con un olor característico. Sus vapores irritan las membranas mucosas y se vuelven narcóticos en altas concentraciones. Es completamente miscible con disolventes orgánicos comunes.
La Tabla 1 recopila las principales propiedades físicas características del n-butanol.
| Propiedad | Valor |
|---|---|
| Masa molar | 74,12 g/mol |
| Punto de fusión | -89,3 °C |
| Punto de ebullición | 117,7 °C |
| Densidad (20°C) | 0,8098 g/cm³ |
| Índice de refracción (20°C) | 1,3991 |
| Viscosidad (20°C) | 3,0 mPa·s |
| Calor específico (30–80°C) | 2,437 J g⁻¹ K⁻¹ |
| Calor de vaporización | 591,64 J/g |
| Calor de fusión | 125,2 J/g |
| Calor de combustión | 36,111 kJ/g |
| Presión crítica | 44,2 hPa |
| Temperatura crítica | 289°C |
| Tensión superficial (temperatura ambiente) | 22,3 mN/m |
| Constante dieléctrica (temperatura ambiente) | 17.8 |
| Número de evaporación (éter = 1) | 33 |
| Solubilidad en agua (20°C, % en peso | 7,7 % en peso |
| Solubilidad en agua (30°C, % en peso | 7,08% en peso |
| Solubilidad del agua en 1-butanol (20 °C, % en peso | 20% en peso |
| Solubilidad del agua en 1-butanol (30°C, % en peso | 20,62% en peso |
| Punto de inflamación | 34°C |
| Límites de ignición en el aire, % vol | 1.4–11.3 |
| Temperatura de ignición | 380°C |
2. Propiedades químicas del 1-butanol
Como alcohol primario, el 1-butanol es una sustancia química reactiva que sirve como material de partida para una amplia gama de reacciones.
2.1. Deshidratación del 1-butanol
El 1-butanol se puede deshidratar hasta obtener una mezcla de butenos (1-buteno, cis-2-buteno y trans-2-buteno) utilizando catalizadores como γ-Al2O3 a altas temperaturas (300-350 °C). A temperatura más baja y en presencia de catalizadores de deshidratación se produce éter dibutílico.

2.2. Oxidación del 1-butanol
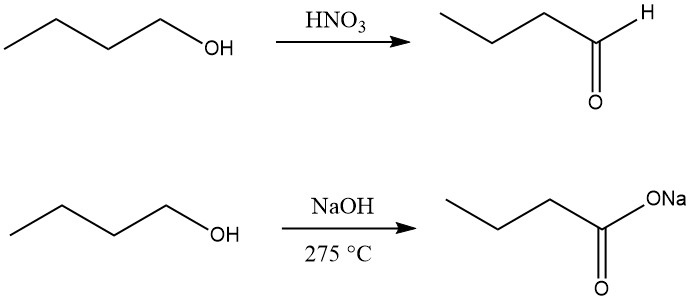
El 1-butanol se puede deshidrogenar a 1-butanal (butanal) usando agentes oxidantes como el óxido de manganeso (IV) en ácido sulfúrico, ácido nítrico , ácido crómico o dióxido de selenio a baja temperatura o sólo con catalizadores adecuados a alta temperatura.
La oxidación del n-butanol a ácido carboxílico se puede lograr mediante la reacción con hidróxido de sodio a 275 °C, formando la sal de sodio de ácido butírico junto con hidrógeno y 2-etilhexanol.
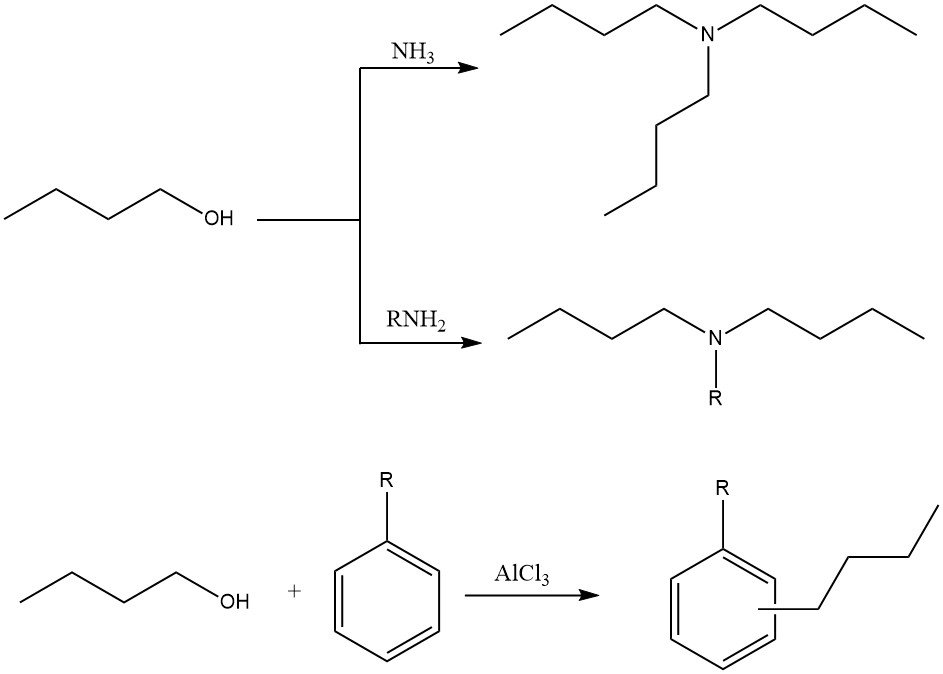
2.3. Alquilación
El 1-butanol se puede utilizar en diversas reacciones de alquilación para producir N-alquil-, N,N-dialquil- o N,N,N-trialquilaminas con amoníaco y aminas. También se puede utilizar en la alquilación de anillos de hidrocarburos aromáticos con catalizadores de Friedel-Crafts.
2.4. Esterificación del 1-butanol
El 1-butanol reacciona con ácidos orgánicos e inorgánicos para formar ésteres butílicos, normalmente catalizados por ácidos. también puede producir ésteres con cloruros de ácido y anhídridos de ácido.
3. Producción de 1-Butanol
Entre las diversas rutas para producir 1-butanol, las tres siguientes dominan la industria:
- Hidroformilación de propeno (síntesis oxo)
- Síntesis repetida
- Hidrogenación de crotonaldehído
3.1. Producción de 1-butanol mediante Oxo Synthesis
El método principal empleado en la producción de 1-butanol es la hidroformilación del propeno, seguida de la hidrogenación de los aldehídos resultantes. En la hidroformilación, se añaden monóxido de carbono e hidrógeno al doble enlace del propeno en fase líquida utilizando catalizadores como hidrocarbonilos o hidrocarbonilos sustituidos de Co, Rh o Ru.
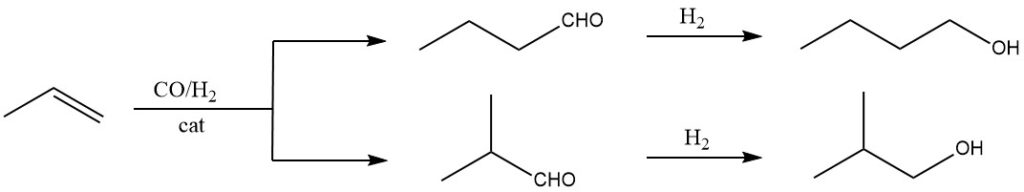
Este paso inicial produce aldehídos con un átomo de C adicional en comparación con las olefinas originales. Normalmente se obtienen mezclas isoméricas de aldehídos, como por ejemplo 1-butanal y 2-metilpropanal en el caso del propeno.
Existen varios procesos de hidroformilación con diferentes condiciones de reacción (presión, temperatura) y sistemas catalíticos.
El método tradicional de alta presión, que existió hasta principios de la década de 1970, opera a presiones de 20–30 × 106 Pa CO/H2 y temperaturas de 100–180 °C, utilizando Co como catalizador. Este proceso produce aproximadamente un 75% de 1-butanol y un 25% de 2-metil-1-propanol.
Los avances recientes han dado lugar a nuevas variaciones de procesos. Los métodos de presión más baja (1–5 × 106 Pa) que emplean catalizadores Rh modificados dan como resultado relaciones isoméricas de aproximadamente 92:8 o 95:5 para 1-butanol y 2-metil-1-propanol. Sin embargo, el uso de Rh no modificado puede aumentar el porcentaje de 2-metil-1-propanol hasta alrededor del 50%.
La hidrogenación catalítica de aldehídos es el paso siguiente, que conduce a la formación de los alcoholes correspondientes. En 2010, los principales productores de butanol fueron BASF, Oxea Group y Dow Chemical Company.
3.2. Producción de 1-butanol mediante el proceso Reppe
Un método alternativo para la producción de 1-butanol es la carbonilación de propeno, una técnica inventada por REPPE en 1942. En este proceso, las olefinas, el monóxido de carbono y el agua reaccionan bajo presión en presencia de un catalizador como la sal de amonio terciario. de hidruros de carbonilo de hierro polinucleares.

Este proceso utiliza condiciones de reacción diferentes a las de la hidroformilación catalizada por Co convencional. A una temperatura más baja (aproximadamente 100 °C) y presión reducida (0,5–2 × 106 Pa), el butanol se forma directamente a partir del propeno.
De manera similar a la síntesis oxo, se puede agregar monóxido de carbono a ambos átomos de C del doble enlace. En consecuencia, cuando se utiliza propeno como material de partida, se obtienen 1-butanol y 2-metil-1-propanol en una proporción de 86:14.
El catalizador empleado, triferrato de carbonilo, es sensible tanto al aire como a las temperaturas elevadas. En presencia de agua y CO2, se descompone en carbonato de hierro.
Para mantener velocidades de reacción suficientes, el catalizador debe estar presente en concentraciones de aproximadamente el 10% en la solución de reacción, condición que se logra mediante el uso de agentes disolventes como N-alquilpirrolidina.
A pesar de las relaciones n-iso favorables en los productos resultantes y las condiciones de reacción más suaves, el proceso de Reppe no ha logrado el mismo nivel de éxito que la hidroformilación de propeno con catalizadores de Co debido al elevado costo de la tecnología del proceso involucrada.
3.3. Producción de 1-butanol mediante hidrogenación de crotonaldehído
Hasta mediados del siglo XX, la producción de 1-butanol a partir de crotonaldehído era el método preferido, pero ha perdido importancia debido al desarrollo de procesos más competitivos.

Este proceso implicó reacciones de varios pasos, como sigue:
- Condensación aldólica: el acetaldehído sufre una condensación aldólica a temperatura y presión ambiente, lo que produce acetaldol con ~95 % de selectividad y ~60 % de conversión. El acetaldehído que no ha reaccionado se puede recuperar para su uso posterior.
- Deshidratación: la acidificación del acetaldol con ácido acético o ácido fosfórico promueve la eliminación de agua y la formación de crotonaldehído. . Este paso logra un rendimiento casi cuantitativo de crotonaldehído como destilado primario.
- Hidrogenación: varios procesos en fase gaseosa y líquida utilizan catalizadores de cobre para la hidrogenación eficiente de crotonaldehído a 1-butanol. Se puede lograr un rendimiento de ~1000 kg de 1-butanol por 1350 kg de acetaldehído.
La viabilidad económica de esta ruta depende de los costes de las materias primas. A medida que el petróleo crudo, la materia prima principal para la síntesis de oxo, se vuelve escaso y costoso, el etanol derivado de la fermentación puede surgir como una alternativa competitiva.
La abundancia y asequibilidad de la biomasa en los países tropicales y en las naciones en desarrollo que carecen de reservas de petróleo hacen que esta ruta sea particularmente atractiva. El etanol se puede deshidrogenar a acetaldehído, sirviendo como material de partida para este proceso.
3.4. Producción de 1-Butanol mediante fermentación de biomasa
La producción de 1-butanol mediante fermentación de biomasa fue un proceso industrial destacado que dominó el siglo XX. Después del aislamiento de Clostridium acetobutylicum por Chaim Weizmann en 1914, la llamada fermentación ABE (acetona, butanol, etanol) se convirtió en el segundo proceso biotecnológico más importante, sólo superado por la fermentación de etanol.
También surgieron y se utilizaron otras cepas de Clostridium productoras de butanol, como C. beijerinckii y C. saccharoperbutylacetonicum.
La fermentación ABE clásica empleaba un proceso por lotes que duraba entre 40 y 60 horas, utilizando biomasa que contenía almidón, como puré de maíz o melaza, como sustratos. Los productos se recuperaron y fraccionaron por destilación, dando rendimientos totales de 25-33 kg/100 kg de sustrato.
Las concentraciones de disolvente alcanzaron entre 12 y 20 g/l, con una concentración máxima de butanol de 14 g/l. Sin embargo, los bajos precios del petróleo crudo y los altos costos del sustrato a finales del siglo XX provocaron el declive de la fermentación industrial ABE, y las últimas plantas cerraron en Sudáfrica y China en 2004.
Sin embargo, el creciente interés en los biocombustibles y los productos químicos inició un interés comercial en la fermentación ABE, particularmente para el butanol. Han surgido nuevas plantas de fermentación en Brasil y China, mientras que empresas como Gevo y Butamax están investigando activamente la producción de butanol a partir de materias primas renovables.
Los esfuerzos de investigación se centran en maximizar el rendimiento de butanol como único producto de fermentación, mejorar la tolerancia al butanol del organismo productor y explorar sustratos alternativos no alimentarios como la celulosa y la hemicelulosa.
En teoría, C. acetobutylicum puede generar 0,41 g de butanol por gramo de glucosa según sus vías de fermentación. Los investigadores están investigando cepas mejoradas y condiciones de crecimiento para aumentar la proporción de butanol/acetona, utilizando ingeniería metabólica y transferencia de genes para mejorar la producción de butanol en otros organismos como E. coli.
Además, superar la baja tolerancia al butanol de C. acetobutylicum implica la selección de cepas y modificaciones de la fermentación, como la extracción o absorción de gas.
El éxito pasado y el reciente resurgimiento de la fermentación ABE resaltan su potencial para la producción sostenible de butanol. La investigación en curso para optimizar los rendimientos, la tolerancia y la utilización del sustrato allana el camino para una industria renovada del butanol de base biológica.
4. Usos del 1-Butanol
En los EE. UU., aproximadamente el 85 % del 1-butanol se utiliza principalmente en revestimientos de superficies. Sirve directamente como disolvente para barnices o se convierte en disolventes derivados o monómeros. Se mezcla con tolueno, etanol o ésteres específicos para la producción de lacas de nitrocelulosa y se utiliza solo como diluyente.
Se añade 1-butanol en una concentración del 5 al 10 % para evitar el «rubor» (opacidad blanca no deseada) causado por los diluyentes, especialmente los volátiles.
Ayuda a regular la viscosidad y mejora las propiedades de flujo de los barnices, y reduce las rayas en pinturas y lacas de goma/resina solubles en alcohol.
El 1-butanol se utiliza como mezcla hasta un 20% para diluir disolventes comunes (principalmente ésteres de ácidos carboxílicos saturados, particularmente acetatos) para poliestireno y caucho clorado.
El éster acrílico de 1-butanol es un componente clave de las pinturas de látex que ha ganado gran importancia desde la década de 1990 debido a su durabilidad y rentabilidad.
Los ésteres butílicos de los ácidos ftálico, adípico, sebácico, oleico, azelaico, esteárico y fosfórico sirven como plastificantes y aditivos en revestimientos de superficies, siendo el ftalato de di-1-butilo (DBP) el más importante. Sin embargo, el consumo de PPD se ha estancado o disminuido ligeramente desde 2000 en algunos países.
El 1-butanol se utiliza en la producción de butilaminas, particularmente en Estados Unidos, Alemania y Bélgica. También actúa como baño de coagulación para hilar fibras acrílicas y teñir fibras de poli(alcohol vinílico).
5. Toxicología del 1-Butanol
Toxicidad aguda:
- El 1-butanol exhibe una toxicidad moderada, siendo las dosis letales más bajas reportadas 790 mg/kg (oral, rata) y 3400 mg/kg (dérmica, conejo).
- La inhalación de altas concentraciones puede causar irritación respiratoria y ocular, falta de coordinación y narcosis. La concentración letal más baja publicada es 24,3 mg/L (ratas, inhalada, 4 horas).
- El contacto directo con los ojos con 1-butanol provoca una irritación corneal grave.
- La irritación de la piel es de leve a moderada en los conejos.
- Las pruebas genéticas (prueba de Ames) indican propiedades no mutagénicas.
Efectos crónicos:
- La exposición ocupacional a vapores de 1-butanol a 200 ppm o más se ha relacionado con inflamación de la córnea, sensación de ardor, visión borrosa y pérdida de audición.
- La exposición repetida a 100 ppm puede causar irritación ocular leve.
- Se ha informado que concentraciones más bajas (25 ppm) causan irritación leve y dolores de cabeza en algunas personas.
- La dermatitis de los dedos y las manos puede ocurrir con el contacto directo con la piel.
Límites de exposición:
- Límite máximo del valor umbral (TLV): 50 ppm (piel) [ACGIH]
- Concentración máxima permitida (valor MAK): 100 ml/m³ [Comisión Alemana para la Determinación de Sustancias Peligrosas]
- Valor TRGS 900: 100 ml/m³ [Normas técnicas alemanas para sustancias peligrosas]
Referencias
- Butanols; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a04_463.pub3
- Butyl Alcohols; Kirk-Othmer Encyclopedia of Chemical Technology. – https://onlinelibrary.wiley.com/doi/abs/10.1002/0471238961.0221202502091212.a01.pub2
