Trichloressigsäure

Trichloressigsäure (TCA), auch Trichlorethansäure genannt, ist ein farbloser hygroskopischer kristalliner Feststoff mit der chemischen Formel Cl3CCOOH. Es ist eine starke Säure und eine ätzende Substanz, die bei Kontakt Haut, Augen und anderes Gewebe schädigen kann.
Inhaltsverzeichnis
1. Physikalische Eigenschaften von Trichloressigsäure
Trichloressigsäure [76-03-9] liegt bei Standardtemperatur und -druck als hygroskopische, rhomboedrische Kristalle mit einem stechenden Geruch vor. Es weist eine hohe Löslichkeit in Wasser und verschiedenen organischen Lösungsmitteln auf. Zu den wichtigsten physikalischen Eigenschaften gehören:
- Molmasse: 163,4 g/mol
- Schmelzpunkt: 59,2 °C
- Siedepunkt: 197,6 °C bei 101,3 kPa; ~107 °C unter reduziertem Druck (2,8 kPa)
- Dichte bei 60 °C: 1,63 g/cm³
- Brechungsindex bei 65 °C: 1,459
- pKa: 0,70
- Dipolmoment: 3,23 D
2. Chemische Eigenschaften von Trichloressigsäure
Trichloressigsäure weist aufgrund der vollständigen Substitution von Methylwasserstoffen durch Chloratome eine starke Azidität (pKa = 0,7) auf, wodurch sie stabiler ist als Chloressigsäure und Dichloressigsäure und weniger anfällig für Substitutionsreaktionen von Chloratomen.
Unter wässrigen Bedingungen induzieren erhöhte Temperaturen die Zersetzung von Trichloressigsäure in Chloroform und Kohlendioxid. Dieser Prozess wird in Gegenwart organischer oder anorganischer Basen beschleunigt, während Anilin, Resorcin und Aktivkohle als Funktion dienen Katalysatoren unter wasserfreien Bedingungen.
Rein thermische Zersetzung findet erst oberhalb des Siedepunkts statt und ergibt chlorierte Kohlenwasserstoffe, Kohlenmonoxid, Kohlendioxid und Phosgen.
Trichloressigsäure bildet Salze mit verschiedenen anorganischen und organischen Basen. Diese Salze zersetzen sich beim Erhitzen in wässrigen Umgebungen und setzen Chloroform frei.
3. Herstellung von Trichloressigsäure
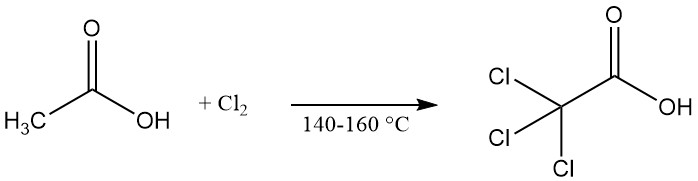
Trichloressigsäure wird kommerziell durch Chlorierung von Essigsäure, Chloressigsäure oder ihren Mutterlaugen bei erhöhten Temperaturen (140–160 °C) hergestellt. Als Katalysator zur Beschleunigung der Reaktion kann Calciumhypochlorit eingesetzt werden.
Der Einsatz von Schwermetallsalzen als Katalysatoren bleibt umstritten. Obwohl Beispiele wie Eisen- und Kupferverbindungen verwendet wurden, bestehen weiterhin Bedenken hinsichtlich ihrer Entfernung durch Fällung mit Schwefel- oder Phosphorsäure.
Zu den untersuchten alternativen Ansätzen gehören die Verwendung von 2 %iger Phosphorsäure oder die Kombination von Katalysatoren mit UV-Licht. Es wurden auch katalysatorfreie Methoden entwickelt.
Das resultierende Rohprodukt, das typischerweise etwa 95 % Trichloressigsäure enthält, wird durch Schmelzkristallisation gereinigt. Dadurch werden in der Mutterlauge vorhandene Verunreinigungen effektiv entfernt. Eine weitere Steigerung der Reinheit kann durch Zentrifugation oder zusätzliche Umkristallisationsschritte erreicht werden.
Bei Verwendung von Schwefelsäure als Katalysator bei höheren Reaktionstemperaturen (bis zu 180 °C) ist eine Nachreinigung nicht erforderlich.
4. Verwendung von Trichloressigsäure
Vor den 1990er Jahren war die Hauptanwendung von Trichloressigsäure die Herstellung ihres Natriumsalzes, das als selektives Herbizid und in Kombination mit 2,4-D und verwendet wurde 2,4,5-T-Formulierungen zur vollständigen Unkrautbekämpfung. Aufgrund ökotoxikologischer Bedenken ist diese Anwendung jedoch deutlich zurückgegangen.
Über Herbizide hinaus findet Trichloressigsäure vielfältige Verwendung in verschiedenen Bereichen:
- Bei der Metalloberflächenbehandlung wird Trichloressigsäure als Ätz- und Beizmittel eingesetzt
- Es wird als Quellmittel und Lösungsmittel in der Kunststoffindustrie verwendet.
- In der Biochemie, zur Fällung von Proteinen, Albumin, DNA und RNA
- Hilfsmittel in der Textilveredelung
- Es wird als Additiv hinzugefügt, um die Hochdruckeigenschaften von Schmierölen zu verbessern.
- Aufgrund seiner ätzenden Natur wird Trichloressigsäure in kontrollierten Umgebungen zur Entfernung von Warzen und Hornhaut sowie zur Behandlung bestimmter Hauterkrankungen eingesetzt.
- Trichloressigsäure und ihre Ester dienen als wertvolle Ausgangsstoffe für verschiedene organische Synthesen.
- Die Säure zeigt charakteristische Farbreaktionen und ermöglicht die Identifizierung verschiedener organischer Verbindungen in der analytischen Chemie.
5. Derivate der Trichloressigsäure
5.1. Trichloracetylchlorid
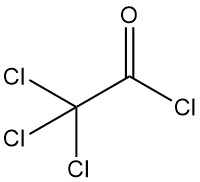
Trichloracetylchlorid [76-02-8] hat die chemische Formel Cl3CCOCl und eine Molmasse von 197,9 g/mol physikalische Eigenschaften ähnlich wie Dichloracetylchlorid:
- Siedepunkt: 118 °C bei 101,3 kPa
- Dichte bei 20°C: 1,620 g/cm³
- Brechungsindex bei 20 °C: 1,4695
Trichloracetylchlorid hydrolysiert leicht zu Trichloressigsäure und Salzsäure bei 75–85 °C in Wasser. Es reagiert mit Ammoniumhydroxid oder konzentrierten Natriumcarbonatlösungen unter Bildung entsprechender Salze.
Trichloracetylchlorid wird nach verschiedenen Methoden hergestellt:
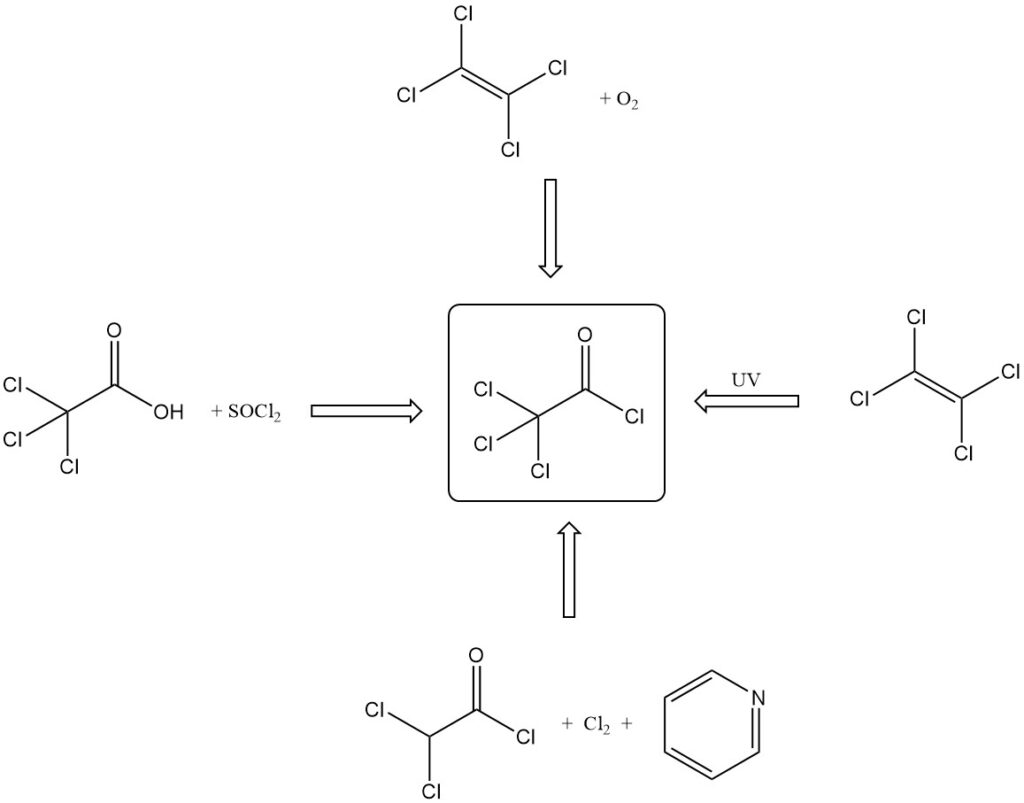
- Durch Reaktion von Trichloressigsäure mit anorganischen Säurechloriden (SOCl2, PCl3) oder P2O5 und HCl.
- Durch Tetrachlorethylenoxidation mit rauchender Schwefelsäure, Sauerstoff oder rauchender Salpetersäure und Schwefelsäure.
- Durch photochemische Oxidation von Tetrachlorethylen mit UV-Licht, radioaktiver Bestrahlung oder Sensibilisierung mit Chlor/Jod.
- Durch die Reaktion von Dichloracetylchlorid mit Pyridin und Chlor.
Trichloracetylchlorid wird zur Herstellung von Trichloressigsäureestern, -anhydriden und Pestiziden (z. B. Chlorpyrifos) sowie als Ausgangsmaterial für die Synthese von Trifluoressigsäure verwendet.
5.2. Trichloressigsäureester
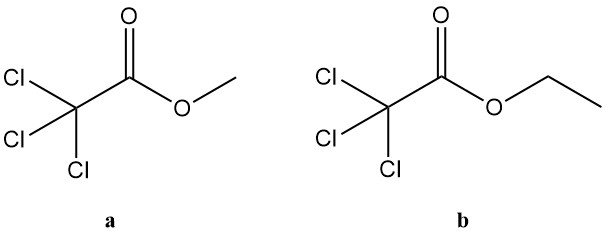
Trichloressigsäureester umfassen eine breite Gruppe von Verbindungen, aber nur die Methyl- und Ethylderivate sind von großem industriellem Interesse. Diese beiden Ester finden Anwendung in verschiedenen Bereichen:
- Lösungsmittel: Obwohl Methyl- und Ethyltrichloracetat nicht ihre primäre Verwendung sind, können sie bei Bedarf als Nischenlösungsmittel fungieren.
- Diese Ester dienen als wertvolle Ausgangsmaterialien für die Synthese anderer Verbindungen, insbesondere von Amiden und Polyalkoholestern. Diese Derivate wurden auf ihre potenzielle Verwendung als Weichmacher untersucht und bieten spezifische Funktionalitäten oder Eigenschaften, die in herkömmlichen Weichmachern nicht ohne weiteres verfügbar sind.
- Ethyltrichloracetat findet breitere Anwendung als Co-Katalysator in Ziegler-Typ-Polymerisationen.
Als Referenz sind hier einige wichtige physikalische Eigenschaften der beiden industriell relevanten Ester aufgeführt:
a. Methyltrichloracetat:
- CAS-Nummer: 598-99-2
- Formel: Cl3CCOOCH3
- Molmasse: 177,43 g/mol
- Siedepunkt: 153 °C (bei 101,3 kPa)
- Dichte: 1,4864 g/cm³ (bei 20 °C)
- Brechungsindex: 1,4572 (bei 20 °C)
b. Ethyltrichloracetat:
- CAS-Nummer: 515-84-4
- Formel: Cl3CCOOCH2CH3
- Molmasse: 191,45 g/mol
- Siedepunkt: 167,5 °C (bei 101,3 kPa)
- Dichte: 1,3823 g/cm³ (bei 20 °C)
- Brechungsindex: 1,4505 (bei 20 °C)
5.3. Natriumtrichloracetat
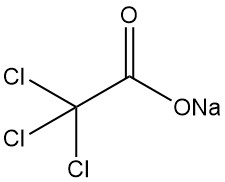
Natriumtrichloracetat (Cl3CCOONa), das einzige industriell bedeutsame Salz der Trichloressigsäure, weist mehrere Schlüsseleigenschaften auf:
Physikalische Eigenschaften:
- Ein farbloser Feststoff zersetzt sich unterhalb seines Schmelzpunktes.
- Gut löslich in Wasser und Methanol, mäßig löslich in anderen polaren Lösungsmitteln .
- Die Löslichkeit in Wasser nimmt mit der Temperatur zu (50 % bei 5 °C, 60 % bei 20 °C, 70 % bei 40 °C).
Chemische Eigenschaften:
- Im trockenen Zustand stabil, unterliegt jedoch in wässriger Lösung einer Hydrolyse, wodurch Natriumbicarbonat und Dichloressigsäure entstehen.
- Thermische Zersetzung bei erhöhten Temperaturen (125–170 °C) erzeugt Natriumchlorid, Trichloracetylchlorid, Kohlenmonoxid und Kohlendioxid.
- Reagiert mit Olefinen, wenn Phasentransferkatalysatoren verwendet werden.
Produktion:
Natriumtrichloracetat wird industriell durch Neutralisierung von Trichloressigsäure mit Natriumhydroxid oder Carbonat hergestellt.
Anwendungen:
- Natriumtrichloracetat fördert in Kombination mit Reduktionsmitteln und Metallsalzen die Vinylpolymerisation.
- Es unterstützt die Farbstoffaufnahme und -verteilung in Polyester- und Zellulosefasern.
- In durch Hitze entwickeltes Diazopapier wird es verwendet, um die Base bei erhöhten Temperaturen (100–200 °C) freizusetzen
- Es wurde früher als Herbizid zur Bekämpfung monokotyler Unkräuter mit einer Bodenhalbwertszeit von 1–2 Monaten eingesetzt; Bedenken hinsichtlich der Ökotoxizität führten jedoch zu weit verbreiteten Verboten in den USA, Kanada, der EU und Südamerika.
6. Toxikologie von Trichloressigsäure und Trichloracetat
Trichloressigsäure birgt aufgrund ihrer ätzenden Natur und der Fähigkeit zur Proteinausfällung mehrere Gesundheitsrisiken. Obwohl es nicht leicht über die Haut absorbiert wird, kann es bei Kontakt zu erheblichen Augen- und Hautreizungen führen.
Wichtige Toxizitätsdaten:
- Oral LD50: 3320–5060 mg/kg (Ratten)
- Niedrigste tödliche Dosis (Hündinnen): 1590 mg/kg
- Inhalation (4 Stunden, hohe Dosis): Keine signifikanten Auswirkungen bei Tieren beobachtet
- Akute menschliche Exposition: Haut- und Augenverbrennungen, Reizungen, Darm-Wirkungen
- Chronische Daten: Begrenzt, betrifft möglicherweise die oberen Atemwege
- Vorgeschlagener TLV-TWA: 1 ppm (7 mg/m³)
Zu den Bedenken hinsichtlich der Sicherheit von Trichloressigsäure gehören:
- Haut- und Augenschäden: Seine ätzenden Eigenschaften können zu Verbrennungen und Reizungen führen.
- Proteinbindung: verdrängt Arzneimittel von Proteinbindungsstellen und verändert möglicherweise deren Wirksamkeit.
- Begrenzte chronische Daten: Mögliche langfristige Auswirkungen erfordern weitere Untersuchungen.
Trichloracetat hat eine vorläufig tolerierte tägliche Aufnahme (PTDI) von 0,075 mg/kg Körpermasse. Dieser Wert basiert auf einer subchronischen Hundefütterungsstudie, bei der verschiedene Nebenwirkungen bei Dosen von ≥ 2000 mg/kg im Futter beobachtet wurden.
Unerwünschte Wirkungen wurden beobachtet, wie Verlust von Körpermasse, Unwohlsein, Gewebeschäden (Zahnfleisch, Mundschleimhaut), Veränderungen der weißen Blutkörperchen, abnormale Urinbefunde und Leber und Herzläsionen, Muskelschwund und beeinträchtigte Spermienproduktion.
Der nicht toxische Wirkungswert in der Nahrung betrug 500 mg/kg. In-vitro-Daten deuten auf kein mutagenes Potenzial hin.
Referenz
- Chloroacetic Acids; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a06_537.pub3
