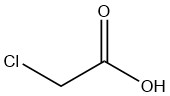
Reine Chloressigsäure ist ein farbloser, hygroskopischer kristalliner Feststoff, der in verschiedenen kristallinen Formen vorliegt. Es handelt sich um eine synthetische Verbindung, die erstmals 1841 von N. LEBLANC als Chlorierungsprodukt von Essigsäure entdeckt wurde. R. HOFFMANN synthetisierte sie später im Jahr 1857, indem er die Chlorierung von Essigsäure mithilfe von Sonnenlicht einleitete.
Chloressigsäure und ihr Natriumsalz gelten hinsichtlich ihrer industriellen und wirtschaftlichen Bedeutung als die bedeutendsten Chlorierungsprodukte der Essigsäure.
Inhaltsverzeichnis
1. Eigenschaften von Chloressigsäure
Chloressigsäure hat eine ausgezeichnete Wasserlöslichkeit und eine gute Löslichkeit in Methanol, Aceton, Diethylether und Ethanol, ist jedoch in Kohlenwasserstoffen und chlorierten Kohlenwasserstoffen nur schwer löslich.
1.1. Chemische Reaktionen von Chloressigsäure
Die chemischen Eigenschaften von Chloressigsäure lassen sich auf die hohe Reaktivität ihrer Carbonsäuregruppe und die leichte Substitution ihres α-Chloratoms zurückführen.
Chloressigsäure und ihre Derivate wie Salze, Ester, Anhydride, Säurechloride, Amide und Hydrazide werden häufig als synthetische organische Zwischenprodukte verwendet.
Zu den industriellen Anwendungen von Chloressigsäure gehören Reaktionen mit anorganischen und organischen Basen, die Salze ergeben. Einige Salze können auch Addukte mit Chloressigsäure bilden, und Natriumchloracetat ist ein wichtiges Handelsprodukt.
Chloressigsäureester wie Methyl-, Ethyl- und tert.-Butylchloracetat werden durch Reaktion mit Alkoholen oder Olefinen synthetisiert.
Chloracetylchlorid wird aus Chloressigsäure durch Reaktion mit verschiedenen Reagenzien wie POCl3, PCl3, PCl5, Thionylchlorid (SOCl2) oder Phosgen (COCl2) hergestellt.
Die Säure kann auch mit Chloracetylchlorid reagieren, um Bis(chloressigsäure)anhydrid zu erzeugen, das durch Dehydratisierung von Chloressigsäure mit P2O5 oder durch Reaktion mit Essigsäureanhydrid erhalten werden kann.
Chloracetylchlorid bildet mit anderen Carbonsäuren gemischte Anhydride, beispielsweise Essigsäurechloressigsäureanhydrid.
Die nukleophile Substitution des Chloratoms ist eine wichtige Reaktion, wenn Chloressigsäure als Zwischenprodukt in organischen Synthesen verwendet wird.
Beispielsweise ergibt die Hydrolyse neutraler oder basischer wässriger Lösungen von Chloressigsäure Glykolsäure (Hydroxyessigsäure) und Diglykolsäure (2,2′-Oxydiessigsäure), eine industrielle Methode zur Herstellung dieser Verbindungen.
Durch Erhitzen der Salze der Chloressigsäure entsteht das Glykolid 1,4-Dioxin-2,5-dion. Durch Reaktion mit Natrium- oder Kaliumhydrogensulfid entstehen Thioglykolsäure und Thiodiglykolsäure.
Chloressigsäure reagiert auch mit Ammoniak, wobei je nach Reaktionsbedingungen Aminoessigsäure (Glycin) als Hauptprodukt oder Nitrilotriessigsäure entsteht.
Wenn Methylchloracetat mit Ammoniak bei niedriger Temperatur reagiert, entsteht Chloracetamid. Durch die Reaktion mit tertiären Aminen in alkalischen Lösungen entstehen verschiedene kommerziell wichtige Betaine, beispielsweise N-Laurylbetain.
Darüber hinaus unterliegen aromatische Verbindungen wie Naphthalin einer elektrophilen Substitution mit Chloressigsäure an geeigneten Katalysatoren, um Arylessigsäuren zu bilden.
Die kommerziell wichtige Cyanessigsäure, die als Zwischenprodukt bei der Herstellung von synthetischem Koffein dient, wird durch Reaktion von Kaliumcyanid mit Chloressigsäure in einer neutralen Lösung synthetisiert.
Jodessigsäure entsteht durch Reaktion mit Kaliumiodid, während Phenoxyessigsäuren durch Phenol veretherung in Gegenwart von Natriumhydroxid synthetisiert werden.
Darüber hinaus werden Carboxymethylderivate mit einem relativ hohen Veretherungsgrad durch Reaktion von Polysacchariden wie Cellulose, Stärke, Guar usw. in einem stark alkalischen Natriumhydroxidmedium synthetisiert.
2. Herstellung von Chloressigsäure
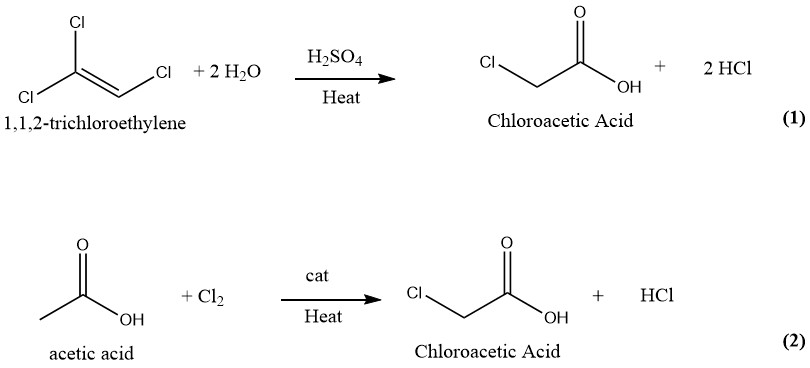
Für die Herstellung von Chloressigsäure wurden zahlreiche Techniken vorgeschlagen und patentiert. In der Vergangenheit umfasste die industrielle Produktion von Chloressigsäure die Hydrolyse von 1,1,2-Trichlorethylen mit Schwefelsäure als Katalysator (1) und die Chlorierung von Essigsäure mit Chlor als Katalysator (2). Allerdings wird derzeit nur das letztere und ältere Verfahren zur Herstellung von Chloressigsäure im industriellen Maßstab eingesetzt.
2.1. Hydrolyse von Trichlorethylen
Chloressigsäure kann in einem kontinuierlichen Verfahren hergestellt werden, bei dem gleiche Mengen Trichlorethylen und 75 %ige Schwefelsäure bei 130–140 °C umgesetzt werden. Bei vollständiger Umsetzung von Trichlorethylen enthält die Reaktionsmischung etwa 50 % Chloressigsäure und 1–2 % Wasser.
Anschließend wird die Mischung einer Vakuumdestillation unterzogen, um reine Chloressigsäure zu erhalten. Dabei werden die Dämpfe mit Wasser gewaschen, das anschließend als Verdünnungsmittel für Schwefelsäure wiederverwendet wird.
Das dabei entstehende Chlorwasserstoffgas wird mit frischem Trichlorethylen gewaschen und anschließend durch Einfrieren und Absorption in Wasser gereinigt.
Diese Methode liefert 1000 kg Endprodukt und 700–750 kg HCl-Gas als Nebenprodukt aus 1500–1850 kg Trichlorethylen und 600 kg H2SO4 (95 %).
Das Trichlorethylen-Verfahren zur Herstellung von Chloressigsäure erzeugt hochreine Chloressigsäure, die frei von Di- oder Trichloressigsäure ist. Aufgrund der hohen Kosten von Trichlorethylen und der erheblichen Menge an HCl, die als Nebenprodukt entsteht, wird diese Methode jedoch nicht mehr verwendet.
Das Reinigungsverfahren umfasst die Trennung von Chloressigsäure von Trichlorethylen, Schwefelsäure und Wasser.
2.2. Chlorierung von Essigsäure
2.2.1. Synthese
Eine hochselektive Umwandlung von Essigsäure in Chloressigsäure ist durch Chlorierung von Essigsäure unter Einsatz geeigneter Katalysatoren erreichbar. Die Reaktion nutzt Essigsäureanhydrid als Katalysator, was den folgenden Reaktionsmechanismus ermöglicht:
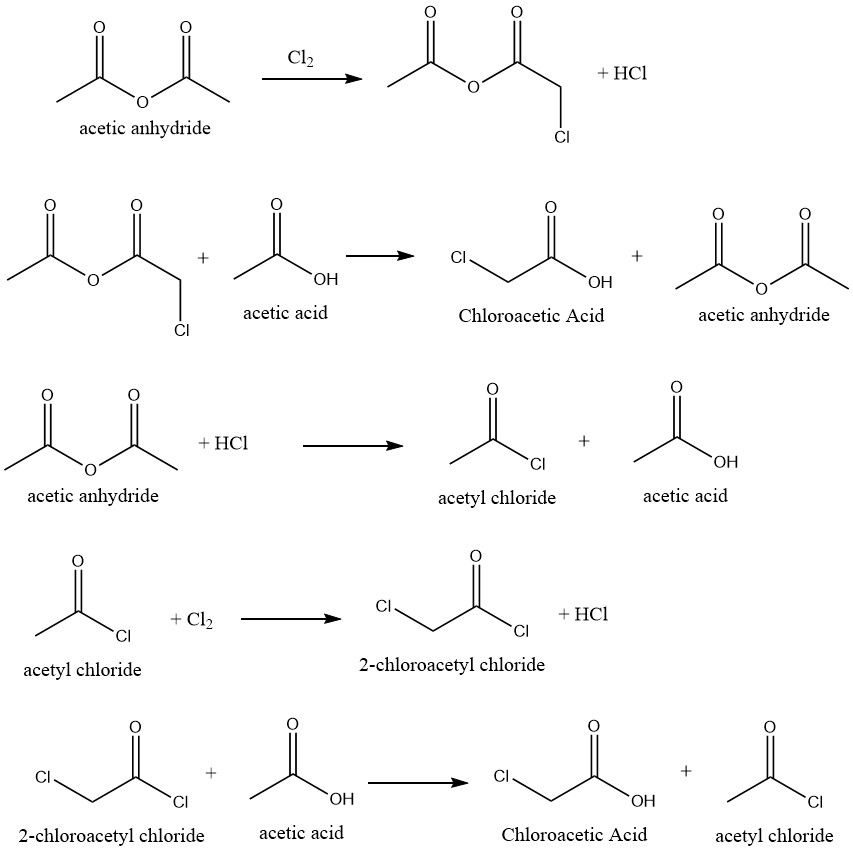
Es wurden mehrere Inhibitoren vorgeschlagen, um die Bildung von Dichloressigsäure zu verhindern, die durch die Chlorierung von Chloressigsäure im Rohgemisch entsteht. Auf diese Weise entfällt oder verringert sich der Bedarf an Reinigungsprozessen zur Herstellung technischer Produkte.
2.2.2. Reinigung
Um bei vielen Produkten den erforderlichen Reinheitsgrad zu erreichen, ist eine Trennung von Di- und Trichloressigsäure erforderlich. Allerdings machen die nahe beieinander liegenden Siedepunkte dieser Chloressigsäuren eine fraktionierte Destillation unpraktisch.
Für die Abtrennung von Dichloressigsäure wurden alternative Techniken wie die azeotrope Destillation und die extraktive Destillation vorgeschlagen, deren Wirksamkeit jedoch weiterhin ungewiss ist.
Ein wichtiger industrieller Reinigungsprozess ist die lösungsmittelfreie Kristallisation, die auf der α-Modifikation des höheren Schmelzpunkts von Chloressigsäure basiert. Die Di- und Trichloressigsäure werden nach der Kristallisation aus der Mutterlauge entfernt.
Die Kristallisation kann in stationären Fingerkristallisatoren oder Rührrührkristallisatoren erfolgen. Eine Zentrifuge wird verwendet, um die Mutterlauge von der Kristallaufschlämmung nach der Kristallisation in letzterer zu trennen.
Anschließend wird das Produkt mit Wasser oder Essigsäure gewaschen. Die reine Chloressigsäure wird üblicherweise geschmolzen und in Flocken umgewandelt. Bei stationären Maschinen erfolgt die Kristallisation mittels Kaltfingern.
Wenn die gesamte Chloressigsäure kristallisiert ist, wird die Mutterlauge abgelassen und das reine kristalline Produkt geschmolzen und in Flocken zerkleinert.
Als alternative Reinigungsmethode wurde ein Dünnschichtkristallisationsverfahren mit Rohstoffen vorgeschlagen.
Darüber hinaus wurde über lösungsmittelbasierte Kristallisationsprozesse unter Verwendung von Tetrachlorkohlenstoff, Dichlormethan oder Kohlenwasserstoffen mit drei Chloratomen berichtet, die zu leicht filtrierbaren Kristallen führten.
Unabhängig von der verwendeten Methode entsteht eine Mutterlauge bestehend aus Essigsäure, Chloressigsäure sowie Di- und Trichloressigsäure. Unter idealen Bedingungen kann diese Mischung weiter chloriert werden, um die nützliche Trichloressigsäure zu ergeben.
Eine bedeutendere Reinigungsmethode beinhaltet die katalytische Hydrodechlorierung unerwünschter Nebenprodukte wie Dichlor- und Trichloressigsäure. Di- und Trichloressigsäuren können durch katalytische Hydrierung bei hoher Temperatur entchlort werden, typischerweise unter Verwendung von Palladium auf einem Träger (z. B. Kohlenstoff oder Kieselgel).
Bei der katalytischen Hydrodechlorierung in der Dampfphase wird Dichloressigsäure hauptsächlich in Essigsäure umgewandelt. Die Verwendung fein dispergierter, inerter Träger mit Pd in der flüssigen Phase bei 130–150 °C führt jedoch zu einer selektiven Dechlorierung unter Bildung von Chloressigsäure.
Es wurden auch Modifikationen dieses Verfahrens vorgeschlagen, beispielsweise das Besprühen von Rohsäure mit Wasserstoffgas unter Vakuum oder das Tröpfeln von Säure über den Katalysator in einem Festbett. Die Zugabe von HCl zur Rohsäure vor dem Kontakt mit dem Katalysator im Festbett erhöht die Selektivität und verseift Säurechloride und -anhydride vor der Entchlorung.
Der Pd-Katalysator auf einem Kieselgelträger (40–200 mm Partikelgröße) ist hochaktiv und selektiv, co-katalytisch wirksame Zusätze wie Natriumacetat können die Ergebnisse zusätzlich verbessern.
Die Oberflächenanreicherung des Edelmetalls erhöht die Katalysatoreffizienz und verbrauchter Katalysator kann durch Chlorbehandlung reaktiviert werden.
Durch den Einsatz von Pd-Katalysatoren auf optimierten Aktivkohleträgern werden Überreduktionsnebenprodukte (z. B. Aldehyde) während des Hydrierungsschritts reduziert, der mit einem Schleifenreaktor durchgeführt werden kann.
Eine Methode zur Verringerung der Dichloressigsäurekonzentration in Chloressigsäure von 2000 auf 210 ppm kann durch die Verwendung von Nichtedelmetallkatalysatoren bei 100 bis 140 °C ohne Wasserstoff erreicht werden.
Abbildung 1 zeigt einen industriellen Chlorierungsprozess, bei dem eine Mischung aus Essigsäure, Essigsäureanhydrid und recyceltem Acetylchlorid im Reaktor (a) bei 90–140 °C chloriert wird. Das gebildete HCl-Gas enthält nur Spuren von Chlor.
Das resultierende Gemisch aus Chloressigsäure, Essigsäure und Essigsäureanhydrid wird unter Verwendung wassergekühlter Kondensatoren (b) kondensiert und in den Reaktor zurückgeführt. Im HCl-Gas mitgeführtes Acetylchlorid wird in einem anschließenden Niedertemperaturprozess (c) zurückgewonnen und recycelt.
Das HCl-Gas wird gereinigt und in konzentrierte wässrige Salzsäure umgewandelt.
Die rohen Essigsäuren können vor dem Entchlorungsschritt, der bei 120–150 °C unter Verwendung eines Palladiumkatalysators und eines großen Wasserstoffüberschusses durchgeführt wird, vakuumdestilliert werden (d). Essigsäure wird über Kopf aus der Vakuumfraktionierungskolonne (i) entnommen, während das Sumpfprodukt reine Chloressigsäure ist.
Falls gewünscht, kann die Chloressigsäure durch Destillation weiter gereinigt werden, um hochsiedende Verunreinigungen, wie die Kondensationsprodukte von Aldehyden, die während des Hydrierungsschritts entstehen, zu entfernen.
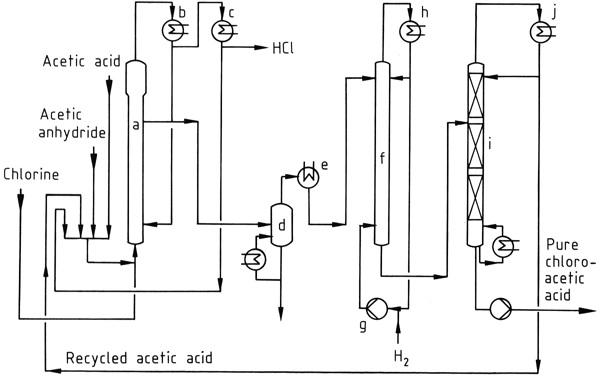
a) Chlorierungsreaktor; b) Kondensator für Essigsäure, Essigsäureanhydrid, Chloressigsäure; c) Kondensator für Acetylchlorid; d) Verdampfer; e) Kondensator für Chloressigsäure; f) Hydrierungsreaktor; g) Wasserstoffkompressor; h) Kondensator; i) Destillationskolonne; j) Kondensator für Essigsäure
3. Verwendung von Chloressigsäure
Chloressigsäure ist eine vielseitige chemische Verbindung, die in einer Vielzahl industrieller Anwendungen eingesetzt wird. Eine seiner Hauptanwendungen ist die Herstellung von Carboxymethylcellulose (CMC), die jährlich mehrere hunderttausend Tonnen anfällt.
Neben CMC kann Chloressigsäure auch mit Stärke unter Bildung von Carboxymethylstärke reagieren, die ebenso häufig verwendet wird wie CMC. Obwohl auch andere Polysaccharide mit Chloressigsäure modifiziert werden können, werden sie nicht so häufig eingesetzt.
Eine weitere wichtige Anwendung von Chloressigsäure ist die Herstellung von Herbiziden auf Basis von Arylhydroxyessigsäuren, insbesondere Chlorphenoxyalkansäuren. Diese Herbizide gehören zu den am häufigsten in der Landwirtschaft eingesetzten Herbiziden.
Darüber hinaus werden Chloressigsäure und Methylchloracetat bei der Herstellung des Insektizids Dimethoat sowie der Herbizide Benazolin und Methyl-b-naphthyloxyacetat verwendet.
Eine dritte wichtige Verwendung von Chloressigsäure ist die Herstellung von Thioglykolsäure, auch Mercaptoessigsäure genannt. Dies wird durch die Reaktion von Chloressigsäure mit Natrium- oder Kaliumhydrogensulfid oder anderen Schwefelverbindungen erreicht.
Thioglykolsäure wird in verschiedenen Formen eingesetzt, einschließlich ihrer Salze, Ester oder Derivate. Der Großteil der produzierten Thioglykolsäure wird zur Herstellung von Stabilisatoren für Poly(vinylchlorid) verwendet.
Es wird auch in der Haarkosmetik sowie in anderen industriellen Anwendungen eingesetzt, beispielsweise bei der Herstellung langkettiger Betaine wie N-Laurylbetain, bei denen es sich um Tenside handelt, die in Reinigungsmitteln und Körperpflegeprodukten verwendet werden.
Zusätzlich zu diesen Anwendungen findet Chloressigsäure eine Vielzahl weiterer Einsatzmöglichkeiten in organischen Synthesereaktionen. Beispielsweise können Cyanessigsäure oder ihre Ester zur Herstellung von Koffein und Barbituraten verwendet werden, die wichtige Hypnotika sind.
Chloressigsäure kann mit aromatischen Kohlenwasserstoffen zu Arylessigsäuren kondensieren.
Bei der Reaktion mit Naphthalin entsteht als Hauptprodukt 1-Naphthylessigsäure und als Nebenprodukt 2-Naphthylessigsäure. Von beiden Stoffen ist bekannt, dass sie das Pflanzenwachstum fördern.
Schließlich spielt Chloressigsäure eine wesentliche Rolle bei der Synthese von Cumarin und Vitamin B6.
Referenz
- Chloroacetic Acids; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a06_537.pub3

