Tetrahydrofuran (THF): Eigenschaften, Reaktionen, Herstellung und Verwendung
Tetrahydrofuran (THF), auch Oxolan genannt, ist ein zyklischer Ether mit der chemischen Formel C4H8O. Es hat eine breite Anwendung in der chemischen Industrie.
Inhaltsverzeichnis
1. Physikalische Eigenschaften von Tetrahydrofuran
Tetrahydrofuran (THF) ist eine farblose, flüchtige, polare Flüssigkeit, die im Handel mit einer Reinheit von mindestens 99,9 Gew.-% (bei Destillation) erhältlich ist. Es besitzt einen charakteristischen acetonähnlichen Geruch. THF ist vollständig mit Wasser, Alkoholen, Ethern und anderen gängigen Lösungsmitteln mischbar.
Tabelle 1 zeigt einige physikalische Eigenschaften von THF.
| Eigenschaft | Wert |
|---|---|
| Molmasse | 72,1 g/mol |
| Siedepunkt | 66 °C |
| Schmelzpunkt | -108,5 °C |
| Kritische Temperatur | 267 °C |
| Kritischer Druck | 5,19 MPa |
| Kritische Dichte | 0,322 g/cm3 |
| Dichte bei 20 °C | 0,886 |
| Brechungsindex bei 20 °C | 1.4073 |
| Spezifische Wärmekapazität | 1,765 J g⁻¹ K⁻¹ |
| Verdampfungswärme (66 °C, 101,3 kPa) | 435 J/kg |
| Verbrennungswärme | -35.141 kJ/kg |
| Explosionsgrenzen in Luft (25 °C) | 1,5 Vol.-% (unten), 12,0 Vol.-% (oben) |
| Flammpunkt (Abel-Pensky) | -22 °C |
| Dipolmoment | 5,84 × 10⁻³⁰ C m |
| Dielektrizitätskonstante (20 °C) | 7.6 |
2. Chemische Reaktionen von Tetrahydrofuran
Tetrahydrofuran ist ein wertvoller Ausgangsstoff für wichtige Reaktionen. Dazu gehört die kationische Polymerisation mit gleichzeitiger Ringöffnung von THF zur Herstellung hochmolekularer bifunktioneller Glykolether mit unterschiedlichen Kettenlängen.
Diese Produkte sind von wirtschaftlicher Bedeutung bei der Herstellung lebenswichtiger Kunststoffe. Darüber hinaus sind Ringspaltungsreaktionen von Tetrahydrofuran die Grundlage für die Dehydratisierung zu Butadien, die Oxidation zu Bernsteinsäure, und Carboxylierung zu Adipinsäure oder γ-Valerolacton.
THF ist das bevorzugte Reaktionsmedium zur Durchführung von Grignard-Reaktionen oder Reduktionen mit Reagenzien wie LiAlH4. Es wird auch als Ligand in Koordinationskomplexen verwendet, wie sie gelegentlich bei stereospezifischen Polymerisationen eingesetzt werden.
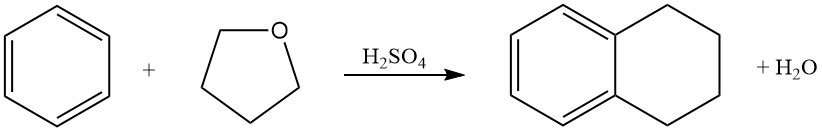
Benzol reagiert mit Tetrahydrofuran in Schwefelsäure unter Bildung von Tetralin (1,2,3,4-Tetrahydronaphthalin).
Allerdings reagiert THF leicht mit Sauerstoff (z. B. bei Kontakt mit Luft) und bildet als Primärprodukt ein instabiles Hydroperoxid. Der Zusatz von Hydrochinon oder 2,6-Di-tert-butyl-p-kresol (BHT) (z. B. 250 mg/kg) kann die Peroxidbildung hemmen. Durch die Destillation von Tetrahydrofuran, das Peroxide enthält, werden die Peroxide konzentriert, was selbst im Labormaßstab zu einer hohen Explosionsgefahr führt.
3. Herstellung von Tetrahydrofuran
3.1. Herstellung von Tetrahydrofuran aus Acetylen und Formaldehyd
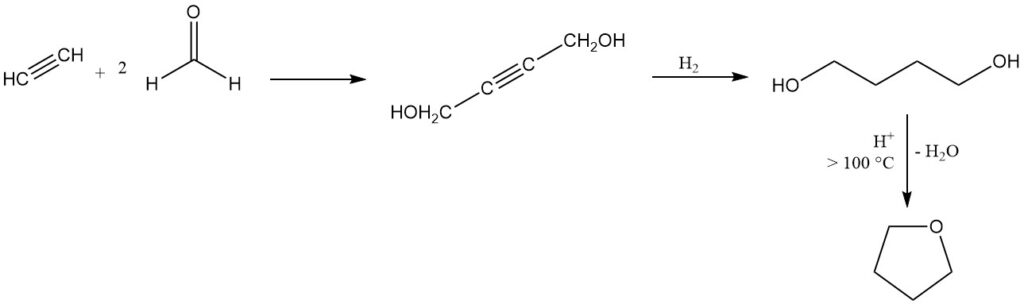
Tetrahydrofuran wird nach dem in den 1930er Jahren entwickelten Reppe-Verfahren hergestellt, das in Europa und den Vereinigten Staaten nach wie vor eine vorherrschende industrielle Methode ist.
Bei diesem Verfahren reagiert Acetylen mit Formaldehyd zu 2-Butin-1,4-diol, gefolgt von einer Hydrierung zu 1,4-Butandiol, das anschließend eine säurekatalysierte Cyclisierung unter Abspaltung von Wasser über 100 °C zu THF durchläuft.
Für diese Cyclisierung eignen sich mehrere Katalysatoren, darunter anorganische Säuren, saure Alumosilikate sowie Erd- oder Seltenerdmetalloxide. Eine nahezu quantitative Umwandlung und eine Ausbeute von nahezu 100 % können in einem kontinuierlichen Prozess bei Atmosphärendruck unter Verwendung von Aluminiumoxid als Katalysator erreicht werden.
Dies erfordert eine kontinuierliche Abdestillation des gebildeten Tetrahydrofurans aus dem Reaktionsgemisch bei gleichzeitiger Zufuhr von reinem 1,4-Butandiol mit entsprechender Verbrauchsrate. Dieses Verfahren weist eine hohe Katalysatoreffizienz auf und ermöglicht eine erhebliche THF-Produktion pro Katalysatoreinheit.
BASF hatte ein Mitteldruckverfahren zur selektiven Umwandlung von Rohbutandiol zu THF mit minimalem Zusatzenergieaufwand entwickelt.
Das aus der Cyclisierung erhaltene THF-Dampf-Gemisch wird zunächst rektifiziert, um das entsprechende Azeotrop (5,3 Gew.-% Wasser, Siedepunkt 62,3 °C) zu isolieren, das mit Alkalihydroxid behandelt wird, gefolgt von einer Destillation, um wasserfreies THF zu erhalten.
Industrielle Prozesse können die Bildung azeotroper Gemische durch Destillation unter Druck verhindern.
3.2. Herstellung von Tetrahydrofuran durch Butadienacetoxylierung
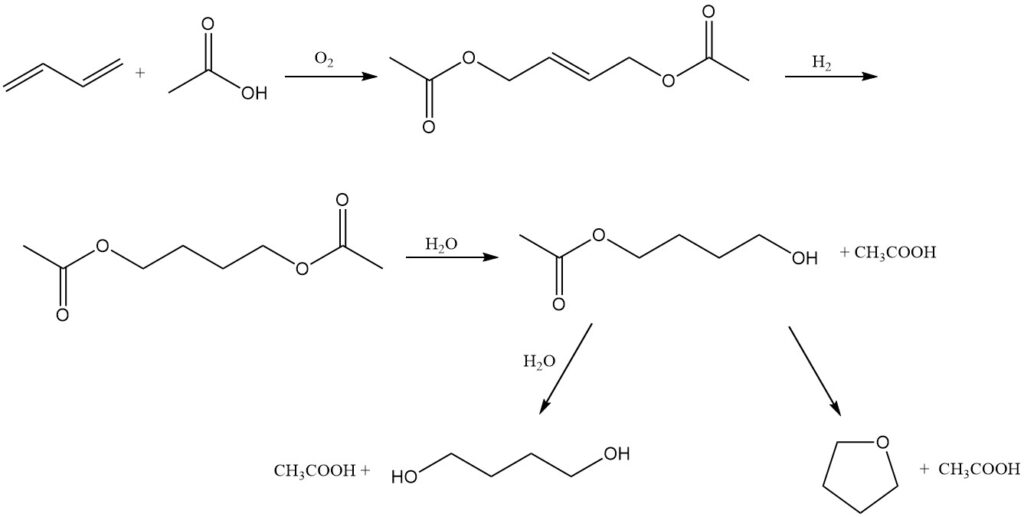
Mitsubishi-Kasei Corporation in Japan bietet einen alternativen Weg für die Koproduktion von 1,4-Butandiol und Tetrahydrofuran unter Verwendung von Butadien als Ausgangsmaterial. Dieser Vorgang lässt sich durch folgende Reaktionen erklären:
Oxidation: Butadien wird bei 3 MPa und 80 °C in Gegenwart eines Palladium-Tellur-Katalysators oxidiert, Essigsäure und ein Stickstoff-Sauerstoff-Gemisch. Diese Reaktion ergibt 1,4-Diacetoxy-2-buten.
Hydrierung: Das erhaltene 1,4-Diacetoxy-2-buten wird dann hydriert, um 1,4-Diacetoxybutan zu bilden.
Hydrolyse: Schließlich wird 1,4-Diacetoxybutan zu 1,4-Butandiol oder THF hydrolysiert.
3.3. Herstellung von Tetrahydrofuran durch Propylenoxidverfahren
Arco produziert 1,4-Butandiol durch einen Prozess, der die folgenden Schritte umfasst:
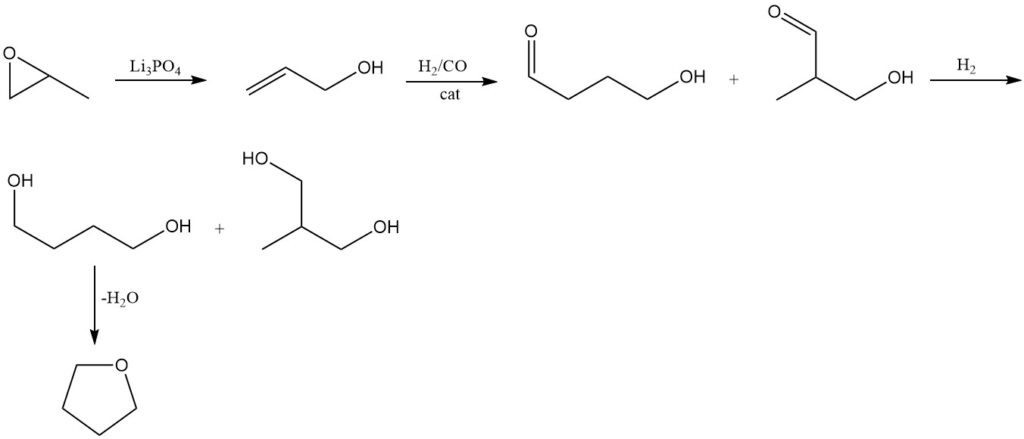
Propylenoxid wird mit herkömmlichen Methoden bei 250–300 °C und 1 MPa Druck über einem Trilithiumorthophosphat (Li3PO4)-Katalysator zu Allylalkohol isomerisiert.
Der resultierende Allylalkohol wird nach dem Kuraray-Verfahren hydroformyliert. Bei dieser Reaktion entsteht 4-Hydroxybutyraldehyd als Primärprodukt und 3-Hydroxy-2-methylpropionaldehyd als Nebenprodukt.
Bei der anschließenden Hydrierung der erhaltenen Aldehyde entsteht als Hauptprodukt 1,4-Butandiol, begleitet von der Bildung von 2-Methyl-1,3-propandiol.
Wie bei den vorherigen Methoden wird Tetrahydrofuran durch Dehydratisierung von 1,4-Butandiol unter Verwendung eines Säurekatalysators hergestellt.
3.4. Herstellung von Tetrahydrofuran durch Maleinsäureanhydrid-Hydrierung
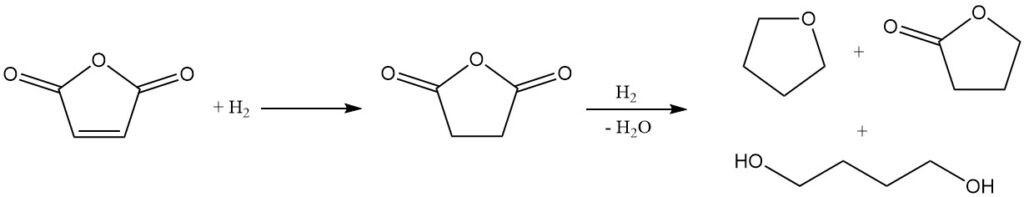
Aufgrund seiner chemischen Struktur ist Maleinsäureanhydrid ein vielversprechender Ausgangsstoff für die Synthese von Butandiol, THF und γ-Butyrolacton. Mitsubishi-Kasei entwickelte und implementierte ursprünglich ein Verfahren im industriellen Maßstab unter Verwendung von Maleinsäureanhydrid. Allerdings haben sie diese Methode inzwischen zugunsten ihres neueren Butadienacetoxylierungsverfahrens aufgegeben.
Mehrere Unternehmen, darunter Davy-McKee Ltd., BP, Sohio und Shinwha Petrochemical, haben ähnliche Verfahren für die Herstellung von Butandiol und Tetrahydrofuran übernommen. Beispielsweise betreibt Shinwha Petrochemical in Südkorea eine Anlage nach dem McKee-Verfahren mit einer Kapazität von 20.000 Tonnen Butandiol pro Jahr.
Der erste Schritt in diesem Prozess ist die Dampfphasenhydrierung von Ethylmaleat. Die Reaktionsbedingungen können manipuliert werden, um das Verhältnis von THF zu Butandiol in der Endproduktmischung zu steuern.
Es besteht ein wachsendes Interesse an der Verwendung von Maleinsäureanhydrid als Ausgangsstoff für die Tetrahydrofuran-Produktion, und es scheint als möglicher Ersatz für das Reppe-Verfahren an Bedeutung zu gewinnen.
3.5. Herstellung von Tetrahydrofuran durch das n-Butan-Maleinsäureanhydrid-Verfahren
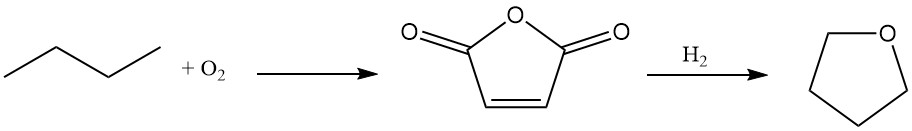
Du Pont bietet ein neuartiges zweistufiges Verfahren zur Tetrahydrofuran-Synthese unter Verwendung von n-Butan als Ausgangsmaterial.
n-Butan wird mithilfe eines einzigartigen, transportablen und abriebfesten Oxidationskatalysators mit hoher Ausbeute (70–75 %) zu Maleinsäureanhydrid oxidiert.
Die resultierende wässrige Maleinsäurelösung wird über einem speziellen Rhenium-dotierten Palladiumkatalysator hydriert. Dieser Schritt bietet Flexibilität und ermöglicht die selektive Produktion von Butandiol oder THF je nach Prozessanforderungen.
Der Prozess wurde erfolgreich pilotiert und in der spanischen Provinz Asturien mit einer jährlichen Produktionskapazität von 45.000 Tonnen implementiert.
3.6. Herstellung von Tetrahydrofuran durch Pentosan/Furfural-Prozesse
Das Interesse an der Herstellung von Tetrahydrofuran aus Furfural ist aufgrund der Nutzung nachwachsender Rohstoffe gestiegen. Pentosane, die in landwirtschaftlichen Abfallprodukten reichlich vorhanden sind, sind die Ausgangsstoffe.
Der Prozess zur THF-Herstellung aus Furfural umfasst zwei katalytische Schritte:
- Furfural wird einer katalytischen Decarbonylierung unterzogen, um Furan zu bilden.
- Das Furan wird dann hydriert, um THF zu ergeben.
4. Verwendung von Tetrahydrofuran
Tetrahydrofuran wird in einer Vielzahl von Bereichen eingesetzt, wobei das größte Volumen als Monomer für Poly(tetramethylenoxid) (PTMO), auch bekannt als Poly(tetramethylenetherglykol) (PTMEG) oder Polytetrahydrofuran (PTHF), vorliegt. PTMO ist ein wichtiger Bestandteil bei der Herstellung von:
- Thermoplastische Polyurethane
- Elastische Fasern
- Geformte Elastomere
- Copolyester
- Copolyamide
- Polyurethanbeschichtungen
Kommerzielles PTMO ist unter verschiedenen Handelsnamen erhältlich, darunter Terathane (DuPont), Polytetrahydrofuran (BASF) und Polymeg (Quaker Oats).
Ein kleinerer Teil von THF wird als Lösungsmittel für Anwendungen wie Beschichtungen, Klebstoffe und Speziallacke auf Basis von Materialien wie Poly(vinylchlorid) (PVC) oder Polyurethanen verwendet und als Colösungsmittel in Druckfarben, als Extraktionsmittel und als Reaktionsmedium, insbesondere für metallorganische Synthesen in der organischen Chemie.
Es ist außerdem ein übliches Laborreagenz und ein Zwischenprodukt bei der chemischen Synthese von Verbraucher- und Industrieprodukten wie Nahrungsmitteln, Pharmazeutika und Insektiziden.
5. Toxikologie von Tetrahydrofuran
Umfangreiche Untersuchungen des Instituts für Arbeitshygiene und Pharmakologie der BASF legen nahe, dass THF eine minimale Toxizität aufweist, vergleichbar mit Aceton, im Gegensatz zu früheren Berichten, die wahrscheinlich auf unreinen Proben basierten.
Tierstudien mit chronischer THF-Exposition (1 Jahr bei 1000 ppm, 2 Jahre bei 3000 ppm) zeigten keine signifikanten Vergiftungssymptome bei Ratten, Katzen oder Kaninchen. Allerdings würden diese Konzentrationen (1000-3000 ppm) beim Menschen zu starken Schleimhautreizungen führen.
Ähnlich wie Ethanol wird THF vom Körper schnell verstoffwechselt.
Aufgrund seiner starken Lösungsmitteleigenschaften löst Tetrahydrofuran die äußeren Keratinschichten von Haut und Schleimhäuten auf und dringt schnell in tiefere Gewebe ein. Diese Eigenschaft führt zu starken Reizungen, löst jedoch keine Sensibilisierung (allergische Reaktion) aus.
Die Peroxidbildung während der Lagerung kann die Hautreizung verschlimmern und der Kontakt mit Wunden oder unter den Fingernägeln kann erhebliche Schmerzen hervorrufen.
THF wird leicht über die Haut absorbiert, ähnlich wie Methanol. Längerer Hautkontakt sollte vermieden werden und ein geeigneter Handschutz wird empfohlen.
Der festgelegte Arbeitsplatzgrenzwert für Tetrahydrofuran liegt bei 200 ppm (ml/m³). Dieser Wert soll lokale Schleimhautreizungen durch THF-Dämpfe bekämpfen und nicht seine narkotischen Wirkungen, die viel höhere Konzentrationen erfordern.
Referenzen
- Tetrahydrofuran, Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a26_221.pub3
- Polyethers, Tetrahydrofuran and Oxetane Polymers; Kirk-Othmer Encyclopedia of Chemical Technology. – https://onlinelibrary.wiley.com/doi/10.1002/0471238961.2005201816182103.a01
- Tetrahydrofuran; Hamilton & Hardy’s Industrial Toxicology. – https://onlinelibrary.wiley.com/doi/10.1002/9781118834015.ch70
