Ethylamin: Eigenschaften, Reaktionen, Herstellung und Verwendung
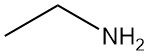
Was ist Ethylamin?
Ethylamin, auch bekannt als Ethanamin, ist ein primäres aliphatisches Amin mit der chemischen Formel C2H5NH2. Es ist bei Raumtemperatur ein brennbares Gas mit ammoniakartigem Geruch.
Ethylamin kommt auf natürliche Weise in Obst und Gemüse, Getreide, Kaffee, Käse und Meeresfrüchten vor. Es ist auch ein Bestandteil von Tabakrauch.
Inhaltsverzeichnis
1. Physikalische Eigenschaften von Ethylamin
Ethylamin ist eine farblose, entzündbare Flüssigkeit oder ein Gas, je nach Umgebungstemperatur. Es ist eine schwache Base mit ammoniakartigem Geruch und einer Geruchsschwelle im Bereich zwischen 0,027 ppm und 3,5 ppm. Es ist mit Wasser, Ethanol und Ether mischbar.
Bei der Verbrennung von Ethylamin entstehen giftige Stickoxide. Im Handel wird Ethylamin als 70%ige wässrige Lösung oder als Druckgas verkauft.
Die physikalischen Eigenschaften von Ethylamin sind in der folgenden Tabelle aufgeführt:
| Eigenschaft | Wert |
|---|---|
| CAS-Nummer | [75-04-7] |
| Chemische Formel | C2H5NH2 |
| Molekularmasse | 45,09 g/mol |
| Schmelzpunkt | -80,6 °C |
| Siedepunkt Punkt | 16,6 °C |
| Dichte bei 20 °C | 0,6829 g/cm3 |
| pKb bei 25 °C | 3,25 |
| Brechungsindex | 1,3663 |
| Dampfdichte | 1,56 |
| Dampfdruck bei 20 °C | 121 kPa |
| Flammpunkt | -52 °C |
| Selbstentzündungstemperatur | 385 °C |
| Verbrennungswärme bei 25 °C (flüssig) | -1713,3 kJ/mol |
| Verdampfungswärme | 6.845,1 g cal/g.mol |
| Oberflächenspannung bei 25 °C | 19,20 mN/m |
2. Reaktionen von Ethylamin
Ethylamin ist ein schwaches primäres Amin, das sich in Wasser löst und eine basische Lösung bildet. Es ist eine stärkere Base als Ammoniak und reagiert mit organischen oder anorganischen Säuren zu Salzen, die in Wasser sehr gut löslich, in organischen Lösungsmitteln jedoch unlöslich sind.
Beispielsweise entsteht bei der Reaktion von Ethylamin mit Salzsäure Ethylammoniumchlorid und mit Propansäure Ethylammoniumpropionat.
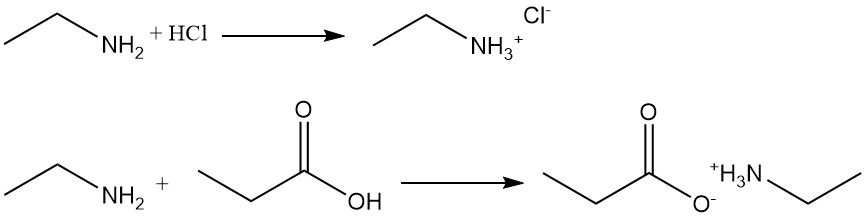
Ethylamin reagiert mit Carbonsäuren und deren Estern, Chloriden und Anhydriden zu den entsprechenden Amiden. Die Reaktion mit Carbonsäurechloriden ist eine stark exotherme Reaktion, die sehr gute Ausbeuten liefert. Bei der Reaktion mit Carbonsäuren entsteht häufig Ammoniumsalz, das zur Herstellung der Amide erhitzt werden muss.
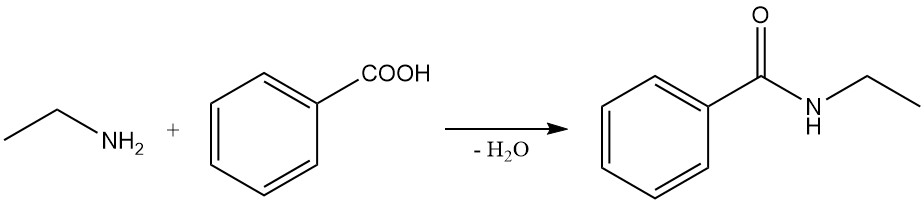
Beispiele für diese Reaktionen sind die Reaktion von Benzoesäure und Ethylamin zu N-Ethylbenzamid und die Reaktion von Ethylamin mit Bernsteinsäureanhydrid zu 1-Ethylpyrrolidin-2,5-dion und N1,N4-Diethylsuccinamid.
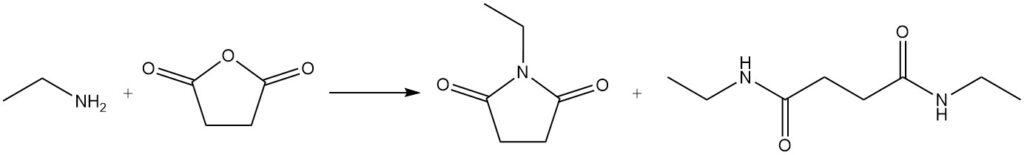
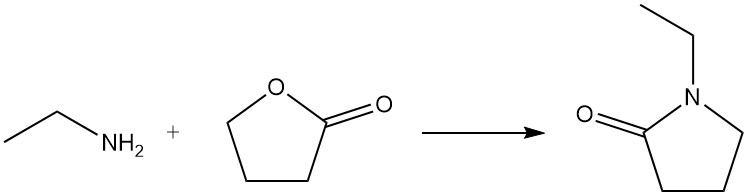
Wenn Ethylamin mit einem Lacton reagiert, entsteht ein Lactam; beispielsweise wird 1-Ethyl-2-pyrrolidon aus Ethylamin und γ-Butyrolacton hergestellt.
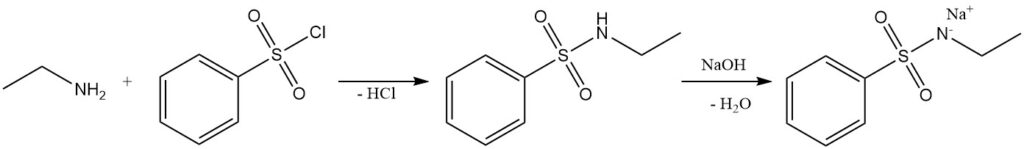
Durch die Reaktion von Ethylamin mit Benzolsulfonylchlorid (Hinsberg-Test) entsteht das alkalilösliche N-Ethylbenzolsulfonamid.
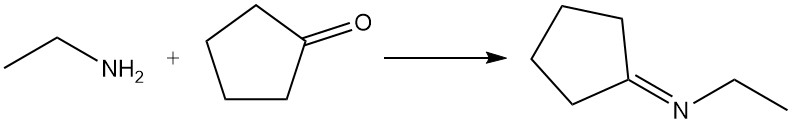
Abhängig von den Reaktionsbedingungen reagieren Aldehyde und Ketone mit Ethylamin zu Iminen (Schiff-Basen) oder Enaminen; diese Produkte können hydriert werden, um höher alkylierte Amine zu ergeben. Aldehyde reagieren im Allgemeinen schneller als Ketone. Ein häufiges Beispiel ist die Reaktion von Ethylamin und Cyclopentanon zu N-Ethylcyclopentanimin.
Ethylcyclohexylamin, ein wichtiges Amin, das in vielen Industriezweigen verwendet wird, entsteht durch die Reaktion von Ethylamin mit Cyclohexanon und anschließender Hydrierung.
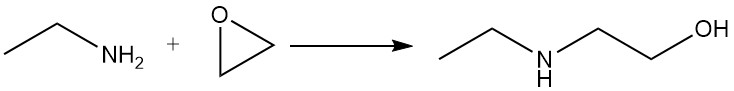
Ethylamin reagiert mit Epoxiden zu einem Gemisch aus Mono- und Dioxyethylderivaten.
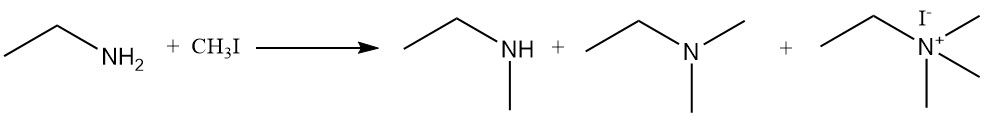
Bei der Reaktion von Ethylamin mit Alkylhalogeniden und Dialkylsulfaten entsteht ein Gemisch aus sekundären und tertiären Aminen sowie quartären Ammoniumverbindungen. Ein Beispiel ist die Reaktion von Ethylamin und Methyliodid zu einem Gemisch aus N-Methylethanamin, N,N-Dimethylethanamin und N,N,N-Trimethylethylammoniumiodid.
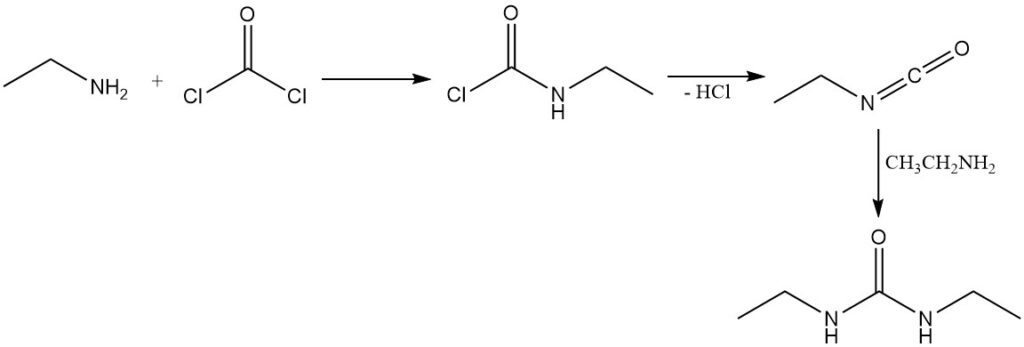
Bei der Reaktion von Phosgen mit Ethylamin entsteht zunächst Ethylcarbamidsäurechlorid, durch anschließende Eliminierung des Chlorwasserstoffs entsteht Isocyanatoethan. Überschüssiges Ethylamin reagiert dann mit Isocyanatoethan zu 1,3-Diethylharnstoff.
Ethylamin reagiert unter basischen Bedingungen (Kaliumhydroxid oder Natriumhydroxid) mit Chloroform zu Ethylisonitril.

Durch die Addition von Ethylamin an Acrylnitril entsteht 3-(Ethylamino)propannitril, das leicht zum entsprechenden N-Ethyl-1,3-propandiamin hydriert werden kann.

Die Oxidation von Ethylamin mit Wasserstoffperoxid unter Verwendung von mit Wolfram dotierten Zeolithen als Katalysatoren erzeugt Acetaldehydoxim.
Die Dehydrierung von Ethylamin erzeugt Acetonitril.
3. Herstellung von Ethylamin
3.1. Herstellung von Ethylamin aus Ammoniak und Ethanol
Die katalytische Reaktion von Ethanol mit Ammoniak ist die vorherrschende Methode zur Ethylaminsynthese. Dieser Prozess erzeugt aufgrund der Reaktivität von Ethylamin mit Ethanol gleichzeitig Diethylamin und Triethylamin als Nebenprodukte.
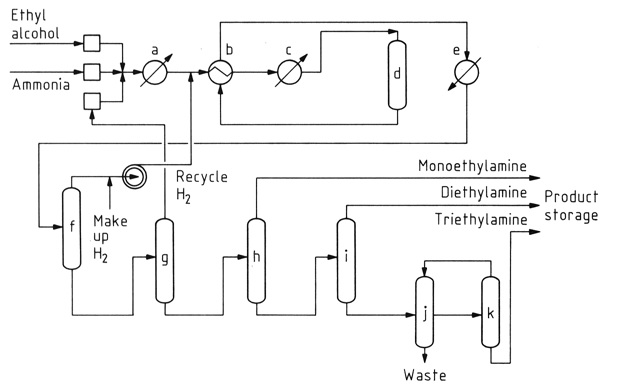
a) Verdampfer; b) Wärmetauscher; c) Überhitzer; d) Katalysator; e) Produktkühler; f) Gasabscheider; g) Ammoniaksäule; h) Monoethylaminsäule; i) Diethylaminsäule; j) Dekanter; k) Triethylaminsäule
Während die anfängliche Umwandlung von Ethanol in Ethylamin nahezu energieneutral ist, ist die Bildung sekundärer und tertiärer Amine exotherm, was ihre thermodynamische Produktion begünstigt. Reaktionsbedingungen, einschließlich Temperatur, Ammoniaküberschuss und Verweilzeit, beeinflussen die Produktverteilung.
In der Vergangenheit wurden Dehydratationskatalysatoren (z. B. Aluminiumoxid, Siliciumdioxid) verwendet, in letzter Zeit haben sich jedoch Katalysatoren auf Metallbasis durchgesetzt. Häufig werden Nickel-, Kobalt-, Kupfer- und Eisenkatalysatoren verwendet, wobei Platin und Palladium aufgrund der möglichen Spaltung von C-C- oder C-N-Bindungen während der Reaktion weniger selektiv sind.
Aktivatoren wie Silber, Zink, Indium, Mangan, Molybdän und Alkalimetalle verbessern die Katalysatorleistung. Diese aktiven Komponenten werden typischerweise auf Aluminiumoxid, Siliciumdioxid oder Zirkoniumdioxid getragen, wobei Zeolithe eine höhere Selektivität für primäre Amine aufweisen.
Diese Reaktion findet in einem Festbettreaktor bei 0,5–25 MPa und 100–250 °C statt, je nach Katalysatortyp und Phase (flüssig oder gasförmig).
Der Mechanismus beinhaltet die Dehydrierung von Ethanol zu Acetaldehyd als geschwindigkeitsbestimmenden Schritt. Auf die anschließende Ammoniakzugabe, Wasserabspaltung und Imin- oder Enaminbildung folgt die Hydrierung zu Ethylamin.
Zu den Nebenreaktionen zählen die Amin-Disproportionierung (insbesondere bei höheren Temperaturen), die Aldolkondensation von Aldehydzwischenprodukten, die Schiff-Basenbildung und die Nitrilbildung unter bestimmten Bedingungen.
Ein zwei- bis achtfacher Ammoniaküberschuss verschiebt das Gleichgewicht in Richtung der Ethylaminbildung.
3.2. Herstellung von Ethylamin aus Acetaldehyd
Acetaldehyd, das durch Oxosynthese leicht zugänglich ist, ist aufgrund seiner wirtschaftlichen Vorteile ein bevorzugter Vorläufer von Ethylamin im Vergleich zu Ethanol. Bei diesem Verfahren handelt es sich um eine zweistufige Reaktion: Zunächst wird aus Acetaldehyd und Ammoniak ein Imin (Schiff-Base) gebildet, anschließend erfolgt die Hydrierung zu Ethylamin.

Bei diesem Verfahren wird ein Festbettkatalysator und ein Reaktionsgemisch aus Acetaldehyd, Ammoniak und Wasserstoff verwendet. Alternativ kann ein zweistufiges Verfahren vorteilhaft sein, bei dem Iminbildung und anschließende Hydrierung getrennt werden.
Der Dampfphasenbetrieb bei 100–160 °C und atmosphärischem oder leicht erhöhtem Druck ist üblich. Hochdruckbedingungen können mit effektiven Wärmeabfuhrsystemen wie hohen Recyclingraten oder Mehrrohrreaktoren verwendet werden. Niedrigere Reaktionstemperaturen im Vergleich zur Alkoholaminierung könnten möglicherweise eine höhere Selektivität erzielen.
Die Katalysatoren ähneln im Allgemeinen denen, die bei der Alkoholaminierung verwendet werden. Das Rohethylamin wird durch Destillation gereinigt.
Obwohl es alternative Reduktionsmittel gibt, bleibt Wasserstoff aufgrund von Handhabungs- und Kostenüberlegungen die erste Wahl in der Industrie.
3.3. Andere Verfahren
Ethylamin kann durch Zugabe von Ammoniak zu Ethylen unter Verwendung saurer Zeolithkatalysatoren wie H-Mordenit hergestellt werden. Obwohl die Umwandlung bei der direkten Aminierung von Ethylen gering ist, da sie durch kinetische Faktoren und das thermodynamische Gleichgewicht begrenzt ist, ist die Selektivität für Monoethylamin ausgezeichnet.
Ethylamin kann auch selektiv durch Elektroreduktion von Acetonitril bei Umgebungstemperatur und -druck unter Verwendung von Cu-Nanopartikeln als Elektrokatalysator hergestellt werden. Dieses Verfahren ist jedoch industriell nicht von Bedeutung.
4. Verwendung von Ethylamin
Ethylamin wird hauptsächlich als Vorläufer für Triazinherbizide durch Reaktion mit Cyanurchlorid verwendet. Atrazin, das vorherrschende Triazinherbizid, wird zur Bekämpfung von breitblättrigem und grasartigem Unkraut eingesetzt, hauptsächlich im Mais- und Sorghum-Anbau. Simazin, ein weiteres von Ethylamin abgeleitetes Triazin, wird im Zitrus- und Zuckerrohranbau verwendet.
Außer für Herbizide wird Ethylamin bei der Synthese verschiedener Chemikalien verwendet. Es reagiert mit Methallylchlorid zu Ethylmethallylamin, einem wichtigen Zwischenprodukt bei der Herstellung des Dinitroanilin-Herbizids Ethalfluralin. Darüber hinaus dient Ethylamin als Vorläufer von Ethylcyclohexylamin, das anschließend in das Thiocarbamat-Herbizid Cycloat umgewandelt wird.
Es wird auch in der Harzindustrie, der Erdölraffination und der Herstellung von Arzneimitteln, Korrosionsinhibitoren, Polyurethankatalysatoren und Textilmitteln verwendet.
Darüber hinaus wird Ethylamin als Lösungsmittelextraktionsmittel, Farbstoffzwischenprodukt, Gummilatexstabilisator und Laborreagenz eingesetzt. Es ist ein Zwischenprodukt bei der Herstellung von Reinigungsmitteln, fotografischen Farbstoffen, Emulgatoren und Farblösern. Ethylamin wurde als menschlicher Metabolit identifiziert.
Die Nachfrage nach Atrazin geht aufgrund von Umweltbedenken zurück, die in bestimmten Regionen zu Verboten geführt haben.
5. Toxikologie von Ethylamin
Ethylamin ist eine flüchtige, alkalische Verbindung, die leicht über die Haut und die Atemwege aufgenommen wird. Trotz der effizienten Ausscheidung über den Urin nach teilweiser Verstoffwechselung kann eine Exposition gesundheitsschädigende Wirkungen haben. Die primäre toxische Wirkung wird auf die ätzenden Eigenschaften zurückgeführt.
Akute und kurzfristige Toxizität
Ethylamin ist ein starker Reizstoff für Haut, Augen und Atemwege. Längerer Kontakt führt zu ätzenden Gewebeschäden.
Die akute orale LD50 bei Ratten beträgt 400 mg/kg, während die dermale LD50 bei Kaninchen 270 mg/kg beträgt. Die Inhalations-LC50 bei Ratten beträgt 5540 ppm (1-stündige Exposition). Die dermale Anwendung einer 70%igen wässrigen Lösung bei Meerschweinchen verursachte schwere Hautverbrennungen und Nekrosen.
Die okuläre Instillation einer 1%igen Lösung bei Kaninchen verursachte schwere Reizungen. Die kurzfristige Inhalation von 50 ppm verursachte bei Kaninchen Hornhautreizungen.
Industrielle Expositionen haben bei Menschen zu Augenreizungen und Hornhautödemen geführt. Es gibt Berichte über vorübergehende Sehstörungen (Glaukopsie), die denen durch Triethylaminexposition ähneln, obwohl der kausale Zusammenhang mit Ethylamin unklar ist.
Chronische Toxizität
Kaninchen, die 50 ppm Ethylamin ausgesetzt waren, zeigten Lungenschäden und Hornhautverletzungen. Eine höhere Konzentration von 100 ppm verursachte Nierenschäden. Ratten sind weniger empfindlich und zeigten bei 100 ppm nur geringe Reizungen. Bei 500 ppm traten nach 24-wöchiger Exposition Reizungen und Schäden in der Nase auf.
Langzeitstudien zur Bewertung des karzinogenen Potenzials fehlen. Studien zur fetalen Entwicklung sind ebenfalls nicht verfügbar.
Es liegen keine Daten zur chronischen Ethylaminexposition beim Menschen vor.
Genotoxizität
Bei In-vitro-Zellkultur-Genotoxizitätstests wurden positive Ergebnisse beobachtet. Ethylamin veränderte die DNA-Synthese bei Nagetieren nicht.
Ökotoxizität
Ethylamin weist eine mäßige bis geringe akute Toxizität für Wasserorganismen auf, mit LC50-Werten von 40 bis 1000 ppm für Goldfische und EC50-Werten von 100 bis 200 ppm für Daphnia magna.
Andere Gefahren
Ethylamin ist leicht entflammbar und kann explosive Dampfgemische bilden. Es ist ein starker Reizstoff für Augen, Nase und Atemwege.
Referenzen
- Amines, Aliphatic. Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/abs/10.1002/14356007.a02_001.pub2
- Ethylamine. – https://www.sciencedirect.com/science/article/abs/pii/B9780123864543005042
- https://www.sciencedirect.com/science/article/abs/pii/B9780128243152001949
- https://patents.google.com/patent/US20070112218A1/en
- https://www.nature.com/articles/s41467-021-22291-0
- https://products.basf.com/global/en/ci/ethylamine-solution-70
