Butanon: Reaktionen, Produktion und Verwendung
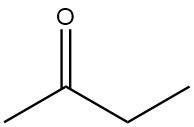
Butanon, auch bekannt als Methylethylketon, MEK, ist ein aliphatisches Keton und neben Aceton das wichtigste kommerziell hergestellte Keton. Es handelt sich um eine farblose, niedrigviskose, brennbare Flüssigkeit mit einem charakteristischen ketonartigen Geruch, der dem von Aceton ähnelt.
Butanon wird hauptsächlich durch den Dehydrierungsprozess von 2-Butanol synthetisiert, ähnlich der Herstellung von Aceton durch Dehydrierung von gasförmigem Isopropylalkohol unter Verwendung von Kupfer-, Zink- oder Bronzekatalysatoren bei Temperaturen im Bereich von 400 bis 550 °C.
Die 2-Butanol-Umwandlung erreicht 80 bis 95 % und die Selektivität von Butanon übersteigt 95 %. Zu den Nebenprodukten gehören Butene, die durch Dehydratisierung entstehen, und höhere Ketone, die durch Autokondensation entstehen. Die weltweite Produktion von Methylethylketon (MEK) erreichte im Jahr 2005 etwa 1 Million Tonnen.
Inhaltsverzeichnis
Seit den 1980er Jahren besteht ein wachsendes Interesse an der Verwendung von 2-Butanon als Lösungsmittel in Farben und Klebstoffen. Insbesondere MEK gilt als Konkurrent von Ethylacetat, insbesondere wenn es als niedrigsiedendes Lösungsmittel eingesetzt wird.
Seine Vielseitigkeit als Lösungsmittel erstreckt sich auf verschiedene Anwendungen wie Nitrozellulose, Zelluloseacetat-Butyrat, Ethylzellulose, Acrylharze, Vinylacetate und Vinylchlorid-Vinylacetat-Copolymer, vor allem bei der Herstellung synthetischer Oberflächenbeschichtungen.
Seine Eignung als Lacklösungsmittel wird auf seine niedrige Viskosität, die hohe Feststoffkonzentration und die große Auswahl an kompatiblen Verdünnungsmitteln zurückgeführt.
Die Streichung von MEK aus der Liste der gefährlichen Luftschadstoffe (HAP) im Jahr 2005 spielte eine wichtige Rolle bei der Aufrechterhaltung der Marktposition von Butanon in den Vereinigten Staaten. Darüber hinaus findet Butanon Verwendung als Aktivator bei oxidativen Reaktionen, als selektives Extraktionsmittel, als spezielles Lösungsmittel zum Entparaffinieren von Mineralölfraktionen und als chemisches Zwischenprodukt.
1. Physikalische Eigenschaften von Butanon
Butanon ist ein niedrigsiedendes, schnell verdampfendes Lösungsmittel mit einem Siedepunkt von 79,6 °C. Mit Wasser ist es nur teilweise mischbar, während es mit den meisten organischen Lösungsmitteln vollständig mischbar ist.
MEK bildet in Kombination mit Wasser und mehreren organischen Verbindungen binäre und ternäre azeotrope Gemische.
Zu den physikalischen Eigenschaften von Butanon gehören:
- Molmasse = 72,1 g/mol
- Schmelzpunkt = -86,7 °C
- Flüssigkeitsdichte bei 25 °C = 0,7995
- Brechungsindex bei 25 °C = 1,736
- Flüssigkeitsviskosität bei 25 °C = 0,395 mPa.s
- Löslichkeit bei 20 °C in Wasser = 27,5 %
2. Chemische Reaktionen von Butanon
Unter normalen Bedingungen und ohne Luftsauerstoff ist Butanon stabil. Bei längerer Lagerung ist Vorsicht geboten, da sich in Gegenwart von Sauerstoff Methylethylketonperoxid bildet. Aufgrund der sofortigen Zersetzung der Peroxide kann es zu Explosionen kommen.
2-Butanon ist unverseifbar sowie hitze- und lichtbeständig. Allerdings zersetzt es sich nach längerer UV-Einwirkung zu Ethan, Methan, Kohlenmonoxid, Ethylen und Diacetyl.
Diacetyl entsteht durch Oxidation von MEK mit Luft in Gegenwart spezieller Katalysatoren.
Methylethylketonperoxid, ein Polymerisationskatalysator, entsteht durch Oxidation von Butanon mit einer Lösung von Wasserstoffperoxid.
Salpetersäure und andere starke Oxidationsmittel oxidieren Butanon zu einer Mischung aus Ameisensäure und Propionsäure.
2-Butanol wird durch katalytische Reduktion von Butanon mit Wasserstoff, durch elektrolytische Reduktion in Natriumacetatlösung oder Reduktion mit Ammoniumamalgam oder Lithiumaluminiumhydrid gewonnen.
Ein weiteres Reduktionsprodukt ist 3,4-Dimethyl-3,4-hexandiol, das durch elektrolytische Reduktion von MEK in saurem Medium oder durch Reduktion mit Magnesiumamalgam gewonnen wird.
Methylethylketon zeigt eine Reaktivität gegenüber Cyanwasserstoff, Natrium- und Kaliumhydrogensulfiten, was zur Bildung von Additionsprodukten führt.
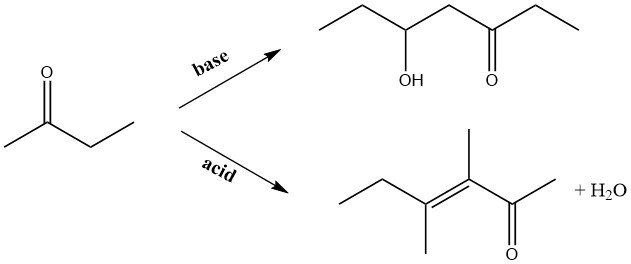
Unter alkalischen Bedingungen geht 2-Butanon Kondensationsreaktionen mit Aldehyden ein, die zur Bildung höher ungesättigter Ketone führen. Insbesondere bei der Verwendung von Formaldehyd entsteht Methylisopropylketon als Zwischenprodukt für nachfolgende Synthesen, was ein besonderes Interessengebiet darstellt.
Bei der basenkatalysierten Autokondensation in der Flüssigphase oder der Gasphasenkondensation an alkalisierten Kupferkatalysatoren reagiert die Carbonylgruppe im Molekül mit der Methylgruppe. Umgekehrt wird bei der säurekatalysierten Kondensation die der Carbonylgruppe benachbarte Methylengruppe zum Angriffspunkt.
Die Kondensation von Butanon und Citral führt zur Bildung von Methylpseudoionon, das anschließend eine Cyclisierung eingehen kann, um Methylionon zu ergeben. Diese Verbindung wird bei der Herstellung synthetischer Veilchenparfums eingesetzt.
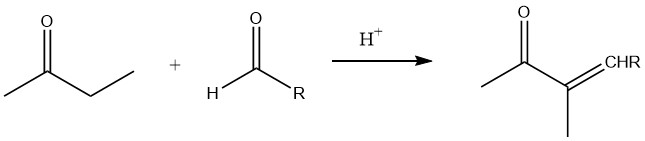
In Gegenwart niedermolekularer Aldehyde, insbesondere bei basenkatalysierter und säurekatalysierter Aldolisierung, ist vor allem die α-Position der Carbonylgruppe an der Reaktion beteiligt.
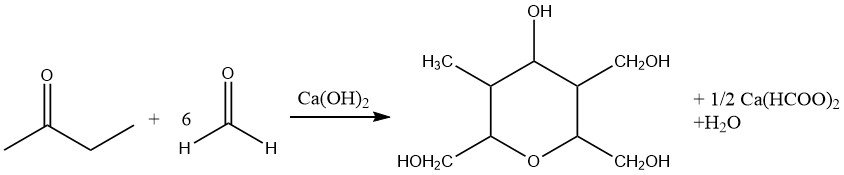
So führt der Einsatz von unterstöchiometrischen Mengen an Formaldehyd bei der basenkatalysierten Aldolisierung zur Bildung von 2-Methylbutan-1-ol-3-on. Darüber hinaus entsteht durch umfassende Hydroxymethylierung, begleitet von der Reduktion der Carbonylgruppe (gekreuzte Cannizzaro-Reaktion), Desoxyanhydroeneaheptit.
Wenn Methylethylketon mit primären und sekundären Alkoholen reagiert, entstehen höhere Ketone. Die Reaktion mit sec-Butylalkohol führt gezielt zur Bildung von Ethylamylketon.
Methylethylketon zeigt eine Reaktivität gegenüber Polyoxyverbindungen oder Epoxiden, was zur Bildung zyklischer Produkte führt.
Amylnitrit greift selektiv die CH2-Gruppe in α-Position zur Carbonylgruppe an und ergibt das Monooxim von Diacetyl.
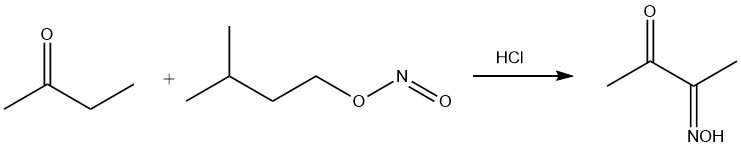
Die Ketogruppe reagiert mit Aminogruppen, was zur Wasserabspaltung führt. In Kombination mit Hydroxylamin ergibt diese Reaktion Methylethylketoxim, ein Antihautmittel.
Durch die Kondensation von Butanon mit aliphatischen Estern und Anhydriden entstehen β-Diketone.
Phenole reagieren mit Methylethylketon unter Bildung von Oxyphenylenverbindungen. Bei der Reaktion mit Phenol wird 2,2-Hydroxyphenylbutan erhalten, ein Homolog von Hydroxyphenylpropan (Bisphenol A). Bisphenol A ist ein wichtiger Stoff, der bei der Herstellung von Kunstharzen verwendet wird.
Methylethylketon kann an der α-Position einer Halogenierung unterzogen werden. Darüber hinaus reagiert es mit Grignard-Verbindungen, was zur Bildung tertiärer Alkohole führt.
In Gegenwart von Acetylen und Natriumamid wird 3-Methyl-1-pentin-3-ol synthetisiert. Durch Kombination von 2-Butanon mit N-Methylformamid kann N-Methylformylaminobutan erhalten werden. Darüber hinaus ermöglicht die Reformatzky-Reaktion die Herstellung von β-Oxyestern unter Verwendung von monobromsubstituierten Estern.
3. Herstellung von Butanon
Die primäre Methode zur Herstellung von Butanon beinhaltet die Dehydrierung von 2-Butanol (sec-Butylalkohol, SBA). Laut Angaben aus dem Jahr 2006 wird diese Verfahrenstechnik in etwa 92 % der weltweiten Produktionskapazitäten eingesetzt.
2-Butanol kann leicht durch einen zweistufigen Prozess der Hydratisierung von n-Butenen gewonnen werden, die aus petrochemischen C4-Raffinaten stammen. Als Katalysator wird bei diesem Verfahren flüssige Schwefelsäure eingesetzt. Alternativ beinhaltet ein einstufiges Verfahren die direkte Zugabe von Wasser zu einem stabilisierten sauren Ionenaustauscherharz, das als Katalysator dient.
Die restlichen 8 % des Methylethylketons werden durch eine fatale Produktionsmethode über die Fischer-Tropsch-Synthese oder durch katalytische Oxidation von flüssigem n-Butan hergestellt, was zur Bildung von Essigsäure und MEK als Nebenprodukt führt.
3.1. Katalytische Dehydrierung von sec-Butylalkohol (SBA) in der Gasphase
Die Dehydrierung von sec-Butylalkohol (SBA) unter Verwendung von Kupfer-, Zink- oder Bronzekatalysatoren ist eine endotherme Reaktion mit einer Wärmeänderung (ΔH) von -51 kJ/mol. Eine Erhöhung der Temperatur führt zu einem Anstieg der Butanonkonzentration im Reaktionsgemisch, das sich bei etwa 350 °C stabilisiert, sofern keine Folgereaktionen stattfinden.
Bei der Gasphasendehydrierung ist Kupfer der bevorzugte Katalysator, während Zink- oder Bronzekatalysatoren typischerweise höhere Dehydrierungstemperaturen (400 °C) erfordern.
Zinkoxidkatalysatoren weisen aufgrund einer Nebenreaktion, die die Dehydratisierung von SBA zu n-Butenen beinhaltet, häufig eine geringere Selektivität auf. Für die Dehydrierung von SBA werden Katalysatoren wie Platin auf Aluminiumoxid, Kupfer oder Chrom sowie Kupfer und Zink auf Aluminiumoxid empfohlen, insbesondere wenn SBA erhebliche Mengen Wasser enthält.
Handelsübliche Katalysatoren werden nach 3–6 Monaten Einsatz durch Oxidation mit Luft reaktiviert. Eine Reaktivierung wird erforderlich, wenn die Alkoholumwandlungsrate im Laufe der Zeit aufgrund einer Verunreinigung der aktiven katalytischen Stellen durch Wasser, Ablagerungen von Buten-Oligomeren und Di-sec-butylether abnimmt. Zur Entfernung dieser Verunreinigungen werden höhere Temperaturen und Oxidation eingesetzt.
Typischerweise weisen kommerzielle Katalysatoren eine Lebensdauer von mehreren Jahren oder mehr auf. Die Deutsche Texaco hat eine Prozesstechnologie zur MEK-Herstellung entwickelt, die auf der Dehydrierung von wasserfreiem sec-Butylalkohol mithilfe eines kupferbasierten Fällungskatalysators bei Temperaturen von 240–260 °C und Normaldruck basiert.
Bei dieser Technologie wird sec-Butylalkohol durch die direkte Hydratisierung von n-Butenen hergestellt, die durch ein temperaturstabilisiertes saures Ionenaustauscherharz katalysiert wird. Trotz dieses verbesserten heterogenen Verfahrens bleibt konzentrierte Schwefelsäure weltweit der Hauptkatalysator für die SBA-Produktion auf indirektem Weg.
Beim indirekten Weg wird das resultierende Zwischenprodukt Mono- oder Di-sec-butylsulfat aus dem ersten Reaktionsschritt in einem nachfolgenden Reaktionsschritt hydrolysiert.
Der flüssige sec-Butylalkohol wird in einem Verdampfer verdampft und der resultierende gasförmige Alkoholstrom wird in einen Rohrbündelreaktor geleitet, wo die Dehydrierung an einem Kupferkatalysator stattfindet. Der gasförmige Produktstrom verlässt den Reaktor und wird nach Abkühlung auf Umgebungstemperatur in eine flüssige Phase aus rohem Methylethylketon und eine gasförmige Wasserstoffphase getrennt.
Der Flüssigkeitsstrom enthält neben dem gewünschten MEK noch etwas nicht umgewandeltes SBA sowie 5-Methyl-3-heptanon, höhere Ketone und Wasser. Die Bildung von 5-Methyl-3-heptanon, höheren Ketonen und Wasser erfolgt durch Autokondensation von zwei oder mehr MEK-Molekülen.
Das 2-Butanon wird durch drei aufeinanderfolgende Destillationsschritte unter Atmosphärendruck gereinigt. Im ersten Schritt wird ein azeotroper Butanon-Wasser-Strom als Kopfprodukt gesammelt, der in einer separaten Batch-Destillationskolonne weiter gereinigt wird.
Die zweite Kolonne liefert das gewünschte reine MEK (typischerweise mit einer Reinheit über 99 %) zusammen mit SBA gemischt mit höheren Ketonen als Sumpfprodukt. Im letzten Destillationsschritt wird das nicht umgewandelte SBA als Kopfprodukt abdestilliert und in den Prozesszulauftank zurückgeführt. Die Sumpfprodukte dieses Schrittes bestehen aus den höheren Ketonen, die während des Syntheseprozesses als Nebenprodukte entstehen.
3.2. MEK als Nebenprodukt des Fischer-Tropsch-Coal-to-Liquid-Prozesses
Beim Fischer-Tropsch-Verfahren erfolgt eine katalytische Umwandlung von Kohlenmonoxid und Wasserstoff, sogenanntem Synthesegas, zu flüssigen Kohlenwasserstoffen. Dieser Prozess liefert ein breites Spektrum an Kohlenwasserstoffkettenlängen und eine erhebliche Menge verschiedener Nebenprodukte.
Ursprünglich in den 1920er Jahren von den deutschen Forschern Franz Fischer und Hans Tropsch entwickelt, wird das Fischer-Tropsch-Verfahren seit 1955 von SASOL Ltd., einem südafrikanischen Unternehmen, kommerziell genutzt und weiter verbessert, um synthetische Kraftstoffe aus Kohle herzustellen.
Der Prozess umfasst eine zweistufige Technik. Zunächst wird Mineralkohle vergast, um Synthesegas zu erzeugen, das anschließend durch Absorption in Wäschersystemen mithilfe der Rectisol-Technologie einer gründlichen Reinigung unterzogen wird. Das gereinigte Synthesegas wird anschließend katalytisch in Kohlenwasserstoffe umgewandelt.
Zusätzlich zu den Primärprodukten wie Olefinen, synthetischem Kraftstoff und Wachsen entsteht als Nebenprodukt eine Vielzahl wasserlöslicher Oxygenate, die während der Reaktion für eine Selektivität im Wasserstrom von etwa 3–6 % verantwortlich sind.
Zur Reinigung dieser Oxygenate, zu denen Alkohole, organische Säuren, Aldehyde, Butanon und andere Ketone gehören, werden herkömmliche Trenntechnologien eingesetzt, um hochwertige Lösungsmittelprodukte zu erzeugen.
3.3. Flüssigphasenoxidation von n-Butan
Bei der Flüssigphasenoxidation von n-Butan zu Essigsäure ist 2-Butanon ein Reaktionsnebenprodukt. Dieser Prozess beinhaltet die Autooxidation oder direkte Oxidation von n-Butan in der flüssigen Phase über einen radikalischen Reaktionsweg.
Bei der anfänglichen Oxidation entsteht MEK als Zwischenprodukt, das bei weiterer Oxidation MEK-Hydroperoxid bildet. Anschließend wird das MEK-Hydroperoxid in zwei Moleküle gespalten, wodurch als Endprodukt die gewünschte Essigsäure entsteht.
Union Carbide Corp. hat ein kontinuierliches Pfropfenströmungsverfahren entwickelt, das die teilweise Sammlung des Zwischenprodukts Butanon ermöglicht. Dieser Prozess beinhaltet eine nichtkatalysierte Flüssigphasenoxidation bei 180 °C und 5,3 MPa mit etwas Rückvermischung. Durch diesen Prozess werden sowohl MEK als auch Essigsäure gewonnen.
Unter kontinuierlichen Oxidationsbedingungen mit Pfropfenströmung bei 150 °C, 6,5 MPa und einer Verweilzeit von 2,7 Minuten werden Methylethylketon und Essigsäure in Massenverhältnissen von bis zu 3/1 gebildet.
Celanese Corp. verwendet Essigsäure als Lösungsmittel und verwendet ein homogen gelöstes Oxidationskatalysatorsystem bestehend aus Kobaltacetat und Natriumacetat. Dieser Batch-Prozess wird bei Temperaturen zwischen 160 und 165 °C und einem Druck von 5,7 MPa durchgeführt. Die resultierenden Produkte sind Butanon und Essigsäure mit einem Massenverhältnis von 0,4/1,0.
3.4. Oxidation von sec-Butylbenzol
Die SPAM-Technologie der Hock Phenol Synthesis Shell, die Phenol, Aceton und Butanon kombiniert, basiert auf der Oxidation einer Mischung aus sec-Butylbenzol und Cumol zu ihren jeweiligen Hydroperoxidverbindungen. Diese Hydroperoxide werden dann auf herkömmliche Weise mit einer anorganischen Säure, vorzugsweise Schwefelsäure, gespalten, was zu einer Mischung aus Phenol, MEK und Aceton als gewünschten Produkten führt.
Dabei wird der Rohketonstrom durch Destillation vom Phenol getrennt und anschließend gereinigt, um die gewünschten reinen Ketonkomponenten zu erhalten. Die katalytische Spaltung von sec-Butylbenzolhydroperoxid (sBHP) mit einer anorganischen Säure zur Herstellung von Phenol und Butanon ist ein seit vielen Jahren bekannter Prozess.
Trotz der industriellen Bedeutung von 2-Butanon im Vergleich zu Aceton wurde dieser alternative Weg jedoch aufgrund einer großen Herausforderung beim Oxidationsschritt nicht kommerzialisiert. Die Geschwindigkeit der autokatalytischen Oxidation von sec-Butylbenzol ist um ein Vielfaches langsamer als die von Cumol, was zu unerwünschten Nebenreaktionen führt, die sich negativ auf die Gesamtausbeute der gewünschten Produkte auswirken.
Den Untersuchungen von Shell zufolge wird die Abnahme der Reaktionsgeschwindigkeit bei der Oxidation von sec-Butylbenzol auf die Bildung von Spaltprodukten zurückgeführt, die als Radikalfänger in der Reaktionsmischung fungieren und in Konzentrationen von Teilen pro Million (ppm) vorliegen. Zu diesen Radikalsäuren gehören Ameisensäure, Essigsäure und Phenol.
Um die negativen Auswirkungen auf die Reaktionsgeschwindigkeit zu überwinden, wurden folgende Optionen vorgeschlagen:
- Verwendung einer Mischung aus sek.-Butylbenzol und Cumol zur Herstellung anfänglicher Mengen an Cumolhydroperoxid (CHP) im ersten Reaktionsschritt, das als Initiator fungiert.
- Reduzierung der Bildung von Methanol oder Ethanol als Spaltprodukte in Rückführungsströmen, wodurch die Produktion der oben genannten Radikalfängersäuren minimiert wird.
- Einleiten einer wässrigen Ammoniaklösung in einem bestimmten Ausmaß, damit die Säuren ihre Ammoniumsalze bilden können und gleichzeitig sichergestellt wird, dass eine Phasenspaltung vermieden wird.
3.5. Direkte Oxidation von n-Butenen (Hoechst-Wacker-Verfahren)
Beim Hoechst-Wacker-Verfahren handelt es sich um die direkte Oxidation von n-Butenen, wobei Sauerstoff mithilfe eines Redoxsalzpaars, PdCl2/2CuCl, in einer homogenen Phase übertragen wird. Anschließend wird das Salzpaar erneut oxidiert.
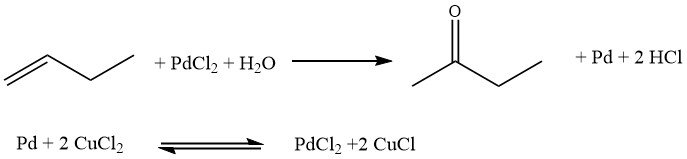
Dieses Verfahren hat jedoch gewisse Nachteile. Es kommt zur Bildung von chlorierten Butanonen und n-Butanal, die unerwünschte Nebenprodukte sind. Darüber hinaus kann es aufgrund der Anwesenheit freier Säuren zu Korrosionsproblemen kommen.
Bei diesem Verfahren wird Sauerstoff mithilfe einer wässrigen Lösung aus Palladiumsulfat und Eisensulfat übertragen. Ähnliche Sauerstoffübertragungsprinzipien wurden in anderen vom Consortium for Electrochemistry und Eastman Kodak entwickelten Verfahren eingesetzt.
4. Verwendung von Butanon
Butanon, auch Methylethylketon (MEK) genannt, ist ein wertvolles Lösungsmittel mit ähnlichen Eigenschaften wie Aceton. Im Vergleich zu anderen Lösungsmitteln mit ähnlichen Verdunstungsraten bietet es mehrere Vorteile:
- Hohe Auflösungskraft: Butanon weist eine starke Fähigkeit auf, verschiedene Substanzen aufzulösen.
- Hohes Verhältnis von gelöster Substanz zu Viskosität: Es kann eine große Menge an Material auflösen und gleichzeitig eine günstige Viskosität beibehalten.
- Mischbarkeit mit Kohlenwasserstoffen: Butanon kann sich mit zahlreichen Kohlenwasserstoffen mischen, ohne den Feststoffgehalt oder die Viskosität zu beeinflussen.
- Günstiges Volumen-zu-Masse-Verhältnis: Aufgrund seiner geringen Dichte sorgt es für ein vorteilhaftes Gleichgewicht zwischen Volumen und Masse.
2-Butanon hat die Fähigkeit, eine Vielzahl natürlicher Substanzen, Kunststoffe und Harze aufzulösen, darunter Kolophonium, Esterharze, Nitrocellulose, Cellulosederivate (wie Celluloseacetat und Celluloseacetobutyrat), Epoxidharze, Alkydharze, Phenolharze und Vinyl Acetatpolymere und viele andere.
Es kann jedoch Cellulosetriacetat, hochmolekulares Celluloseacetat, Poly(vinylchlorid), Poly(vinylbutyral), Polysulfidkautschuk und Schellack nicht nur teilweise auflösen.
Das Lösungsmittel findet Anwendung in verschiedenen Branchen wie der Farben-, Lack- und Lackherstellung sowie in Farbverdünnern, Klebstoffen, Zementen, Dichtstoffen, Magnetbändern, Kunstleder, Transparentpapier, Druckfarben, Reinigungsmitteln für elektronische Geräte, Kosmetika, Pharmazeutika, Entfettung von Metalloberflächen und Extraktionsverfahren.
Butanon wird auch als synthetischer Aromastoff in Lebensmitteln und Pharmazeutika, als Sterilisator für chirurgische Instrumente und zahnmedizinische Geräte sowie bei der Herstellung von rauchfreiem Pulver verwendet.
Obwohl Butanon hauptsächlich als Lösungsmittel verwendet wird, hat es als chemischer Rohstoff nur eine begrenzte Bedeutung. Es kann jedoch verschiedene Reaktionen eingehen, wie z. B. eine Kondensation mit Formaldehyd zur Herstellung von Methylisopropenylketon, eine Autokondensation zur Bildung von Ethylamylketon und eine Mischkondensation mit Aceton zur Herstellung von Methylamylketon.
MEK wird bei der Herstellung von Parfümen, Antioxidantien, Katalysatoren, Peroxiden und Diacetalen verwendet. Methylethylketoxim wird in geringem Umfang als Antihautmittel in Lacken eingesetzt.
Darüber hinaus dient Butanonperoxid als Polymerisationsinitiator für ungesättigte Polyester.
In der Parfümindustrie reagiert 2-Butanon mit Citral zu Duftkomponenten wie Methylpseudoionon. Darüber hinaus ist es seit 1962 in der Bundesrepublik Deutschland als Alkoholvergällungsmittel zugelassen (Beschluss der Bundesmonopolverwaltung in Offenbach).
Referenz
- 2-Butanone, Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a04_475.pub2
