Acylierung aromatischer Verbindungen
1. Friedel-Crafts Acylierung
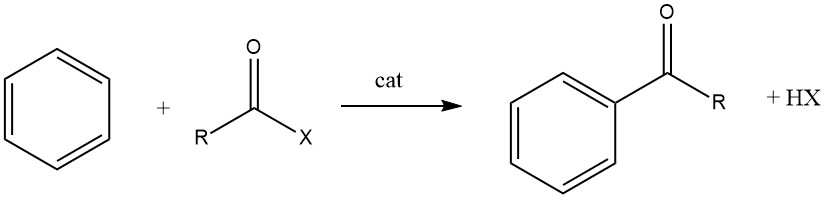
Bei der Friedel-Crafts-Acylierung handelt es sich um die Herstellung eines aromatischen Ketons durch die Reaktion zwischen einer aromatischen Verbindung und einem Acylierungsmittel, bei dem es sich um ein Acylhalogenid, ein Säureanhydrid, eine Säure oder einen Ester handeln kann. Diese Reaktion findet in Gegenwart eines sauren Katalysators statt.
Inhaltsverzeichnis
Die Acylierung aromatischer Substrate ist von großer industrieller Bedeutung, da sie zur Synthese aromatischer Zwischenprodukte genutzt wird, die häufig bei der Herstellung von Pharmazeutika, Insektiziden, Weichmachern, Farbstoffen, Parfümen und verschiedenen anderen kommerziellen Produkten eingesetzt werden. Diese Spezialverbindungen werden im Vergleich zu alkylierten Produkten typischerweise in kleinerem Maßstab hergestellt.
| Acylierungsmittel | Aromatische Verbindung | Produkt | Endverwendung |
|---|---|---|---|
| Essigsäureanhydrid | Benzol | Acetophenon | Parfüme, Pharmazeutika, Lösungsmittel, Weichmacher |
| Essigsäureanhydrid | Toluol | 4-Methylacetophenon | Parfums |
| Essigsäureanhydrid | Anisol | 4-Methoxyacetophenon | Parfums |
| Essigsäureanhydrid | Isobutylbenzol | 4-Isobutylactophenon | Arzneimittel |
| Dichloracetylchlorid | 1,2-Dichlorbenzol | α,α,2,4-Tetrachloracetophenon | Insektizide |
| Chlorbutyroylchlorid | Fluorbenzol | Chlorpropyl-4-fluorphenylketon | Arzneimittel |
| Tetrachlormethan | Benzol | Benzophenon | Arzneimittel, Insektizide, Parfüme |
| Benzoylchlorid | Benzol | Benzophenon | |
| Phosgen | N,N-Dimethylanilin | 4,4'-Bis-dimethylaminobenzophenon | Farbstoffe |
| Phthalsäureanhydrid | Benzol | 2-Benzoylbenzoesäure | Anthrachinon |
Die Acylierung zeigt eine bemerkenswerte Vielseitigkeit und führt zu vielfältigen Produkten, darunter aromatische Aldehyde, Alkylarylketone, symmetrische und unsymmetrische Diarylketone sowie Cyclisierungsprodukte.
Acylierungsmittel weisen im Allgemeinen eine höhere Reaktivität als Alkylierungsmittel auf, sodass Acylierungen unter relativ milden Bedingungen durchgeführt werden können. Aromatische Substrate mit elektronenschiebenden Substituenten wie Alkyl-, Hydroxyl- oder Alkoxygruppen weisen eine erhöhte Reaktivität auf.
Aromatische Verbindungen mit elektronenziehenden Substituenten wie Nitro-, Acyl-, Carboxyl- oder Nitrilgruppen sind deutlich schwieriger zu reagieren, selbst mit hochaktiven Acylierungsmitteln.
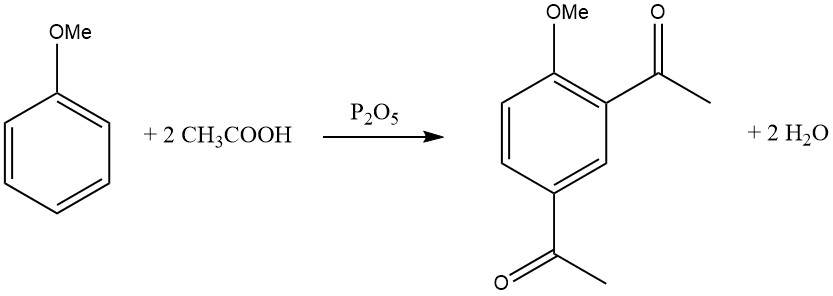
Die Einführung der ersten Acylgruppe hemmt den Eintritt einer zweiten Acylgruppe, wodurch eine Disubstitution im selben Ring selten wird. Es gibt jedoch einige Ausnahmen, wie zum Beispiel die Diacylierung von Mesitylen, Duren und Anisol mit einer Mischung aus Eisessig und Phosphorpentoxid.
Elektronenschiebende Substituenten erleichtern die Acylierung, und die Reaktivitätssteigerung aufgrund der Polysubstitution ist bemerkenswert.
Neben Benzol und seinen Derivaten können auch mehrkernige carbozyklische aromatische Verbindungen wie Naphthalin, Diphenyl, Anthracen, Phenanthren und Pyren als Substrate in Acylierungsreaktionen dienen.
Elektronenreiche Heterocyclen wie Pyrrol, Furan und Thiophen sowie ihre polycyclischen Derivate weisen eine hohe Reaktivität auf.
Im Gegensatz dazu reagieren Pyridin und Chinolin nicht, sofern sie nicht durch Substituenten aktiviert werden. Zu den nicht benzoloiden aromatischen Substraten, die bei der Acylierung aktiv sind, gehören Azulene, Ferrocene und Indolizine.
Trotz einiger Ähnlichkeiten mit der Friedel-Crafts-Alkylierung weist die Acylierung charakteristische Unterschiede auf.
Beispielsweise ist der Verbrauch des sauren Katalysators typischerweise mindestens stöchiometrisch, obwohl es in der Literatur Fälle gibt, in denen unterstöchiometrische Mengen an Lewis-Säuren verwendet werden. Die Reaktion verläuft im Vergleich zur Friedel-Crafts-Alkylierung mit höherer Regioselektivität und Einheitlichkeit, was zu weniger Isomerisierungen und Nebenreaktionen führt.
1.1. Acylierungskatalysatoren
Die bei der Friedel-Crafts-Alkylierung eingesetzten Katalysatoren können auch für Acylierungsreaktionen verwendet werden. Der Katalysator der Wahl ist in den meisten Fällen AlCl3. In AlCl3 vorhandene Verunreinigungen wie FeCl3 oder Spuren von Wasser erhöhen die Reaktionsausbeute und die Systemreaktivität, insbesondere in Fällen, in denen die Reaktionen ansonsten langsam sind.
In bestimmten Fällen kann die hohe Aktivität von AlCl3 jedoch zu unerwünschten Nebenreaktionen führen, wie z. B. der Zersetzung reaktiver Heterozyklen wie Benzofuran, der Etherzersetzung oder der Umlagerung von Alkylgruppen.
Um in solchen Fällen die Aktivität von AlCl3 zu mildern, können komplexierende Lösungsmittel wie Nitrobenzol zur Bildung von 1:1-Addukten verwendet werden. Darüber hinaus sind BF3 und SnCl4 geeignete Acylierungskatalysatoren für empfindliche Heterozyklen.
Beim Einsatz von Acylierungsmitteln wie Anhydriden, Estern oder Carbonsäuren können auch starke Protonensäuren wie Schwefelsäure, Perchlorsäure, Orthophosphorsäure und Polyphosphorsäure eingesetzt werden.
Polyphosphorsäure, die ursprünglich hauptsächlich für intramolekulare Cyclisierungsreaktionen verwendet wurde, wird heute zunehmend für intermolekulare Acylierungen eingesetzt.
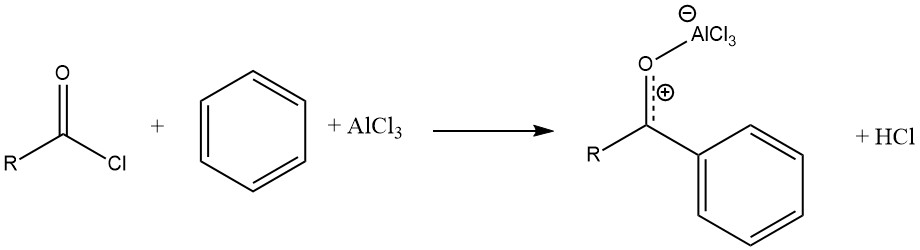
Die durch AlCl3 katalysierte Reaktion eines Acylhalogenids mit einem aromatischen Substrat führt zur Bildung eines stabilen Komplexes der Lewis-Säure mit dem aromatischen Keton. Das Produkt wird dann durch Hydrolyse freigesetzt.
Im Gegensatz zu Friedel-Crafts-Alkylierungen muss der Katalysator typischerweise in mindestens stöchiometrischen Mengen im Verhältnis zum Acylhalogenid eingesetzt werden. Es gibt jedoch einige Ausnahmen, bei denen „wirklich katalytische“ (unterstöchiometrische) Mengen an Lewis-Säuren verwendet werden, wie etwa Eisenchlorid, Zink- oder Eisenoxide, Kobaltchlorid und Seltenerdmetalltriflate.
Für Acylierungsmittel wie Carbonsäuren oder Ester ist mindestens die doppelte Menge an Katalysator erforderlich, bei Anhydriden sogar die dreifache Menge (jedoch 1,5 Mol pro Mol Produkt).
Fluorwasserstoff, manchmal in Kombination mit Borfluorid, ist ein industriell wichtiger Katalysator. Es bietet den Vorteil der Katalysatorrückgewinnung durch Destillation und reduziert so die Abfallbildung.
Diese Technologie wird kommerziell für die Acylierung von Isobutylbenzol zu 4-Isobutyacetophenon eingesetzt, einem Zwischenprodukt bei der Herstellung von Ibuprofen, einem weit verbreiteten entzündungshemmenden Medikament.
1.1.1. Heterogene Katalysatoren
Während die klassische Friedel-Crafts-Synthese mit homogenen Katalysatoren nach wie vor die primäre Methode zur Herstellung aromatischer Ketone ist, weist sie mehrere Nachteile auf:
1. Aufgrund der Bildung stabiler Komplexe mit den Produkten sind häufig stöchiometrische oder sogar überschüssige Mengen an „Katalysator“ erforderlich. Diese Katalysatoren, wie AlCl3, wirken eher wie Reagenzien als wie echte Katalysatoren und tragen erheblich zu den Produktionskosten bei. Sie müssen aus dem Produkt abgetrennt und ausgewaschen werden und können nicht einfach recycelt werden.
2. Das Reaktionssystem ist stark korrosiv und erfordert teure Reaktoren und Geräte zur Abgasreinigung, die nicht nur HCl, sondern auch chlorierte Kohlenwasserstoffe enthalten.
3. Der Katalysator muss neutralisiert und zusammen mit einer großen Menge Abwasser entsorgt werden, was die Umweltbelastung erhöht.
In den letzten Jahren gab es Bestrebungen, homogene Katalysatoren durch heterogene Katalysatoren zu ersetzen. Heterogene Katalysatoren bieten Vorteile wie die Notwendigkeit, keine stöchiometrischen Mengen zu benötigen, keine Korrosion zu verursachen, eine einfache Trennung ohne Neutralisierung und die Möglichkeit des Recyclings oder der Verwendung in kontinuierlichen Festbettprozessen.
Heterogene Acylierungskatalysatoren müssen starke Lewis- oder Brønsted-Säuren sein. Einige wichtige Klassen fester Säuren, die diese Reaktion katalysieren können, sind:
1. Zeolithe: Mikroporöse, kristalline Alumosilikate mit starken Brønsted- oder Lewis-Zentren. Mittelporige Systeme wie H-ZSM-5 oder großporige Systeme wie HY-Zeolith, Beta-Zeolith oder Mordenit wurden erfolgreich für Acylierungsreaktionen mit elektronenreichen aromatischen Verbindungen eingesetzt.
2. Modifizierte Tone: Modifizierte Tonmineralien können die Anzahl saurer Stellen erhöhen. Mit Säure behandelte Tone (Brønsted-Säurekatalysatoren) und ionenausgetauschte Tone (Lewis-Säurekatalysatoren) werden kommerziell für verschiedene säurekatalysierte Reaktionen verwendet.
3. Feste Supersäuren: Starke Säuren, die stärker als 100 % Schwefelsäure sind, einschließlich sulfatierter Oxide wie ZrO2, TiO2, HfO2, Fe2O3 und SnO2, wurden als feste Supersäuren für Acylierungsreaktionen untersucht.
4. Sonstiges: Andere Katalysatoren wie Heteropolysäuren, oberflächenmontierte Säuren (Protonen- oder Lewis-Säuren auf einem Träger) und Nafion wurden ebenfalls für Acylierungsreaktionen untersucht, werden jedoch noch nicht kommerziell genutzt.
Durch den Einsatz heterogener Katalysatoren wollen Forscher die Einschränkungen homogener Katalysatoren überwinden und nachhaltigere und effizientere Prozesse für die Synthese aromatischer Ketone entwickeln.
1.2. Lösungsmittel bei der Acylierungsreaktion
Bei Acylierungsreaktionen unter Verwendung eines Acylhalogenid-Lewis-Säure-Katalysatorsystems spielt die Wahl des Lösungsmittels eine entscheidende Rolle. Als aromatisches Substrat können sowohl unpolare Lösungsmittel wie CCl4 oder CS2 als auch Lösungsmittel mittlerer Polarität wie Dichlormethan oder 1,2-Dichlorethan verwendet werden.
Mit AlCl3 als Katalysator entstehen in diesen Lösungsmitteln heterogene Systeme. Allerdings führt die Verwendung von Lösungsmitteln wie Nitromethan oder Nitrobenzol zu homogenen Lösungen und einer verringerten Reaktivität aufgrund der Komplexbildung. Auch die Wahl des Lösungsmittels kann die Regioselektivität der Acylierungsreaktion beeinflussen.
Eine zu berücksichtigende Gefahr besteht darin, dass sich Addukte aus AlCl3 und Nitrobenzol bei erhöhten Temperaturen explosionsartig zersetzen können.
Es gibt drei gängige Verfahren zur Durchführung der Acylierung unter Verwendung eines Acylhalogenid-Lewis-Säure-Katalysatorsystems:
- Das Acylierungsmittel wird zu einer gekühlten Lösung oder Suspension des Katalysators in einem Lösungsmittel gegeben, gefolgt von der Zugabe des aromatischen Substrats zum vorgebildeten Acylierungskomplex (Perrier-Methode).
- Alle Reaktanten werden gemischt und abgekühlt, und der Katalysator wird langsam zugegeben (Elbs-Methode).
- Das aromatische Substrat dient als Lösungsmittel für den Katalysator, anschließend wird das Acylierungsmittel langsam zugegeben (Bouveault-Methode).
Die Perrier-Methode wird oft bevorzugt, da sie während der gesamten Reaktion ein konstantes Verhältnis von Katalysator zu Acylierungsmittel aufrechterhält.
Wenn Schwefelsäure als Katalysator verwendet wird, ist ein großer Überschuss der Säure erforderlich und die Reaktanten werden zugegeben. Um Ringsulfonierungs- oder Aldolisierungsreaktionen zu vermeiden, sollte die Temperatur unter 100 °C gehalten werden.
1.3. Acylierungsmittel
Die Friedel-Crafts-Acylierung weist aufgrund der systematischen Variation, die sowohl im Acylierungsmittel als auch im aromatischen Substrat eingeführt werden kann, eine bemerkenswerte Vielseitigkeit auf. Die Reaktivität von Acylierungsmitteln folgt einem Trend wie folgt:
[RCO]+[BF4]− > [RCO]+[ClO4]− > RCOO-SO3H > RCOX (RCO)2 O > RCO2R‘ > RCONR’2
Ionische Acylperchlorate und Tetrafluorborate sind wirksame Wirkstoffe, wohingegen Säureester und -amide ohne Katalysatoren nahezu inaktiv sind. Die Reaktivität von Acylhalogeniden nimmt in der Reihenfolge ab: RCOI > RCOBr > RCOCl > RCOF.
Die Reaktivität von Acylhalogeniden wird auch durch den Substituenten R beeinflusst, der Alkyl oder Aryl sein kann und Halogen-, Alkyl-, Alkoxy- oder Nitrogruppen enthalten kann. Die Reaktivität wird außerdem durch die Art des aromatischen Substrats und den verwendeten Katalysator beeinflusst.
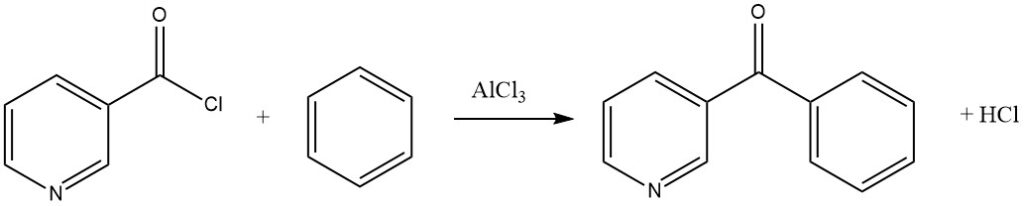
Aromatische Acylhalogenide können Nitrosubstituenten enthalten oder vom Pyridintyp sein, wie bei der Synthese von 3-Benzoylpyridin aus Benzol und Nicotinylchlorid gezeigt wurde.
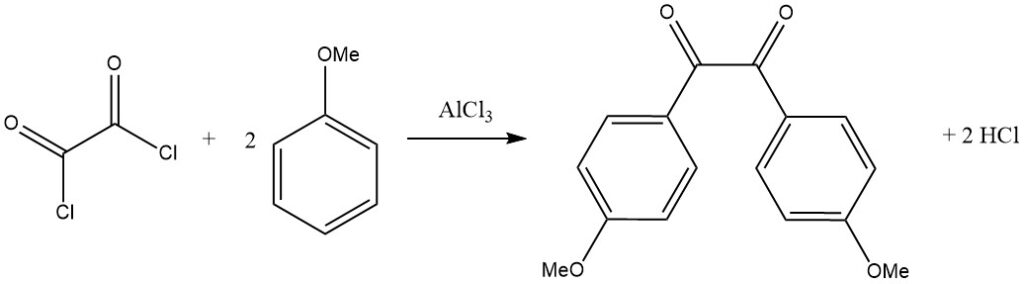
Bifunktionelle Acylhalogenide können auch als Acylierungsmittel wirken, wie bei der Reaktion von Oxalylchlorid mit einem aktivierten aromatischen Substrat wie Anisol zu sehen ist, die zum entsprechenden Benzilderivat führt.
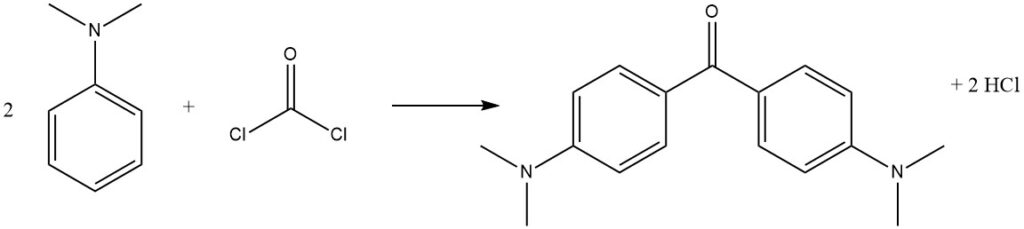
Phosgen, ein kommerziell wichtiges Reagens, kann mit N,N-Dimethylanilin reagieren, um 4,4′-Bis(dimethylamino)benzophenon (Michlers Keton) zu erzeugen, das bei der Farbstoffherstellung verwendet wird.
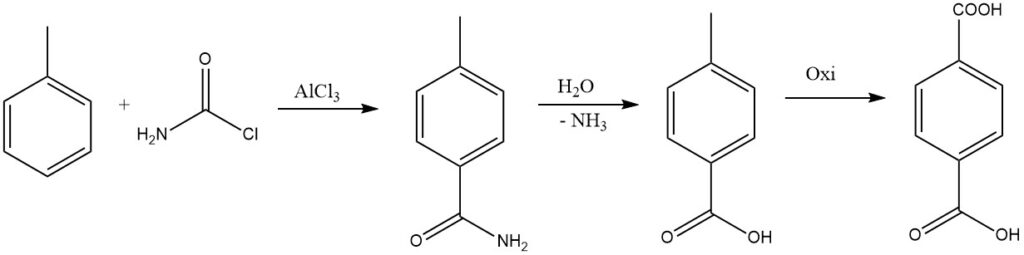
Durch Ersetzen eines Halogens des Phosgens durch eine Amidgruppe kann das resultierende Amid hydrolysiert werden, um die Säure zu bilden, die für die industrielle Synthese von Terephthalsäure in Betracht gezogen wird.
Isocyanate, Isothiocyanate und CO2 können in Gegenwart von AlCl3 auch als Acylierungsmittel dienen, um aromatische Carbonsäuren oder ihre Derivate zu ergeben.
Unsymmetrische bifunktionelle Acylierungsmittel wie Säurechloride, die eine Estergruppe enthalten, reagieren selektiv mit der aktiveren Acylgruppe.
In ähnlicher Weise können Säureanhydride wie Bernstein-, Glutar- oder Maleinsäureanhydrid in Gegenwart von 2 Mol AlCl3 pro Mol Anhydrid 4-Aryl-4-oxobutansäuren erzeugen, die Zwischenprodukte bei der Haworth-Synthese mehrkerniger Aromaten sind.
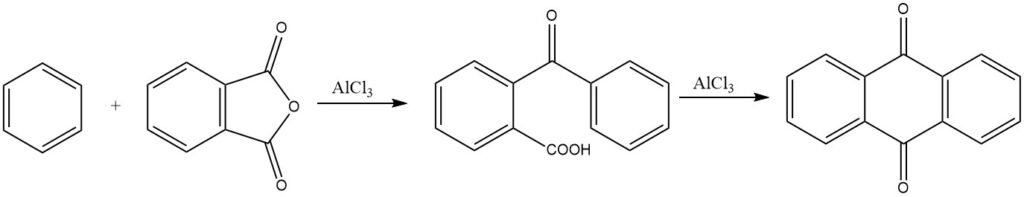
Die Synthese von Anthrachinon aus Phthalsäureanhydrid und Benzol ist von kommerzieller Bedeutung. Unter stark sauren Bedingungen kann sich auch 3,3-Diphenylphthalid bilden.
Mit Zeolith-Katalysatoren können nicht aktivierte Carbonsäuren in der flüssigen Phase mit Toluol reagieren, wodurch p-Acyltoluole in hohen Ausbeuten erhalten werden. Dieses Verfahren hat sich mit Ausbeuten von bis zu 96 % als vielversprechend erwiesen.
2. Acylierung von Benzol und Benzolderivaten
2.1. Acylierung von Benzol
Die industrielle Acylierung von Benzol mit Essigsäureanhydrid unter Verwendung von AlCl3 als Katalysator und Aufrechterhaltung einer Temperatur von 30 °C durch Kühlung führt zu Acetophenon mit einer Ausbeute von 85 %. Allerdings wird Acetophenon heute überwiegend industriell durch Oxidation von Ethylbenzol oder Cumol hergestellt.
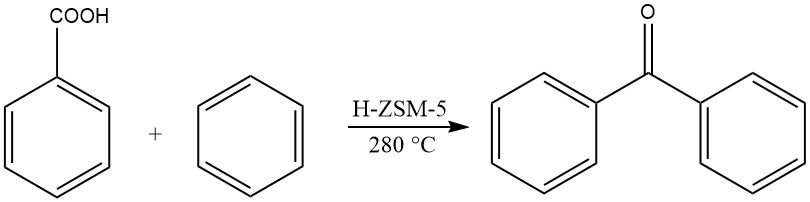
Eine andere Methode beinhaltet die Gasphasen-Acylierung von Benzol mit Benzoesäure bei erhöhten Temperaturen, wodurch Benzophenon entsteht.
2.2. Acylierung von Toluol
Die Acylierung von Toluol unter Verwendung von Acetylchlorid und Aluminiumchlorid als Katalysator führt zur Bildung von 4-Methylacetophenon mit einer beeindruckenden Selektivität von 97,6 %. Diese Verbindung findet Anwendung bei der Herstellung von Parfüms.
2.3. Acylierung deaktivierter Substrate
Benzoloidaromatische Verbindungen mit Nitro-, Carboxyl-, Nitril- und Acylsubstituenten zeigen eine Behinderung der elektrophilen Substitution. Die Acylierung dieser Verbindungen ist jedoch nur in Gegenwart eines aktivierenden zweiten Substituenten möglich, beispielsweise einer Hydroxy- oder Alkoxygruppe.
Andererseits können desaktivierte Substrate wie Chlorbenzol einer Acylierung unterworfen werden, um p-Chlorbenzophenone zu bilden, wobei kommerzielle heterogene Katalysatoren wie Zeolithe oder sulfatiertes Zirkonoxid verwendet werden, die für ihre Eigenschaften als feste Supersäuren bekannt sind.
2.4. Acylierung aktivierter Substrate
Die Acylierung aktivierter Substrate wie Phenol kann mit verschiedenen Katalysatoren durchgeführt werden, darunter Carbonsäure – ZnCl2, Carbonsäure – BF3 oder Carbonsäure – Polyphosphorsäure. Die Acylierung von Phenolen zeigt eine Selektivität von bis zu 25 % für die ortho-Substitution, wobei das Verhältnis von ortho zu para stark von der Wahl der Katalysatoren und Lösungsmittel abhängt.
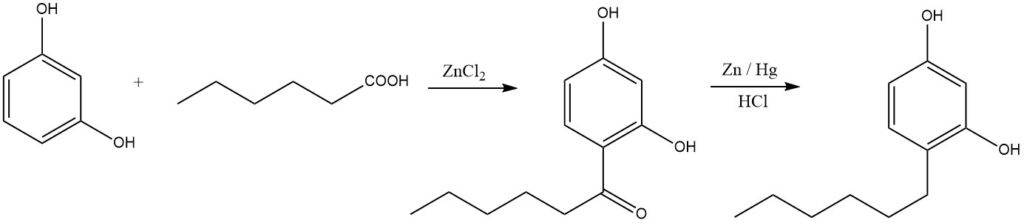
Lineare Alkylphenole können durch Acylierung und anschließende Reduktion synthetisiert werden. Ein anschauliches Beispiel ist die Herstellung von Hexylresorcin, das häufig als Desinfektionsmittel verwendet wird:
Sowohl Phenole als auch Phenylether sind hochreaktive Substrate und zeigen unter relativ milden Bedingungen Reaktivität. Beispielsweise kann Anisol bequem bei 40 – 50 °C in Gegenwart von Polyphosphorsäure acyliert werden. Phenylether hingegen werden überwiegend in der 4-Position acyliert.
Eine umweltfreundliche Alternative zu herkömmlichen Friedel-Craft-Acylierungssystemen vermeidet die Bildung von Abfallsalzen und Nebenprodukten. Bei diesem Ansatz kommen gemischte Anhydride der Trifluoressigsäure zum Einsatz, die in situ durch Reaktion mit Carbonsäuren erzeugt werden. Als Katalysator dienen geringe Konzentrationen an H3PO4, und Trifluoressigsäure kann nach der Dehydratisierung recycelt werden.
2.5. Acylierung aromatischer Amine
Nach der N-Acylierung zeigen aromatische Amine bei Acylierungsreaktionen ein ähnliches Reaktivitätsmuster wie alkylaromatische Verbindungen. Tertiäre aromatische Amine wie N,N-Dimethylanilin können an der 4-Position acyliert werden, wobei P2O5 als Katalysator eingesetzt wird. Dies ist bei der Synthese von Michlers Keton bekannt.
2.6. Cyclisierungsreaktionen
6-Methoxy-1-tetralon wird durch die Reaktion von 4-(3-Methoxyphenyl)buttersäure in einer beeindruckenden Ausbeute von 96 % erhalten.
Intermolekulare Cyclisierungen werden vor allem bei Reaktionen von Phthalsäureanhydrid mit Benzol und seinen Derivaten nachgewiesen, die jeweils zu Anthrachinonen und substituierten Anthrachinonen führen.
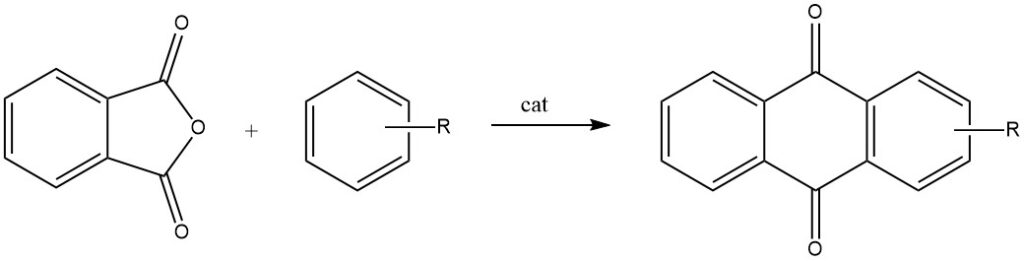
Wenn Phthalsäureanhydrid mit Toluol oder Chlorbenzol reagiert, durchläuft es einen zweistufigen Prozess, der zur Bildung von 2-substituierten Anthrachinonen führt.
Umgekehrt ergibt die Reaktion mit 4-Chlorphenol direkt 1,4-Dihydroxyanthrachinon (Chinizarin). Durch anschließende Oxidation, Nitrierung, Chlorierung oder Aminierung dieser Produkte entstehen wichtige Zwischenprodukte für Feinchemikalien.
Darüber hinaus erzeugt die Friedel-Crafts-Acylierung von Ethylbenzol mit Phthalsäureanhydrid in einem zweistufigen Verfahren 2-Ethylanthrachinon, eine wichtige Komponente, die bei der Synthese von H2O2 verwendet wird.
3. Acylierung mehrkerniger aromatischer Verbindungen
3.1. Acylierung von Naphthalin
Bei der Acylierung von Naphthalin entstehen typischerweise Gemische aus 1- und 2-Acylderivaten, und die relativen Anteile dieser Derivate werden hauptsächlich durch die Wahl des Lösungsmittels beeinflusst. Wenn unpolare Lösungsmittel wie CS2 oder CCl4 verwendet werden, erfolgt die Acylierung hauptsächlich in der 1-Position. Umgekehrt wird in polaren Lösungsmitteln wie CH3NO2 oder C6H5NO2 die Bildung von 2-Acetylnaphthalinen begünstigt.
3.2. Acylierung substituierter Naphthaline
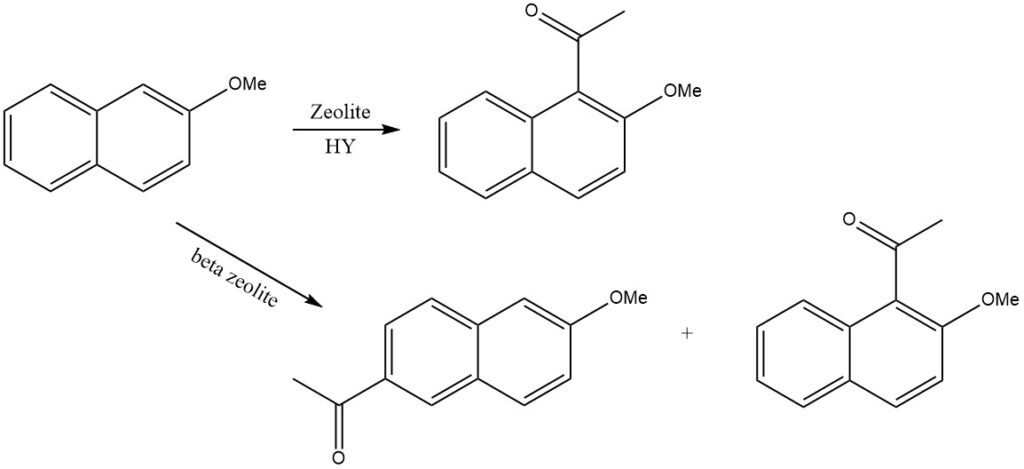
Die Acylierung substituierter Naphthaline führt häufig zu komplexen Produktmischungen. Typischerweise ist der stärker aktivierte Ring anfälliger für Acylierung. Allerdings kann die Regioselektivität durch die Formselektivität der Zeolithe gesteuert werden.
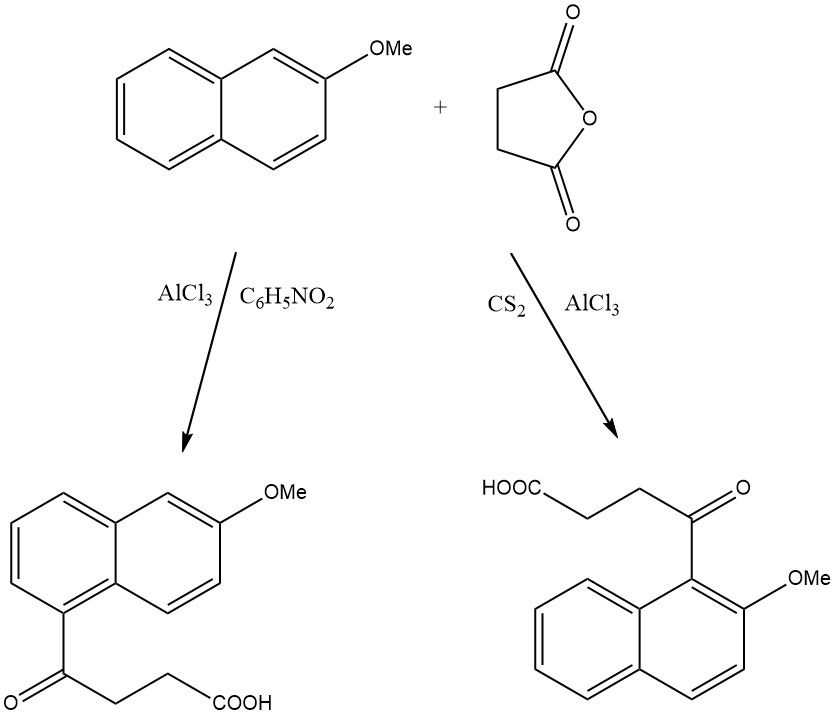
Wenn beispielsweise 2-Methoxynaphthalin auf Zeolith HY acyliert wird, entsteht nur 1-Acetyl-2-methoxynaphthalin, während auf Beta-Zeolith 2-Acetyl-6-methoxynaphthalin entsteht.
Die 1,5-Diacylierung erfordert strengere Bedingungen, wie dies bei der Synthese von 1,5-Dibenzoylnaphthalin der Fall ist. Diese Verbindung kann in Natriumaluminiumchlorid weiter fusioniert werden, um Dibenzopyrenchinon zu ergeben, einen Farbstoff, der als Indanthren Goldgelb GK im Handel erhältlich ist.
Wenn Naphthalin mit Diacylverbindungen reagiert, entstehen häufig die 1,8-diacylierten Produkte.
3.3. Acylierung von Biphenylen
Wenn ein Ring eines Biphenylmoleküls durch einen elektronenziehenden Substituenten deaktiviert wird, wird der andere Ring reaktiver und kann an der 4-Position eine Acylierung eingehen. Die Deaktivierung eines Rings erhöht die Reaktivität des anderen Rings und macht ihn anfälliger für elektrophile Substitutionen. Daher erfolgt die Acylierung bevorzugt an der 4-Position.
3.4. Acylierung von Anthracen
In Gegenwart von AlCl3 und unter milden Bedingungen in unpolaren Lösungsmitteln (0 °C, Benzol) wird Anthracen an der reaktivsten 9-Position acyliert. Die Isomerisierung des Keton-AlCl3-Komplexes wird durch Ausfällung verhindert.
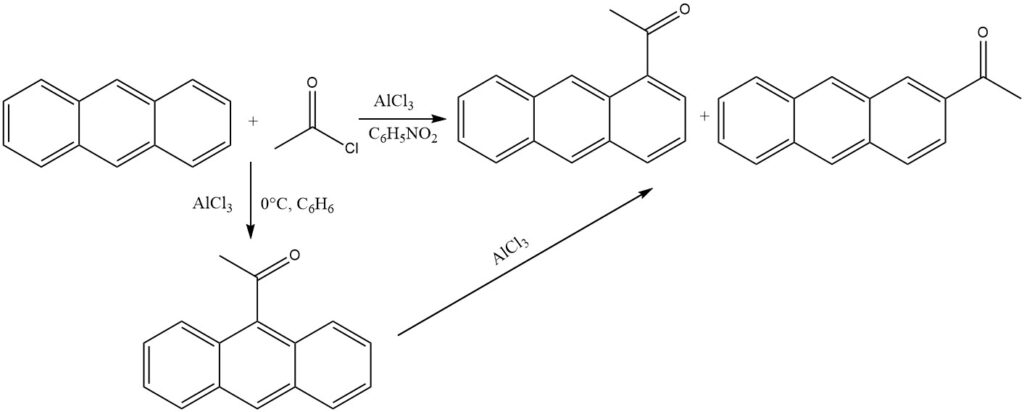
Wenn jedoch polare Lösungsmittel wie Nitrobenzol verwendet werden, entsteht ein Gemisch, das hauptsächlich aus 1-Acylanthracen und etwas 2-Acylanthracen besteht. Auch in diesem Szenario dürfte 9-Acylanthracen das Ausgangsprodukt sein, das anschließend einer Isomerisierung unterliegt.
3.5. Acylierung von Phenanthren
Auch wenn Phenanthren in Nitrobenzol acyliert wird, erhält man als Hauptprodukte die 2- und 3-Acyl-Isomere. Andererseits führt die Verwendung des weniger polaren Lösungsmittels Dichlorethan überwiegend zur Bildung des 9-Acyl-Isomers als Primärprodukt. Die Wahl des Lösungsmittels spielt eine entscheidende Rolle bei der Bestimmung der Regioselektivität der Acylierungsreaktion für Phenanthren.
4. Acylierung heteroaromatischer Verbindungen
Furan, Thiophen und Pyrrol besitzen eine hohe Elektronendichte, was sie in elektrophilen Substitutionsreaktionen hochaktiviert und ihre Acylierung unter milden Reaktionsbedingungen ermöglicht.
4.1. Acylierung von Furan
Die Acylierung von Furan führt zu erheblichen Ausbeuten des 2-Acylderivats, insbesondere wenn Anhydride als Acylierungsmittel dienen. Die ausgezeichnete Reaktivität von Furan ermöglicht die Verwendung von Benzol als Lösungsmittel. Geeignete Katalysatoren für diese Reaktion sind unter anderem Zinkchlorid, Bortrifluorid und Phosphorsäure. Darüber hinaus kann auch an der 5-Position eine Acylierung stattfinden.
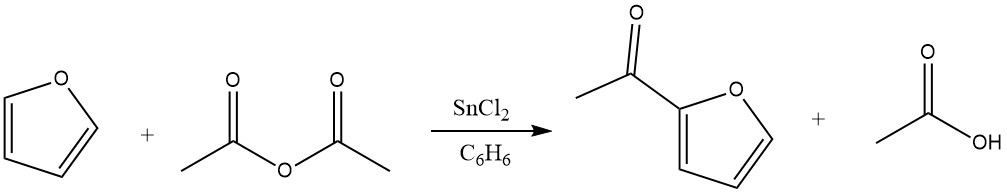
4.2. Acylierung von Thiophen
Die Reaktivität von Thiophen kann mit der von Anisol verglichen werden. Thiophen kann effizient acyliert werden und liefert hohe Ausbeuten an den gewünschten Produkten, wenn Acylhalogenide in Gegenwart von SnCl4 oder Anhydride mit Phosphorsäure oder ZnCl2 als Acylierungsmittel verwendet werden.
4.3. Acylierung von Pyrrol
Die Acylierung von Pyrrol kann auch ohne Katalysatoren erfolgen, obwohl ZnCl2, BF3 und AlCl3 üblicherweise in Verbindung mit Anhydriden als Acylierungsmittel verwendet werden. Im Allgemeinen erfolgt die Acylierung an der 2-Position des Pyrrolrings, aber auch eine 2,5-Diacylierung ist möglich. Eine 3-Acylierung wird jedoch nur beobachtet, wenn sowohl die 2- als auch die 5-Position am Pyrrolring blockiert sind.
4.4. Acylierung von Imidazolen
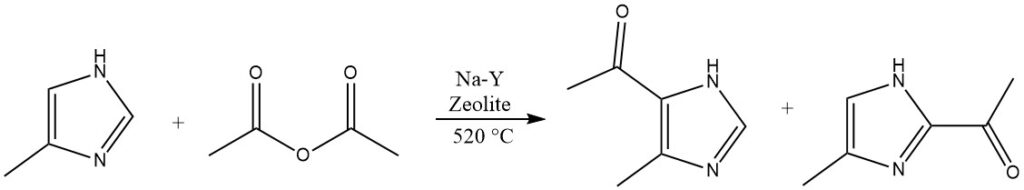
Heterocyclen, die stark desaktiviert sind und in homogenen flüssigen Phasen nicht acyliert werden können, wie Imidazol oder Pyrazole, können bei erhöhten Temperaturen über 500 °C auf Na-Y-Zeolithen reagieren.
4.5. Acylierung von Benzofuranen
Hochreaktive Heterozyklen können mit Zeolithen in einem kontinuierlichen Flüssigphasenprozess acyliert werden. Ein repräsentatives Beispiel ist beispielsweise die Acylierung von 2-Methylbenzofuran mit Essigsäureanhydrid:
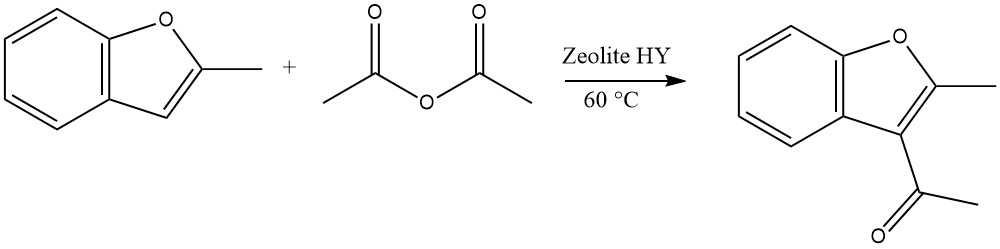
Im Fall von Dibenzofuran und Dibenzothiophen kann eine Acylierung oder Diacylierung an der 2- oder 8-Position auftreten. Bei Carbazol erfolgt die Acylierung oder Diacylierung typischerweise an der 3- oder 6-Position.
4.6. Verschiedenes
Substituierte 4H-Pyrone haben in Acylierungsreaktionen hervorragende Ausbeuten gezeigt, wenn Trifluoressigsäure als Katalysator verwendet wird. Bemerkenswert ist, dass sogar Diacylierungsreaktionen möglich sind.
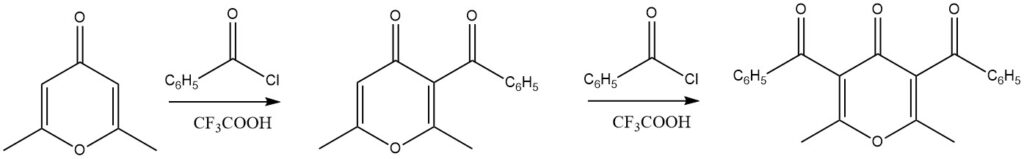
Eine Vielzahl anderer heteroaromatischer Verbindungen, darunter Chroman, Xanthene, 1,3-Benzodioxol und Dibenzodioxine, wurden ebenfalls erfolgreich Acylierungsreaktionen unterzogen.
5. Acylierung nichtbenzolischer aromatischer Verbindungen
Ferrocen geht in Gegenwart von Aluminiumchlorid leicht eine Acylierung mit Acylhalogeniden ein und zeigt eine vergleichbare Reaktivität wie Phenole. Anhydride können auch als Acylierungsmittel dienen. Mit BF3 als Katalysator kann eine Monoacylierung von Ferrocen erreicht werden.
Wenn ein Überschuss sowohl an Acylierungsmittel als auch an AlCl3 verwendet wird, wird die heteroannulare Diacetylierung zur vorherrschenden Reaktion.

Verschiedene Cyclopentadienylderivate können acyliert werden. Die Reaktivität einiger aromatischer Substrate folgt dieser Reihenfolge: C6H5OH·(C5H5)2Fe > C6H5OCH3 > CH3C5H4Mn(CO)3 > C5H5Mn(CO)3 > C6H6.
Azulen reagiert reibungslos mit Essigsäureanhydrid in Gegenwart von SnCl4 als Katalysator, was zur Acylierung des Cyclopentadienylteils führt und 1-Acetylazulen ergibt. Unter strengeren Bedingungen und in Gegenwart von AlCl3 oder SnCl4 wird 1,3-Diacetylazulen gebildet, indem Acetylchlorid oder Essigsäureanhydrid als Acylierungsmittel verwendet werden.
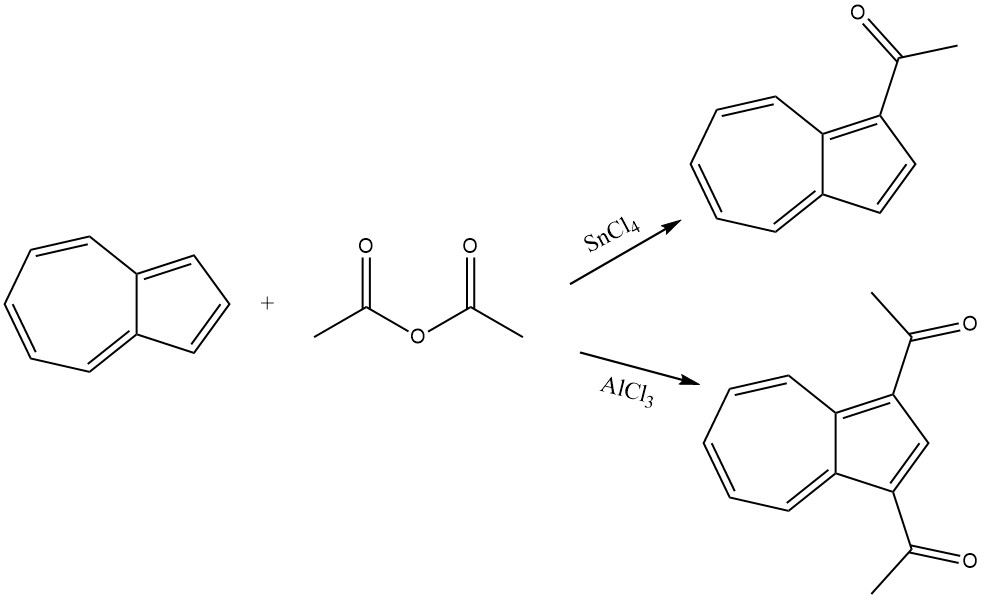
6. Verschiedene Acylierungsreaktionen
Unter den zahlreichen Reaktionen, die zu aromatischen C-Acylierungsprodukten führen, sind die Formylierungsreaktionen, die Houben-Hoesch-Synthese und die Fries-Umlagerung von besonderer Bedeutung.
6.1. Formylierung
Die Formylierung aromatischer Verbindungen ist eine spezielle Art der Acylierungsreaktion, die auftritt, wenn ein Formylhalogenid oder Ameisensäureanhydrid mit einer aromatischen Verbindung in Gegenwart eines Friedel-Crafts-Katalysators wie AlCl3 reagiert. Allerdings ist die Anwendung dieser Reaktion aufgrund der Instabilität der meisten Formylierungsmittel begrenzt.
Bei der Gattermann-Koch-Synthese wird eine Mischung aus Chlorwasserstoff und Kohlenmonoxid mit AlCl3 und Kupfer(I)-chlorid als Formylierungsmittel für aromatische Verbindungen verwendet. Benzol sowie substituierte Benzole oder polyzyklische Aromaten werden einer Formylierung unterzogen, um aromatische Aldehyde zu ergeben, wobei die para-Isomere bevorzugt werden.
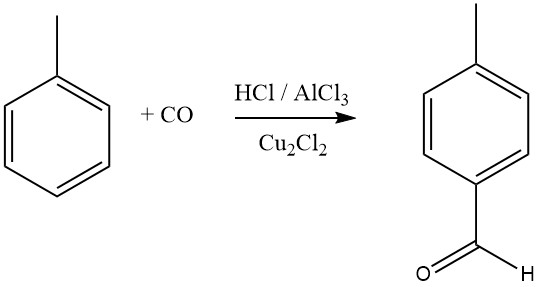
Aromatische Verbindungen mit meta-dirigierenden Substituenten reagieren bei diesem Formylierungsprozess nicht. Mitsubishi Gas Chemical erforscht eine modifizierte Gattermann-Koch-Synthese für die industrielle Synthese von Terephthalsäure.
Bei diesem Verfahren reagiert Toluol mit CO und HF-BF3 zu p-Tolualdehyd in hoher Ausbeute, das dann zu Terephthalsäure oxidiert wird. Aktuelle Studien legen nahe, dass das eigentliche Acylierungsmittel in diesen Reaktionen [CHO]+ ist, das durch Protonierung von CO oder seinen Komplexen entsteht.
Für die Vilsmeier-Aldehydsynthese werden aromatische und heterozyklische Substrate durch Reaktion mit Dialkyl- oder Arylalkylformamiden in Gegenwart von POCl3 formyliert. Diese Reaktion ermöglicht die Formylierung einer Vielzahl von Verbindungen, einschließlich reaktiver mehrkerniger aromatischer Verbindungen, Phenolether, Dialkylamine und N-Heterozyklen wie Pyrrol und Indol.
Die Regioselektivität der Formylierung folgt den Prinzipien von Friedel-Crafts-Reaktionen und führt typischerweise zur Bildung von 4-substituierten aromatischen Verbindungen. Darüber hinaus können aromatische Substrate mit Dichlormethylmethylether oder Trialkylorthoformiat in Gegenwart von TiCl4 bzw. AlCl3 formyliert werden.
6.2. Houben-Hoesch-Synthese
Die Houben-Hoesch-Synthese, die eng mit der Gattermann-Reaktion verwandt ist, beinhaltet die Acylierung reaktiver aromatischer Substrate wie Phenole, Phenylether, Pyrrole, Thiophene und Indole unter Verwendung von Nitrilen. Diese Reaktionen finden in Gegenwart von Chlorwasserstoff (HCl) und Zinkchlorid (ZnCl2) statt.
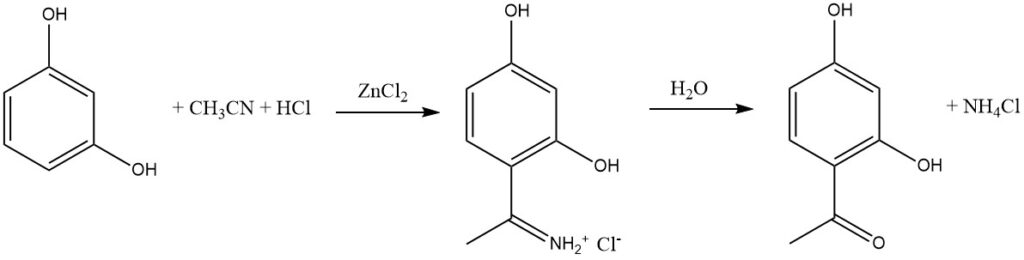
In dieser Synthese ist das aktive Elektrophil das Imminiumion, das durch Zugabe von HCl zum Nitril gebildet und dann von der Lewis-Säure (ZnCl2) komplexiert wird. Dieses sperrige Zwischenprodukt führt vorwiegend zur Acylierung an der 4-Position des aromatischen Substrats und nicht an der 2-Position.
Im Vergleich zur Friedel-Crafts-Acylierung mit Acylhalogeniden oder -anhydriden ist die Houben-Hoesch-Synthese häufig eine einfachere Methode zur Acylierung aktivierter Phenole.
6.3. Fries-Umlagerung
Die Fries-Umlagerung von Arylestern, die durch Acylierung von Phenolen hergestellt werden können, ist eine wertvolle Methode zur Synthese phenolischer Ketone, die bei der Herstellung von Feinchemikalien verwendet werden. Diese Reaktion wird in der pharmazeutischen Industrie häufig zur Synthese von Arzneimitteln wie Adrenalon, Synephrin, Buphenin und Acebutolol eingesetzt.
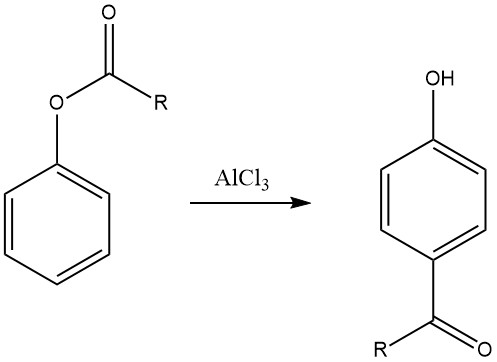
Die Regioselektivität der Fries-Umlagerung kann durch Anpassung der Reaktionsbedingungen gesteuert werden. Im Allgemeinen ist die para-Substitution bei niedrigen Temperaturen bevorzugt, während die ortho-Substitution bei hohen Temperaturen bevorzugt ist. Aber auch die Wahl des Lösungsmittels sowie die Art und Menge der Katalysatoren beeinflussen die Regioselektivität.
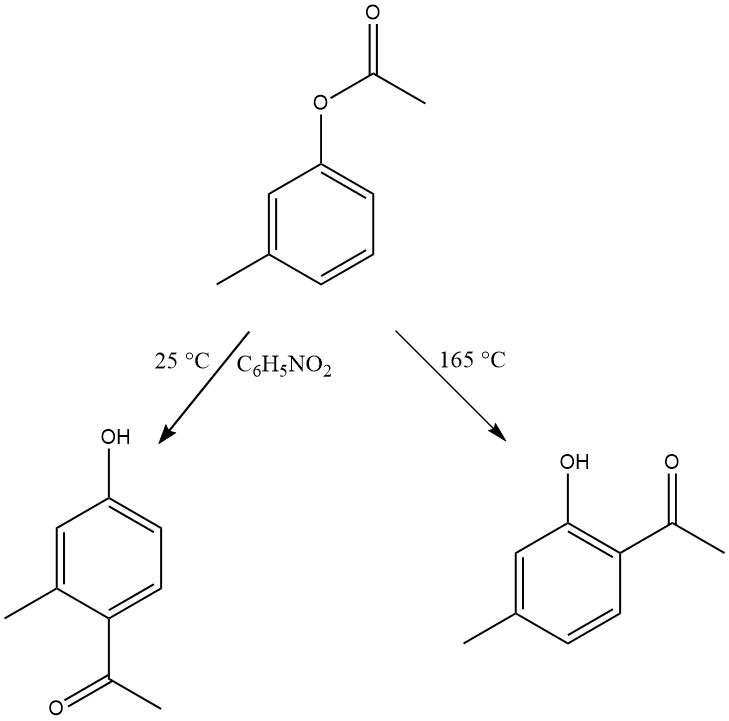
Eine breite Palette von Substraten mit verschiedenen Substitutionen sowohl in der Phenol- als auch in der Säureeinheit kann dieser Umlagerung unterliegen. Auch Phenolderivate mit elektronenziehenden Gruppen, wie der Nitrogruppe, sowie Naphthol und Hydroxy- oder Dihydroxyphenylester sind bei dieser Umwandlung reaktiv.
N-Acylaniline können bei erhöhten Temperaturen auch zu 4-Acylanilinen umgelagert werden. Der Säureanteil der Ester kann variiert werden, was die Verwendung verschiedener Alkyl- oder Arylsäuren ermöglicht, darunter Diaryldicarboxylester und Sulfonsäureester, die zur Bildung von 4-Hydroxyphenylsulfonen führen.
AlCl3 ist der am häufigsten verwendete Katalysator, obwohl auch SnCl4, TiCl4, FeCl3 und ZnCl2 wirksam und manchmal praktischer sind. Die Umlagerung erfolgt typischerweise durch Erhitzen einer Mischung aus Phenolestern und dem Katalysator auf Temperaturen im Bereich von 80 bis 180 °C.
Abhängig von der Reaktivität des Substrats kann die Reaktion innerhalb weniger Minuten bis einigen Stunden abgeschlossen sein. Es ist möglich, die Reaktion bei niedrigeren Temperaturen in Lösungsmitteln wie C6H6NO2, (CH2Cl)2, CS2, C6H5Cl oder Petrolether durchzuführen, dies erfordert jedoch längere Reaktionszeiten.
Alternativ kann die Umlagerung in CS2 eingeleitet, anschließend zur Entfernung des Lösungsmittels destilliert und dann bei höheren Temperaturen abgeschlossen werden.
Um das Ortho-Isomer aus den Produktgemischen zu isolieren, wird häufig Wasserdampfdestillation eingesetzt. Andererseits können flüchtige Produkte durch fraktionierte Destillation abgetrennt werden und das Para-Isomer kann aus nichtflüchtigen Produktgemischen durch Kristallisation gewonnen werden.
Referenz
- Acylation and Alkylation; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a01_185
FAQ zur Acylierung
Die Friedel-Crafts-Acylierung ist eine Art organische chemische Reaktion, bei der eine Acylgruppe (R-CO-) in einen aromatischen Ring eingeführt wird. Sie ist nach den Chemikern Charles Friedel und James Crafts benannt, die die Reaktion im 19. Jahrhundert entwickelten.
Vor der Acylierung ist häufig eine Ansäuerung des Reaktionsgemisches erforderlich, um ein geeignetes Elektrophil zu erzeugen, das mit dem aromatischen Substrat reagieren kann. Dieser Schritt hilft bei der Aktivierung des Acylierungsmittels (z. B. Acylhalogenid oder -anhydrid) und bereitet es auf die elektrophile aromatische Substitution vor, einen Schlüsselschritt bei der Friedel-Crafts-Acylierung. Der Ansäuerungsprozess beinhaltet die Zugabe eines Lewis-Säure-Katalysators wie AlCl3 oder FeCl3, um das reaktive Acyliumion (RCO+) zu erzeugen, das die Acylierungsreaktion erleichtert.
Bei der Friedel-Crafts-Acylierung handelt es sich um die elektrophile Substitution einer Acylgruppe an einem aromatischen Ring. Die Reaktion findet statt, indem zunächst aus dem Acylierungsmittel in Gegenwart eines Lewis-Säure-Katalysators ein starkes Elektrophil (Acyliumion) erzeugt wird. Dieses Elektrophil greift dann den elektronenreichen aromatischen Ring an, was zur Bildung eines intermediären Carbokations führt. Die Reaktion wird durch die Deprotonierung dieses Carbokations abgeschlossen, was zur Einführung der Acylgruppe am aromatischen Ring führt und das acylierte Produkt erzeugt.
Abhängig von den spezifischen Reaktionsbedingungen und der Reaktivität der beteiligten Substrate und Reagenzien können Acylierungsreaktionen in einer Vielzahl von Lösungsmitteln durchgeführt werden. Für Friedel-Crafts-Acylierungsreaktionen werden üblicherweise unpolare Lösungsmittel wie CCl4, CS2, Benzol und Toluol verwendet. Darüber hinaus können für bestimmte Reaktionen polare Lösungsmittel wie Dichlormethan und Nitrobenzol eingesetzt werden. Die Wahl des Lösungsmittels kann die Reaktivität, Regioselektivität und Ausbeute der Acylierungsreaktion beeinflussen.
Die starke desaktivierende Wirkung der Acylgruppe führt überwiegend zur Bildung von Monosubstitutionsprodukten und die sperrige Natur der Acylierungsgruppe schränkt auch die weitere Substitution ein, was zur Monosubstitution als Hauptprodukt führt.
Acylierungsreaktionen finden breite Anwendung in der organischen Synthese und der Herstellung verschiedener chemischer Verbindungen. Einige häufige Anwendungen der Acylierung sind:
- Synthese aromatischer Ketone, wesentliche Zwischenprodukte in Pharmazeutika und Agrochemikalien.
- Herstellung von Feinchemikalien, Farbstoffen und Parfümen.
- Bildung reaktiver Zwischenprodukte zur weiteren Funktionalisierung organischer Moleküle.
- Produktion von Industriechemikalien wie Terephthalsäure und Anthrachinonen.
- Synthese biologisch aktiver Verbindungen wie Arzneimittel und Naturstoffe.
Obwohl die Friedel-Crafts-Acylierung eine wertvolle Synthesemethode ist, weist sie einige Einschränkungen auf. Eine wesentliche Einschränkung besteht in der Möglichkeit von Nebenreaktionen wie Polyacylierung, die zu unerwünschten Produkten führen und die Gesamtausbeute verringern können. Darüber hinaus kann es sein, dass einige Substrate aufgrund sterischer Hinderung oder Desaktivierung durch bestimmte Substituenten nicht effizient acyliert werden. Darüber hinaus kann die Verwendung starker Lewis-Säure-Katalysatoren zu unerwünschten Nebenreaktionen oder einer Katalysatorvergiftung führen.
Ja, die Friedel-Crafts-Acylierung wird in großem Umfang bei der Synthese verschiedener Naturstoffe und biologisch aktiver Verbindungen eingesetzt. Es ermöglicht die Einführung spezifischer funktioneller Gruppen in aromatische Ringe und erleichtert so die Schaffung vielfältiger chemischer Strukturen, die in Naturprodukten vorkommen. Die Regioselektivität und die milden Reaktionsbedingungen machen es zu einem wertvollen Werkzeug für die effiziente Synthese komplexer Moleküle mit aromatischen Einheiten.
Bei Friedel-Crafts-Acylierungsreaktionen werden häufig starke Lewis-Säuren und Acylierungsmittel eingesetzt, die gefährlich und reaktiv sein können. Es sollten angemessene Sicherheitsvorkehrungen befolgt werden, einschließlich der Verwendung geeigneter Schutzausrüstung wie Handschuhe, Laborkittel und Schutzbrillen. Die Reaktionen sollten in einem gut belüfteten Abzug durchgeführt werden, um das Einatmen von Säuredämpfen zu vermeiden.
