Anhydride phtalique : propriétés, réactions, production et utilisations
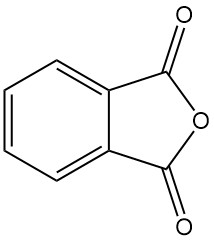
Qu’est-ce que l’anhydride phtalique ?
L’anhydride phtalique [85-44-9], également connu sous le nom d’isobenzofuran-1,3-dione, est un composé organique de formule C6H4(CO)2O. Il s’agit d’un solide incolore à blanc, sous forme d’aiguilles, avec une odeur douce et distinctive formée par la déshydratation de l’acide phtalique.
L’anhydride phtalique a été le premier anhydride d’un acide dicarboxylique à être utilisé commercialement. Il s’agit d’un produit chimique industriel important utilisé pour la production à grande échelle de plastifiants pour plastiques.
A. Laurent a découvert l’anhydride phtalique pour la première fois en 1836 et depuis 1872, il est produit par BASF en utilisant le procédé d’oxydation du naphtalène.
Table des matières
1. Propriétés physiques de l’anhydride phtalique
L’anhydride phtalique existe sous forme d’aiguilles ou de plaquettes incolores avec des formes cristallines monocliniques ou rhombiques. Les propriétés physiques de l’anhydride phtalique sont répertoriées dans le tableau 1.
| Propriété | Valeur |
|---|---|
| Numéro CAS | [85-44-9] |
| Formule chimique | C8H4O3 |
| Poids moléculaire | 148,12 g/mol |
| Densité (solide à 4 °C) | 1,527 g/cm3 |
| Densité de vapeur spécifique (1 013 mbar) | 6,61 kg/m3 |
| Point de fusion | 131,6 °C |
| Point d'ébullition (1 013 mbar) | 295,1 °C |
| Chaleur de fusion | 159,1 J/g |
| Chaleur de combustion | 22 160,7 J/g |
| Chaleur de formation (naphtalène) | 12 058 J/g |
| Chaleur de formation (o-xylène) | 8 625 J/g |
| Chaleur de sublimation | 601 J/g |
| Chaleur d'évaporation | 441,7 J/g |
| Point éclair | 152 °C |
| Température d'inflammation | 580 °C |
| Limites d'inflammabilité (1 013 mbar) | Supérieur : 10,5 % en volume Inférieur : 1,7 % en volume |
| Limite inférieure d'explosion de poussière | 25 g/m3 |
La densité de l’anhydride phtalique liquide entre 140 et 240 °C peut être déterminée à l’aide de l’équation suivante :
ρ/kg.m-3 = 1321.55-0.6697 (t/°C)-0.000905 (t/°C) 2
Les données de solubilité de l’anhydride phtalique dans divers solvants sont présentées dans le tableau 2.
Les données rapportées sur les risques d’explosion de l’anhydride phtalique dans l’air montrent des variations significatives. Des explosions peuvent se produire à des concentrations inférieures à 100 g/m³, influencées par les impuretés présentes dans l’échantillon. Des incidents industriels récents suggèrent que le dépassement de 35 g/m³ d’anhydride phtalique dans le gaz produit de réaction peut conduire à une inflammation au contact du sel caloporteur en raison de tubes de réacteur brisés.
| Solvant | Température (°C) | Solubilité (g/100 g) |
|---|---|---|
| Eau | 20 | 1.64 |
| Eau | 50 | 1,74 |
| Eau | 100 | 19.0 |
| Disulfure de carbone | 20 | 0,7 |
| Acide formique | 20 | 4.7 |
| Pyridine | 20 | 80 |
| Benzène | - | soluble |
| Éthanol | 20 | soluble |
| Éther diéthylique | 20 | légèrement soluble |
2. Réactions de l’anhydride phtalique
L’anhydride phtalique montre la réactivité de l’anhydride cyclique et des composés aromatiques.
La réaction de l’anhydride phtalique avec des alcools ou des diols donne des esters ou des polyesters. Par exemple, l’anhydride phtalique réagit avec l’éthylène glycol pour former du polyester, un polymère avec des unités ester répétitives.
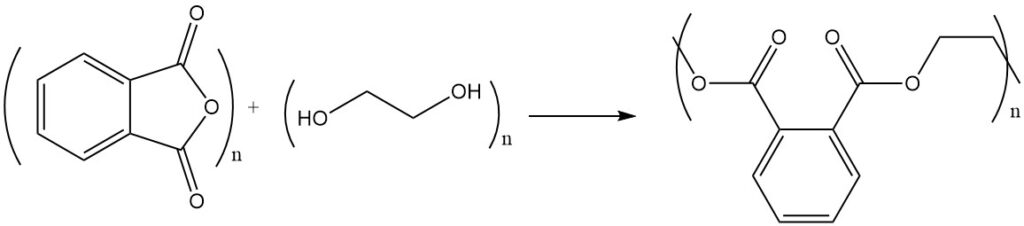
Les résines polyester insaturées sont formées par polycondensation avec de l’anhydride maléique ou de l’acide fumarique.
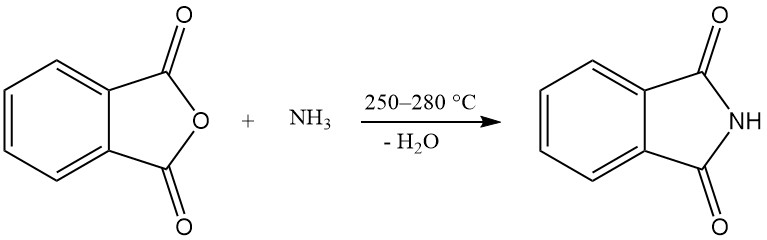
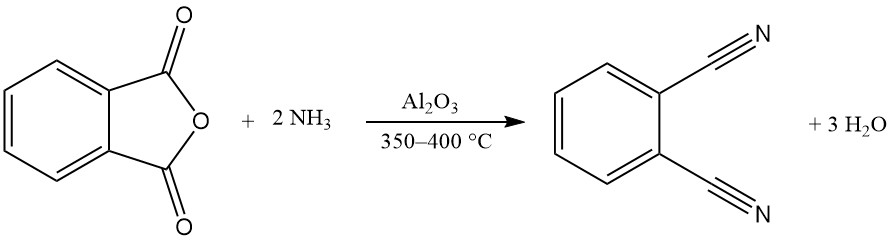
Un ou les deux groupes carboxy de l’anhydride phtalique peuvent réagir avec l’ammoniac pour produire du phtalimide ou du phtalonitrile.
Les colorants phtaléine et rhodamine, dont certains ont plus d’un siècle d’histoire de production, sont obtenus par la réaction de l’anhydride phtalique avec des phénols, des aminophénols ou des dérivés de quinaldine. La fluorescéine est synthétisée à partir d’anhydride phtalique et de résorcinol à l’aide de catalyseurs acides.
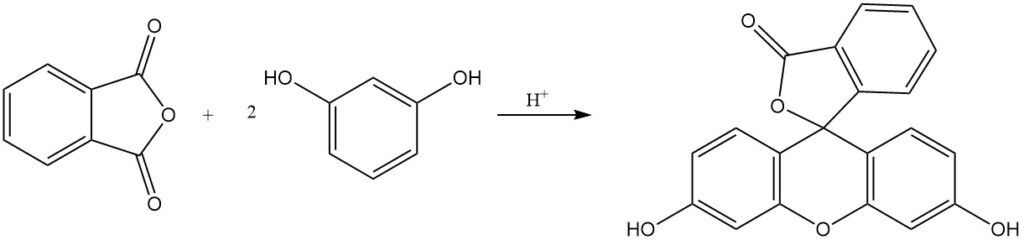
La réaction de l’anhydride phtalique avec le phénol produit de la phénolphtaléine en présence d’un catalyseur acide.
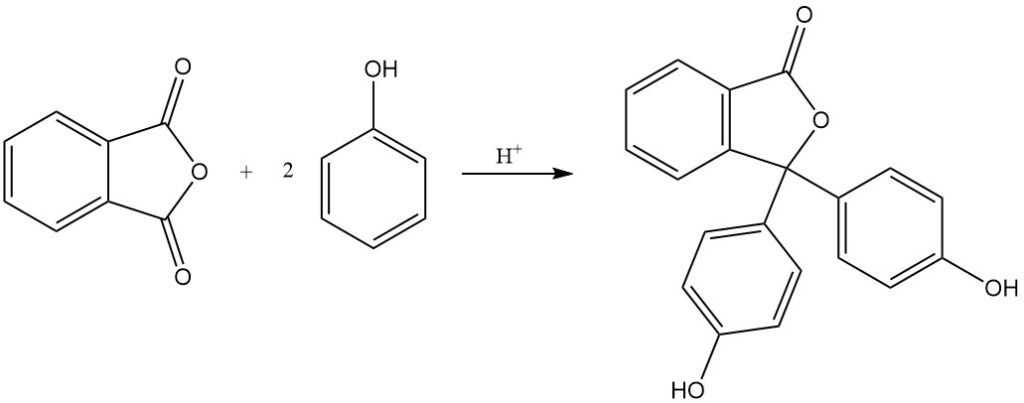
Lorsque l’anhydride phtalique réagit avec le 4-aminophénol, il donne du N-(4-hydroxyphényl)phtalimide.
La réaction de Friedel-Crafts de l’anhydride phtalique avec des dérivés benzéniques, suivie d’une fermeture de cycle, forme des dérivés d’anthraquinone, qui sont utilisés pour fabriquer des colorants anthraquinoniques.
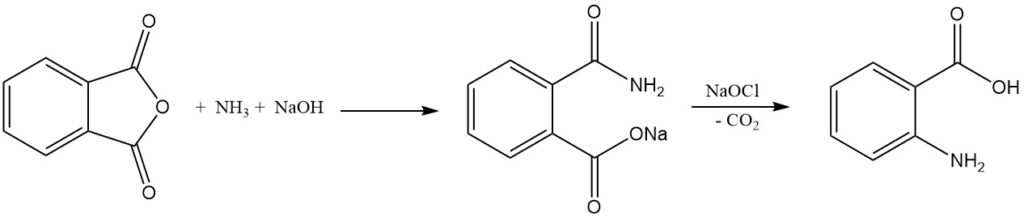
La synthèse industrielle de l’acide anthranilique à partir de l’anhydride phtalique comporte deux étapes. Tout d’abord, l’anhydride phtalique réagit avec l’ammoniac en présence d’hydroxyde de sodium pour former un sel d’acide phtalimique, puis le sel de sodium de l’acide phtalamique subit un réarrangement de Hofmann et une décarboxylation lorsqu’il est traité avec de l’hypochlorite pour donner de l’acide anthranilique.
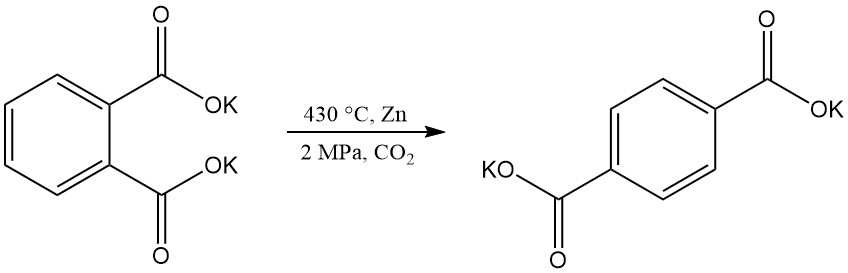
L’acide téréphtalique peut être produit par réarrangement du phtalate dipotassique, mais des défis techniques ont rendu ce processus obsolète.
L’hydrogénation électrochimique de l’anhydride phtalique produit de l’acide 3,5-dihydrophtalique, tandis que l’hydrogénation avec un catalyseur au nickel produit du phtalide.
3. Production d’anhydride phtalique
L’anhydride phtalique est principalement produit à l’échelle industrielle par l’oxydation en phase gazeuse de l’o-xylène ou du naphtalène. Il peut également être préparé par oxydation en lit fluidisé du naphtalène ou par oxydation en phase liquide de l’o-xylène.
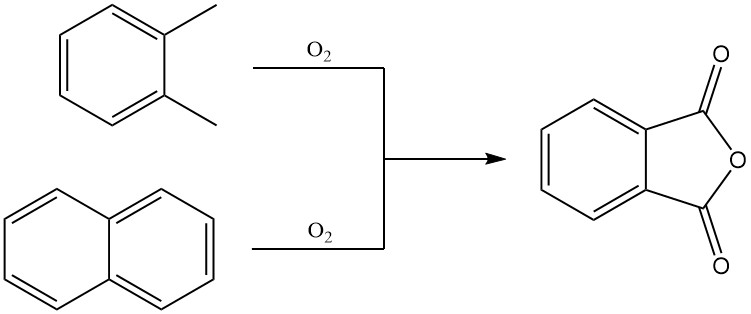
3.1. Production d’anhydride phtalique par oxydation en phase gazeuse de o-xylène ou de naphtalène
L’o-xylène préchauffé est mélangé à de l’air chaud et introduit dans un réacteur tubulaire contenant un catalyseur hautement sélectif. La réaction d’oxydation est exothermique et la chaleur générée est utilisée pour produire de la vapeur, l’excès de vapeur étant disponible pour un usage externe.
Les gaz effluents du réacteur sont prérefroidis. À des concentrations élevées d’anhydride phtalique, une partie de l’anhydride phtalique liquide peut être directement collectée dans un condenseur, et le flux gazeux de produit restant entre dans un système de condenseur à commutation.
Les tubes à ailettes à l’intérieur des condenseurs de commutation sont refroidis par de l’huile caloporteuse selon un processus cyclique. Pendant le cycle de refroidissement, l’anhydride phtalique se condense sous forme solide sur les tubes, et un cycle de chauffage ultérieur fait fondre l’anhydride phtalique déposé, qui est ensuite collecté dans un réservoir de stockage.
Après la séparation de l’anhydride phtalique, les gaz d’échappement contenant des sous-produits doivent être nettoyés par lavage à l’eau, incinération catalytique ou incinération thermique.
Le lavage à l’eau permet de concentrer l’acide maléique (un sous-produit) de la solution de lavage, qui peut être ensuite traité pour produire de l’acide fumarique ou de l’anhydride maléique.
La combinaison de l’épuration et de la production d’anhydride maléique élimine le rejet d’eaux usées polluées.
L’anhydride phtalique brut est transféré vers un système de traitement thermique/chimique continu qui reconvertit tout sous-produit d’acide phtalique en anhydride phtalique. Enfin, l’anhydride phtalique brut traité est purifié par un système de distillation continue en deux étapes.
3.1.1. Processus commerciaux
Le procédé BASF fonctionne avec une large gamme de charges d’o-xylène (jusqu’à 105 g/m³) et utilise un réacteur de finition pour réduction des sous-produits et amélioration de la qualité.
Ce processus offre un fonctionnement flexible pour un rendement optimisé, une réduction des déchets et une durée de vie prolongée du catalyseur et ne nécessite pas d’activation du SO2 ni de pré-condenseur pour la collecte de l’anhydride phtalique brut.
L’anhydride phtalique brut produit contient une faible quantité de sous-produits, ce qui le rend optimisé pour une faible consommation d’énergie et une exportation nette d’énergie élevée.
Le procédé Wacker accepte l’o-xylène, le naphtalène ou leurs mélanges. Il utilise des charges d’o-xylène de 90 à 100 g/m³ (STP) et se concentre sur les modifications des processus pour réaliser des économies d’énergie.
Le procédé Nippon Shokubai VGR se distingue par le recyclage des gaz de ventilation, réduisant la concentration d’oxygène à <10 % en volume pour un fonctionnement sûr avec une o élevée -Chargement en xylène (jusqu’à 85 g/m³ STP). Ce processus permet d’obtenir des rendements élevés attribués à un système catalytique spécialisé et peut également utiliser du naphtalène comme matière première.
Le procédé Alusuisse-Ftalital LAR propose des charges d’o-xylène dans l’air jusqu’à 134 g/m³ (STP) pour l’énergie potentielle et réduction de la taille des équipements. Il utilise commercialement des charges allant jusqu’à 80 g/m³ (STP) et emploie des catalyseurs en forme d’anneau ou de demi-anneau capables de traiter à la fois l’o-xylène et le naphtalène ou leurs mélanges.
Le procédé Rhône-Poulenc utilise l’o-xylène comme matière première et soumet le produit brut à un post-traitement chimique avant le traitement en deux étapes. distillation. Il traite les gaz résiduaires par incinération.
Le procédé ELF Atochem/Nippon Shokubai exploite le catalyseur Nippon Shokubai pour traiter l’o-xylène ou le naphtalène et utilise des charges d’alimentation industrielles allant jusqu’à 75 g/m³ (STP) pour l’o-xylène.
3.1.2. Catalyseur et mécanisme de réaction
Les usines modernes utilisent principalement des catalyseurs en forme d’anneau dans des réacteurs tubulaires refroidis par du sel fondu pour plus d’efficacité énergétique. Des supports demi-coques sont également disponibles.
Les catalyseurs typiques sont constitués d’un support céramique inerte (silicate, carbure de silicium, etc.) recouvert d’une fine couche d’oxydes de vanadium et de titane. De l’antimoine, du rubidium, du césium, du niobium et du phosphore peuvent être ajoutés pour améliorer la sélectivité envers l’anhydride phtalique.
Les catalyseurs à deux zones combinant des zones d’activité faible et élevée sont courants, certains procédés utilisant trois zones pour des charges élevées en o-xylène, et certains catalyseurs nécessitent une activation du SO2 pour une durée de vie prolongée.
La voie réactionnelle exacte pour la formation d’anhydride phtalique n’est pas entièrement comprise et dépend des méthodes de mesure et des configurations expérimentales.
Un mécanisme redox impliquant des atomes d’oxygène dans le réseau catalytique est généralement accepté. Bien que l’alcool intermédiaire n’ait pas été définitivement observé, sa présence est probable dans la conversion de l’o-xylène en anhydride phtalique.
La conversion industrielle de l’o-xylène atteint des rendements supérieurs à 80 % du maximum théorique (environ 110 à 112 kg de PA pour 100 kg d’o-xylène). Cependant, les rendements de conversion du naphtalène sont généralement inférieurs (environ 85 % du maximum théorique, soit 98 kg de PA pour 100 kg de naphtalène), en raison de sous-produits supplémentaires comme la naphtoquinone.
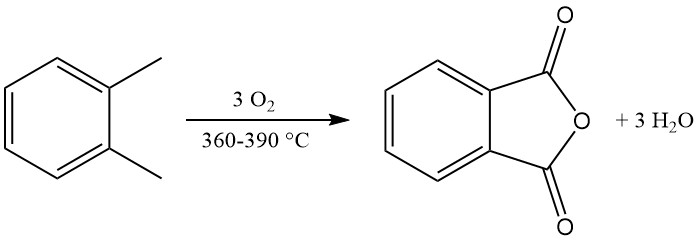
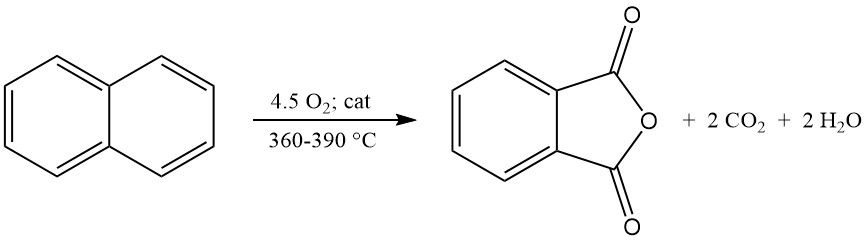
La réaction d’oxydation exothermique génère une chaleur importante : 1 300 à 1 800 kJ/mol pour l’o-xylène et 2 100 à 2 500 kJ/mol pour le naphtalène. Cette chaleur est souvent exploitée pour la production de vapeur.
Les principaux sous-produits de l’oxydation de l’o-xylène comprennent l’acide maléique et le phtalide, et l’oxydation du naphtalène produit en outre de la naphtoquinone, qui nécessite une purification plus poussée.
3.1.3. Purification de l’anhydride phtalique
Pour obtenir de l’anhydride phtalique de haute pureté après l’étape de réaction initiale, le produit brut subit souvent un traitement thermique avant distillation pour éliminer les impuretés.
Un traitement thermique simple (100 à 400 °C) convient aux produits à faible teneur en impuretés à base d’o-xylène. Le traitement vise à éliminer l’eau, les contaminants à bas point d’ébullition (anhydride maléique, o-tolualdéhyde) et les phtalides.
L’anhydride phtalique produit par l’oxydation du naphtalène nécessite un traitement chimique supplémentaire en raison de la présence de naphtoquinone comme sous-produit.
Divers produits chimiques peuvent être utilisés pour l’élimination de la naphtoquinone, notamment l’acide sulfurique, l’hydroxyde de sodium, le mélange acide borique/acide sulfurique, le disulfure de potassium, le carbonate de sodium, le maléate de potassium et les polydiènes aliphatiques.
La distillation est utilisée comme étape finale de purification de l’anhydride phtalique brut.
Le processus de distillation (Figure 1) implique généralement un système continu avec plusieurs colonnes.
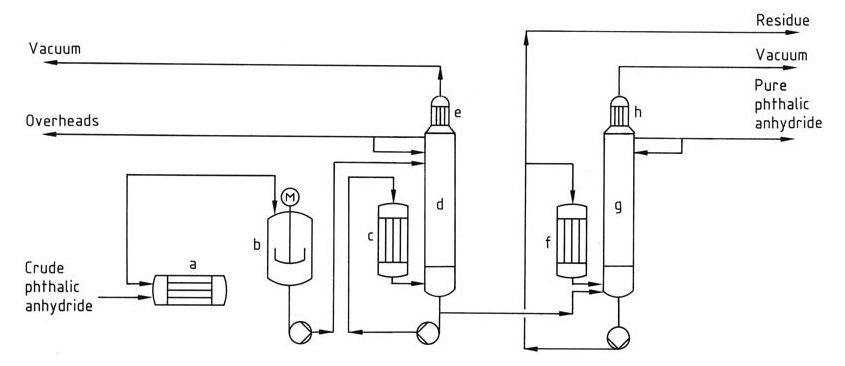
a) Réchauffeur d'anhydride phtalique brut ; b) Prédécomposeur ; c) Rebouilleur ; d) Colonne de décapage ; e) Condenseur ; f) Rebouilleur ; g) Colonne de distillation ; h) Condenseur
Tout d’abord, le prédécomposeur convertit l’acide phtalique résiduel dans le produit brut en anhydride phtalique, puis la première colonne concentre et élimine les impuretés à bas point d’ébullition comme l’anhydride maléique et l’acide benzoïque de la tête. Enfin, la deuxième colonne purifie l’anhydride phtalique en le distillant tout en laissant derrière elle le résidu à haut point d’ébullition.
3.2. Production d’anhydride phtalique par oxydation en lit fluidisé du naphtalène
L’anhydride phtalique peut être produit par oxydation en lit fluidisé du naphtalène. Un exemple est le procédé Badger, qui est toujours utilisé, et les usines employant ce procédé peuvent augmenter leur capacité de production en injectant à la fois de l’oxygène et de l’air, permettant ainsi une concentration de naphtalène plus élevée.
Le naphtalène liquide est directement injecté et vaporisé au fond du lit pour assurer une répartition uniforme dans tout le catalyseur et l’oxygène atmosphérique est introduit à travers un plateau distributeur pour faciliter la réaction.
Un mélange vigoureux au sein du lit fluidisé maintient une température uniforme (345 à 385 °C) et la chaleur générée par la réaction est utilisée pour la production de vapeur à haute pression via des tubes de refroidissement.
Des cyclones et des filtres en céramique sont utilisés pour séparer et recycler le catalyseur, qui peut être régénéré à l’aide de SO2.
Jusqu’à 60 % de l’anhydride phtalique est récupéré sous forme de condensat liquide, le reste étant obtenu par désublimation dans des condenseurs à interrupteur et finalement distillé sous vide pour produire un produit pur.
3.3. Production d’anhydride phtalique par oxydation en phase liquide de l’o-xylène
L’anhydride phtalique peut être produit par oxydation en phase liquide de l’o-xylène. Dans ce processus, un mélange d’acide acétique, d’o-xylène (> 99 % de teneur en isomères ortho requis pour un rendement élevé) et un catalyseur à base de cobalt, de manganèse et de brome est introduit dans un système de réacteur en cascade.
La réaction démarre sous pression avec injection d’air et progresse dans les récipients suivants. L’eau générée comme sous-produit est éliminée dans le premier récipient par distillation azéotropique avec de l’o-xylène.
Les isomères de l’acide phtalique sont séparés et l’anhydride phtalique est obtenu par cristallisation. En raison de la présence de brome dans le catalyseur, le produit brut nécessite un prétraitement particulier avant une purification finale par distillation.
Le Procédé Sisas est un processus en deux étapes qui implique l’oxydation en phase liquide de l’o-xylène en acide o-toluique brut et l’o-xylène n’ayant pas réagi est recyclé. Ensuite, l’acide o-toluique séparé est oxydé en phase gazeuse pour produire de l’anhydride phtalique.
Le rendement molaire global en anhydride phtalique à base d’o-xylène peut atteindre jusqu’à 88 %.
Le processus d’oxydation en phase liquide est une alternative aux méthodes traditionnelles, mais n’a pas été largement adopté par l’industrie par rapport à l’oxydation catalytique en lit fixe.
4. Utilisations de l’anhydride phtalique
L’application la plus importante de l’anhydride phtalique est la production de plastifiants. Les principales utilisations de l’anhydride phtalique sont la production de plastifiants (55 %), de résines polyester insaturées (14 %), de résines alkydes (15 %) et d’autres produits chimiques tels que colorants et pigments, détergents, herbicides et insecticides, ignifuges, saccharine. et des agents de réticulation de résine polyester.
Il est largement utilisé dans le monde entier pour une gamme d’applications extrêmement large, allant de l’industrie du plastique à la synthèse de résines, de fongicides agricoles et d’amines.
5. Toxicologie de l’anhydride phtalique
L’anhydride phtalique présente une faible toxicité aiguë mais il peut provoquer une irritation et une sensibilisation respiratoires lors de son inhalation. Les études d’exposition chronique ne suggèrent aucun potentiel cancérigène et les données limitées sur la toxicité pour la reproduction nécessitent des recherches plus approfondies.
Toxicité aiguë
L’anhydride phtalique présente une faible toxicité aiguë sur la base des valeurs DL50 :
- Orale (rat) : 1 500 à 4 000 mg/kg
- Inhalation (rat) : >210 mg/m³ h (poussière)
- Dermique (lapin) : >10 000 mg/kg
Le contact cutané avec l’anhydride phtalique peut provoquer une légère irritation, tandis que le contact oculaire est irritant. Il peut également induire une sensibilisation cutanée.
Toxicité subaiguë
L’exposition alimentaire chez le rat (jusqu’à 3 800 ppm) pendant 28 jours n’a montré aucun effet significatif.
Des études par gavage chez le rat ont révélé une toxicité rénale et muqueuse gastrique à des doses supérieures à 1 200 mg/kg/jour.
Des études par inhalation ont démontré une irritation respiratoire chez divers animaux à des concentrations élevées (10 000 mg/m³).
Une exposition répétée par inhalation (8,5 mg/m³) a provoqué une irritation des voies respiratoires et de fréquentes pneumonies chez les rats.
Génotoxicité
Aucun effet mutagène ou chromosomique n’a été observé lors des tests in vitro avec et sans activation métabolique.
Toxicité chronique et cancérogénicité
Des études alimentaires à long terme chez des rats et des souris à des doses élevées (jusqu’à 3 600 mg/kg/jour) n’ont pas montré d’augmentation de la formation de tumeurs par rapport aux témoins.
Toxicité pour la reproduction
Des études limitées impliquant une injection intrapéritonéale chez la souris suggèrent des risques potentiels de malformation à des doses élevées (≥ 55,5 mg/kg/jour) pendant la gestation. Cependant, la voie d’exposition et la souche animale limitent le caractère concluant de ces résultats.
Références
- Phthalic Acid and Derivatives, Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a20_181.pub2
- Phthalic anhydride (PA): a valuable substrate in organic transformations. – https://pubs.rsc.org/en/content/articlehtml/2023/ra/d3ra03378c
- Process for the production of phthalic anhydride. – https://patents.google.com/patent/US4435580A/en
