ácido cloroacético: reacciones, producción y usos
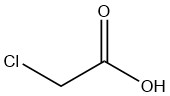
El ácido cloroacético puro es un sólido cristalino higroscópico e incoloro que existe en varias formas cristalinas. Es un compuesto sintético que fue descubierto por primera vez como producto de la cloración del ácido acético por N. LEBLANC en 1841. R. HOFFMANN lo sintetizó más tarde en 1857 iniciando la cloración del ácido acético utilizando la luz solar.
El ácido cloroacético y su sal de sodio se consideran los productos de cloración más importantes del ácido acético en términos de importancia industrial y económica.
Tabla de contenido
1. Propiedades del ácido cloroacético
El ácido cloroacético tiene una excelente solubilidad en agua y buena solubilidad en metanol, acetona, éter dietílico y etanol, pero sólo es escasamente soluble en hidrocarburos e hidrocarburos clorados.
1.1. Reacciones químicas del ácido cloroacético.
Las propiedades químicas del ácido cloroacético se pueden atribuir a la alta reactividad de su grupo ácido carboxílico y a la facilidad de sustitución de su átomo de α-cloro.
El ácido cloroacético y sus derivados, como sales, ésteres, anhídridos, cloruros de acilo, amidas e hidrazidas, se utilizan ampliamente como intermedios orgánicos sintéticos.
Las aplicaciones industriales del ácido cloroacético incluyen reacciones con bases orgánicas e inorgánicas, que producen sales. Algunas sales también pueden formar aductos con ácido cloroacético y el cloroacetato de sodio es un producto comercial importante.
Los ésteres del ácido cloroacético, como el cloroacetato de metilo, etilo y terc-butilo, se sintetizan mediante reacción con alcoholes u olefinas.
El cloruro de cloroacetilo se produce a partir de ácido cloroacético al reaccionar con varios reactivos como POCl3, PCl3, PCl5, cloruro de tionilo (SOCl2) o fosgeno (COCl2).
El ácido también puede reaccionar con cloruro de cloroacetilo para producir anhídrido bis(cloroacético), que se puede obtener deshidratando el ácido cloroacético con P2O5 o reaccionando con anhídrido acético.
El cloruro de cloroacetilo forma anhídridos mixtos con otros ácidos carboxílicos, como el anhídrido cloroacético acético.
La sustitución nucleofílica del átomo de cloro es una reacción importante cuando el ácido cloroacético se utiliza como intermediario en síntesis orgánicas.
Por ejemplo, la hidrolización de soluciones acuosas neutras o básicas de ácido cloroacético produce ácido glicólico (ácido hidroxiacético) y ácido diglicólico (ácido 2,2′-oxidiacético), un método industrial para producir estos compuestos.
Calentando las sales de ácido cloroacético se obtiene glicolida, 1,4-dioxina-2,5-diona. La reacción con hidrógenosulfuro de sodio o potasio forma ácido tioglicólico y ácido tiodiglicólico.
El ácido cloroacético también reacciona con el amoníaco, produciendo ácido aminoacético (glicina) como producto principal o ácido nitrilotriacético, dependiendo de las condiciones de reacción.
Cuando el cloroacetato de metilo reacciona con amoníaco a baja temperatura, se obtiene cloroacetamida. Al reaccionar con aminas terciarias en soluciones alcalinas se forman diversas betaínas comercialmente importantes, como la N-lauril betaína.
Además, los compuestos aromáticos como la naftaleno sufren sustitución electrófila con ácido cloroacético sobre catalizadores adecuados para formar ácidos arilacéticos.
El ácido cianoacético, de importancia comercial, que se utiliza como intermediario en la producción de cafeína sintética, se sintetiza haciendo reaccionar cianuro de potasio con ácido cloroacético en una solución neutra.
El ácido yodoacético se forma reaccionando con yoduro de potasio, mientras que los ácidos fenoxiacéticos se sintetizan mediante eterificación de fenol en presencia de hidróxido de sodio.
Además, se sintetizan derivados de carboximetilo con un grado relativamente alto de eterificación haciendo reaccionar polisacáridos, como celulosa, almidón, guar, etc., en un medio de hidróxido de sodio fuertemente alcalino.
2. Producción de ácido cloroacético.
Se han sugerido y patentado numerosas técnicas para la fabricación de ácido cloroacético. En el pasado, la producción industrial de ácido cloroacético implicaba la hidrólisis de 1,1,2-tricloroetileno con ácido sulfúrico como catalizador (1) y la cloración de ácido acético con cloro como catalizador (2). Sin embargo, actualmente sólo se emplea este último y más antiguo proceso para la producción de ácido cloroacético a escala industrial.
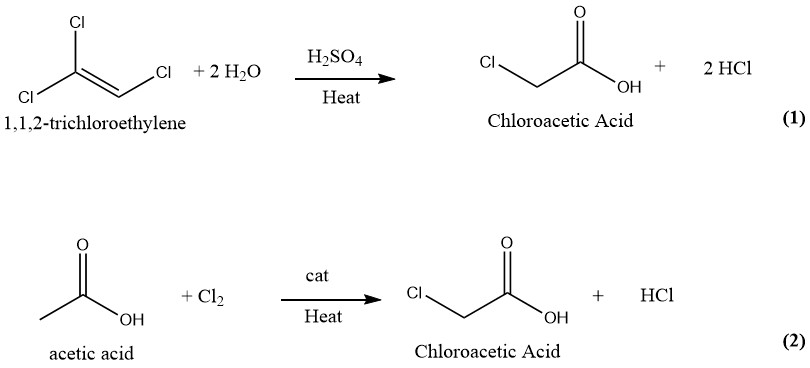
2.1. Hidrólisis de tricloroetileno
El ácido cloroacético se puede producir mediante un proceso continuo en el que se hacen reaccionar cantidades iguales de tricloroetileno y ácido sulfúrico al 75% a 130-140°C. Tras la conversión completa del tricloroetileno, la mezcla de reacción contiene aproximadamente un 50% de ácido cloroacético y entre un 1 y un 2% de agua.
Posteriormente, la mezcla se somete a destilación al vacío para obtener ácido cloroacético puro. Durante este proceso, los vapores se lavan con agua, que posteriormente se reutiliza como diluyente del ácido sulfúrico.
El gas cloruro de hidrógeno generado durante el proceso se lava con tricloroetileno fresco y luego se purifica mediante congelación y absorción en agua.
Este método produce 1000 kg de producto terminado y 700 a 750 kg de HCl gaseoso como subproducto de 1500 a 1850 kg de tricloroetileno y 600 kg de H2SO4 (95%).
El método del tricloroetileno para producir ácido cloroacético produce ácido cloroacético de alta pureza que está libre de ácido di o tricloroacético. Sin embargo, este método ya no se utiliza debido al alto costo del tricloroetileno y la importante cantidad de HCl generado como subproducto.
El procedimiento de purificación implica la separación del ácido cloroacético del tricloroetileno, ácido sulfúrico y agua.
2.2. Cloración del ácido acético
2.2.1. Síntesis
La conversión altamente selectiva de ácido acético en ácido cloroacético se puede lograr mediante cloración del ácido acético que emplea catalizadores apropiados. La reacción utiliza anhídrido acético como catalizador, lo que facilita el siguiente mecanismo de reacción:
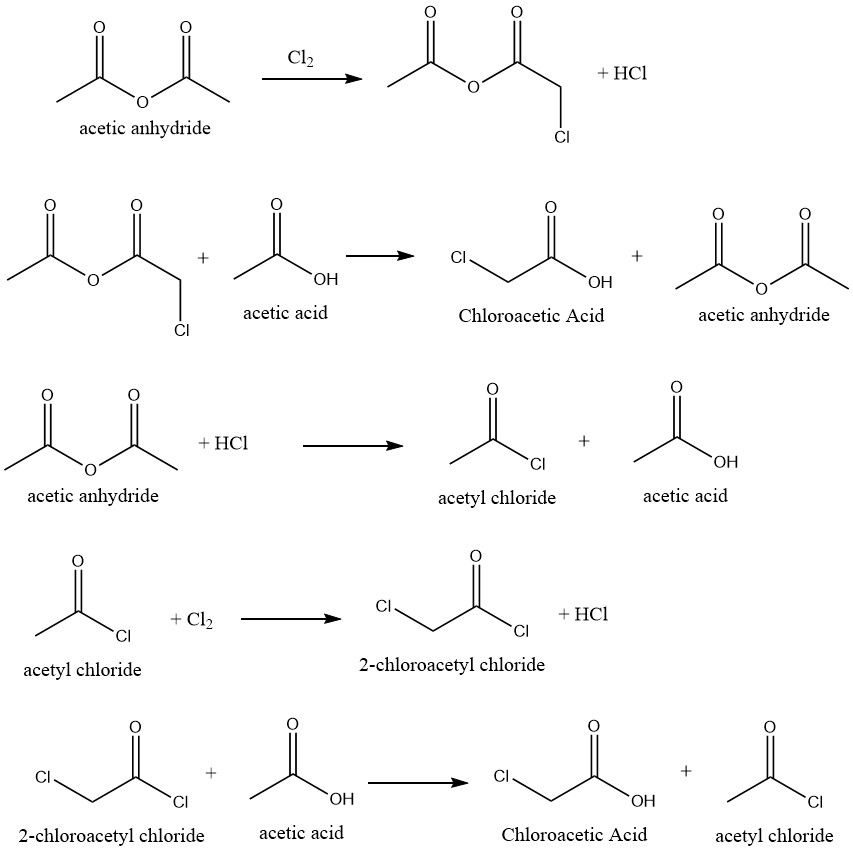
Se han sugerido varios inhibidores para impedir la formación de ácido dicloroacético, que se genera por la cloración del ácido cloroacético en la mezcla cruda. Al hacerlo, elimina o reduce el requisito de que el proceso de purificación produzca productos de calidad técnica.
2.2.2. Purificación
Para lograr el nivel de pureza requerido para muchos productos, es necesaria la separación de los ácidos dicloroacético y tricloroacético. Sin embargo, los puntos de ebullición cercanos de estos ácidos acéticos clorados hacen que la destilación fraccionada no sea práctica.
Se han sugerido técnicas alternativas, como la destilación azeotrópica y la destilación extractiva, para la separación del ácido dicloroacético, pero su eficacia sigue siendo incierta.
Un importante proceso de purificación industrial implica la cristalización sin disolventes, que se basa en la modificación α del punto de fusión más alto del ácido cloroacético. Los ácidos dicloroacético y tricloroacético se eliminan de las aguas madre después de la cristalización.
La cristalización puede ocurrir en cristalizadores de dedo estacionarios o cristalizadores con agitador agitado. Se utiliza una centrífuga para separar las aguas madres de la suspensión de cristales después de la cristalización en esta última.
Luego se lava el producto con agua o ácido acético. El ácido cloroacético puro comúnmente se funde y se transforma en escamas. En máquinas estacionarias la cristalización se realiza con dedos fríos.
Cuando todo el ácido cloroacético ha cristalizado, se escurren las aguas madre y el producto cristalino puro se funde y se desmenuza.
Como método de purificación alternativo se ha propuesto un proceso de cristalización en capa fina con materias primas.
Además, se han informado procesos de cristalización basados en solventes que utilizan tetracloruro de carbono, diclorometano o hidrocarburos con tres átomos de cloro, lo que da como resultado cristales fácilmente filtrables.
Independientemente del método utilizado, se genera un licor madre compuesto de ácido acético, ácido cloroacético y ácidos dicloroacético y tricloroacético. En condiciones ideales, esta mezcla se puede clorar adicionalmente para producir el útil ácido tricloroacético.
Un método de purificación más importante implica la hidrodecloración catalítica de subproductos no deseados, como el ácido dicloro y tricloroacético. Los ácidos dicloroacético y tricloroacético se pueden declorar mediante hidrogenación catalítica a alta temperatura, normalmente utilizando paladio sobre un soporte (por ejemplo, carbón o gel de sílice).
Cuando se utiliza hidrodecloración catalítica en fase de vapor, el ácido dicloroacético se convierte principalmente en ácido acético. Sin embargo, el uso de vehículos inertes finamente dispersos con Pd en la fase líquida a 130-150°C da como resultado una decloración selectiva para formar ácido cloroacético.
También se han propuesto modificaciones de este procedimiento, como rociar ácido crudo con gas hidrógeno al vacío o gotear ácido sobre el catalizador en un lecho fijo. La adición de HCl al ácido crudo antes del contacto con el catalizador en el lecho fijo mejora la selectividad y saponifica los cloruros y anhídridos del ácido antes de la decloración.
El catalizador de Pd sobre un portador de gel de sílice (tamaño de partícula de 40 a 200 mm) es altamente activo y selectivo, y los aditivos cocatalíticamente eficaces, como el acetato de sodio, pueden mejorar aún más los resultados.
El enriquecimiento de la superficie del metal noble mejora la eficiencia del catalizador y el catalizador gastado puede reactivarse mediante un tratamiento con cloro.
El uso de catalizadores de Pd en portadores de carbón activo optimizados reduce los subproductos de reducción excesiva (por ejemplo, aldehídos) durante el paso de hidrogenación, que se puede realizar utilizando un reactor de circuito.
Se puede lograr un método para disminuir la concentración de ácido dicloroacético en ácido cloroacético de 2000 a 210 ppm utilizando catalizadores de metales no nobles a entre 100 y 140°C sin hidrógeno.
La Figura 1 muestra un proceso de cloración industrial, donde se clora una mezcla de ácido acético, anhídrido acético y cloruro de acetilo reciclado en el reactor (a) a 90–140 °C. El gas HCl formado contiene sólo trazas de cloro.
La mezcla resultante de ácido cloroacético, ácido acético y anhídrido acético se condensa usando condensadores enfriados por agua (b) y se devuelve al reactor. El cloruro de acetilo arrastrado en el gas HCl se recupera en un proceso posterior a baja temperatura (c) y se recicla.
El gas HCl se purifica y se convierte en ácido clorhídrico acuoso concentrado.
Los ácidos acéticos crudos se pueden destilar al vacío (d) antes del paso de decloración, que se lleva a cabo a 120-150 °C utilizando un catalizador de paladio y un gran exceso de hidrógeno. El ácido acético se toma por la cabeza de la columna de fraccionamiento al vacío (i), mientras que el producto del fondo es ácido cloroacético puro.
Si se desea, el ácido cloroacético se puede purificar aún más mediante destilación para eliminar impurezas de alto punto de ebullición, como los productos de condensación de los aldehídos formados durante la etapa de hidrogenación.
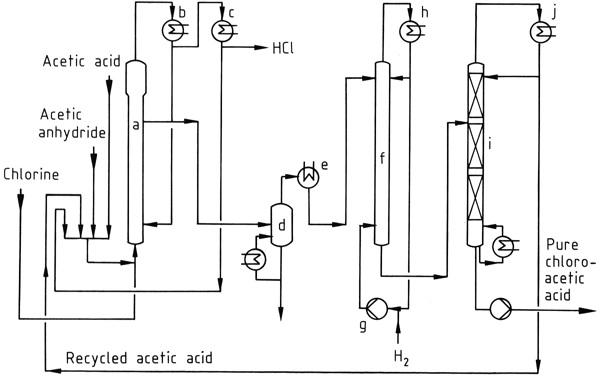
a) Reactor de cloración; b) Condensador para ácido acético, anhídrido acético, ácido cloroacético; c) Condensador para cloruro de acetilo; d) Evaporador; e) Condensador para ácido cloroacético; f) reactor de hidrogenación; g) compresor de hidrógeno; h) Condensador; i) columna de destilación; j) Condensador para ácido acético
3. Usos del ácido cloroacético
El ácido cloroacético es un compuesto químico versátil que se utiliza en una amplia gama de aplicaciones industriales. Uno de sus usos principales es la fabricación de carboximetilcelulosa o CMC, que asciende a varios cientos de miles de toneladas al año.
Además de la CMC, el ácido cloroacético también puede reaccionar con el almidón para producir carboximetilalmidón, que se utiliza tan ampliamente como la CMC. Si bien otros polisacáridos también pueden modificarse con ácido cloroacético, no se emplean con tanta frecuencia.
Otra aplicación importante del ácido cloroacético es la producción de herbicidas a base de ácidos arilhidroxiacéticos, específicamente ácidos clorofenoxialcanoicos. Estos herbicidas se encuentran entre los más utilizados en el sector agrícola.
Además, en la producción del insecticida dimetoato se utilizan ácido cloroacético y cloroacetato de metilo, así como los herbicidas benazolina y b-naftiloxiacetato de metilo.
Un tercer uso importante del ácido cloroacético es la fabricación de ácido tioglicólico, también conocido como ácido mercaptoacético. Esto se logra haciendo reaccionar el ácido cloroacético con sulfuro de hidrógeno de sodio o potasio u otros compuestos de azufre.
El ácido tioglicólico se emplea en diversas formas, incluida su sal, éster o derivado. La mayor parte del ácido tioglicólico producido se utiliza en la producción de estabilizadores para poli(cloruro de vinilo).
También se utiliza en cosmética para el cabello y en otras aplicaciones industriales, como la producción de betaínas de cadena larga, como la N-lauril betaína, que son tensioactivos utilizados en limpiadores y productos de cuidado personal.
Además de estas aplicaciones, el ácido cloroacético tiene muchos otros usos en reacciones sintéticas orgánicas. Por ejemplo, el ácido cianoacético o sus ésteres se pueden emplear para fabricar cafeína y barbitúricos, que son importantes hipnóticos.
El ácido cloroacético puede condensarse con hidrocarburos aromáticos para formar ácidos arilacéticos.
Cuando se reacciona con naftaleno, se produce ácido 1-naftilacético como producto principal y ácido 2-naftilacético como subproducto. Se sabe que ambas sustancias promueven el crecimiento de las plantas.
Por último, el ácido cloroacético desempeña un papel esencial en la síntesis de cumarina y vitamina B6.
Referencia
- Chloroacetic Acids; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a06_537.pub3
