Phénol: Production, Réactions et Utilisatiions
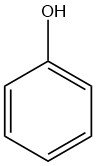
Le phénol, également connu sous le nom d’hydroxybenzène, est un composé organique de formule chimique C6H5OH. C’est un solide cristallin blanc à température ambiante, mais le phénol de qualité technique peut être liquide en raison d’impuretés. Il a une odeur distincte, souvent décrite comme étant incroyablement douce et goudronneuse.
Le phénol a été découvert en 1834 par RUNGE, qui l’a isolé du goudron de houille et l’a nommé acide carbolique.
En 1841, LAURENT l’obtient sous forme cristalline, détermine sa composition et le nomme acide phénolique, qui sera plus tard abrégé en phénol.
Enfin, KEKULE a formulé sa structure moléculaire en 1858. Jusqu’à la fin des années 1800, tout le phénol était récupéré du charbon. Il était principalement utilisé comme désinfectant.
En 1897, HOFFMANN a été le premier à synthétiser l’acide acétylsalicylique à partir du phénol sous une forme pure et stable.
Dans les années 1900, la demande de phénol a augmenté avec la commercialisation des résines phénoliques après la Première Guerre mondiale, des bisphénols après la Seconde Guerre mondiale et des polycarbonates dans les années 1960.
Table des matières
1. Production de phénol
Aujourd’hui, l’oxydation du cumène (procédé Hock) est de loin la voie de synthèse dominante du phénol avec un taux de production de plus de 6,7 millions de t/a de phénol et environ 4,1 millions de t/a du coproduit acétone.
C’est le procédé le plus compétitif, soutenu par la demande d’acétone. Comme la demande de phénol pourrait augmenter plus fortement à l’avenir, il existe toujours un intérêt commercial à trouver de nouvelles voies d’accès au phénol sans coproduit, par exemple l’oxydation directe du benzène en phénol.
L’oxydation du toluène donne l’acide benzoïque comme produit intermédiaire qui est utilisée pour la production de phénol.
Environ 300 000 t de phénol sont encore récupérées du goudron de houille.
Depuis env. 1995 l’oxydation directe du benzène en phénol avec du protoxyde d’azote a été développée par Solutia mais n’a toujours pas été commercialisée.
Les voies de synthèse classiques telles que le procédé de sulfonation du benzène et l’hydrolyse du chlorobenzène par la soude caustique n’ont plus aucune importance économique.
1.1. Oxydation du cumène (procédé du jarret)
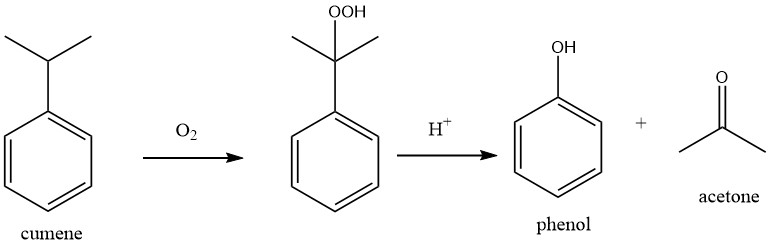
Le processus consiste en deux réactions chimiques fondamentales : le cumène est d’abord oxydé avec de l’oxygène en hydroperoxyde de cumène (CHP).
Le CHP est ensuite clivé en phénol et acétone en utilisant un acide minéral fort comme catalyseur. Les deux réactions sont très exothermiques avec des chaleurs de réaction de -117 kJ/mol pour l’oxydation du cumène et de -252 kJ/mol pour le clivage du peroxyde.
Ces réactions ont été signalées pour la première fois en 1944 par H. HOCK et S. LANG.
Le procédé industriel d’oxydation du cumène a été développé et commercialisé après la Seconde Guerre mondiale par The Distillers Co. en Grande-Bretagne et Hercules Powder Company aux États-Unis. La première usine a démarré en 1952 à Shawinigan, Canada, avec une capacité de 8000 t/a.
1.2. Oxydation du toluène
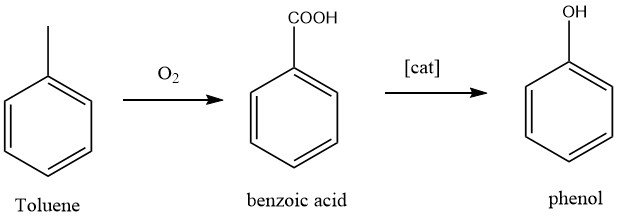
Ce procédé a été développé par California Research Corp. et Dow Chemical. Les deux étapes du procédé sont d’abord l’oxydation du toluène en acide benzoïque, qui était déjà bien connue, et ensuite l’oxydation de l’acide benzoïque en phénol.
En principe, la conversion du toluène en phénol est une oxydation complète du groupe méthyle avec comme sous-produits du dioxyde de carbone et de l’eau.
L’oxydation du toluène comme première étape est réalisée en phase liquide à des températures d’environ 100 à 150 °C et une pression manométrique d’environ 2 bar.
L’oxygène atmosphérique est utilisé. Un naphténate de cobalt est utilisé comme catalyseur soluble à des concentrations comprises entre 0,1 et 0,3 %. L’oxydation du toluène en acide benzoïque a un mécanisme radicalaire complexe.
L’alcool benzylique et le benzaldéhyde sont des intermédiaires dans l’oxydation successive en acide benzoïque. Des sous-produits tels que le benzoate de benzyle et le biphényle sont formés, ainsi que de l’acide formique, de l’acide acétique et, en plus petites quantités, du dioxyde de carbone et du monoxyde de carbone.
Pour l’oxydation de l’acide benzoïque en tant que deuxième étape, l’acide benzoïque fondu est utilisé comme réactif et milieu solvant. La température est d’environ 230 à 240°C à la pression atmosphérique. L’acide benzoïque réagit avec l’oxygène atmosphérique, la vapeur et le benzoate de cuivre (II) soluble comme catalyseur. Des sels de magnésium peuvent être ajoutés pour agir comme promoteur.
La formation de phénol est le résultat net de plusieurs réactions qui se produisent simultanément dans le système. Le benzoate de cuivre (II) se décompose thermiquement en benzoate de cuivre (I) et en acide benzoylsalicylique : Le benzoate de cuivre (I) de la première étape de réaction est régénéré avec l’oxygène atmosphérique.
En présence d’eau ou de vapeur, l’acide benzoylsalicylique est hydrolysé en acide benzoïque et en acide salicylique. L’acide salicylique est décarboxylé rapidement pour donner du phénol et du dioxyde de carbone.
La première usine commerciale basée sur le procédé Dow a démarré au début des années 1960 à Landar, en Colombie-Britannique, exploitée par Dow-Canada (fermée), et la seconde à Kalama, Washington, exploitée par Dow Chemical Company. La troisième usine a été construite à Rosenburg, aux Pays-Bas, exploitée par DSM. En 1991, une nouvelle usine a été mise en service au Japon par Nippon Phenol.
En 1978, The Lummus Company a annoncé un nouveau procédé d’oxydation de l’acide benzoïque. L’oxydation est conduite en phase vapeur sur un catalyseur contenant du cuivre. La réaction est conduite dans un réacteur en phase vapeur sur un catalyseur hétérogène.
Lummus a annoncé qu’il n’y a pas de formation de goudrons ou de résidus non volatils. Ceci est probablement dû au fait que le phénol est rapidement éliminé de la zone de réaction.
1.3. Phénol de charbon
La récupération du phénol « naturel » à partir du charbon est le plus ancien procédé commercial de production de phénol et il est toujours pratiqué. De nos jours, ce processus n’a que peu d’importance en tant que source de phénol.
Le phénol, ainsi que de nombreux autres composés aromatiques, est récupéré des vapeurs de carbonisation du charbon. Le charbon est chauffé à plus de 900 °C à l’abri de l’air dans un four à coke. Les hydrocarbures condensables et les gaz sont éliminés sous forme de vapeurs laissant le coke comme résidu solide. Les vapeurs sont condensées pour former du goudron de houille.
Le gaz peut être lavé avec de l’acide sulfurique ou de l’acide phosphorique aqueux pour récupérer l’ammoniac. Il peut également être lavé avec une huile de lavage pour éliminer davantage le benzène. Le gaz restant, composé d’hydrogène et de méthane, est utilisé comme combustible sur place.
Le goudron de houille est ensuite traité par distillation continue. Dans une première colonne, l’huile légère, qui contient du benzène, du toluène et des xylènes, est séparée avec de l’eau. Dans une deuxième colonne, de l’huile carbolique, contenant du phénol et des composés phénoliques, est prise en tête et de l’huile de naphtalène en coupe latérale.
Le produit de fond de la deuxième colonne est encore fractionné pour donner de l’huile de lavage pour la récupération du benzène à partir des gaz de dégagement, de l’huile de méthylnaphtalène, de l’huile d’anthracène et du brai. Les colonnes à plateaux ou les colonnes à garnissage aléatoire sont utilisées avec des taux de reflux élevés et un haut degré d’intégration thermique.
L’huile carbolique, qui constitue ca. 2 à 3 % du goudron de houille, contient environ 30 à 35 % de composés phénoliques tels que le phénol et les crésols, est traité avec 8 à 9 % de soude caustique dans l’unité d’extraction.
Le phénol et les crésols, connus sous le nom d’acides de goudron, sont extraits sous forme de sels dans la phase aqueuse. La lessive de phénolate brut est traitée par distillation à la vapeur pour séparer les hydrocarbures résiduels et les bases pyridiniques. La lessive de phénolate est ensuite traitée avec du dioxyde de carbone pour libérer les goudrons acides de leurs sels dans la colonne.
La phase aqueuse contenant du carbonate de sodium est en outre traitée pour éliminer le phénol dissous. La phase organique est fractionnée en phénol pur (bp 181,8 °C), o-crésol (bp 191,0 °C), un mélange de m- et p-crésols (bp 202,0 – 203,0 °C) et une fraction de xylénol (bp jusqu’à à 210 °C) par distillation discontinue.
2. Réactions chimiques du phénol
Les propriétés chimiques du phénol sont caractérisées par l’influence mutuelle du groupe hydroxyle et du cycle aromatique l’un sur l’autre.
2.1. Réactions impliquant la liaison O-H.
Contrairement aux alcools aliphatiques, le phénol est un acide faible et réagit donc avec les bases fortes pour former des sels solubles dans l’eau. Cet effet est utilisé pour récupérer le phénol à partir de liquides organiques tels que le goudron de houille.
La valeur de pKa en solution aqueuse est de 10,0. L’anion phénolate est stabilisé par le système cyclique aromatique.
A température ambiante, le phénol peut être libéré des sels même avec du dioxyde de carbone.
À des températures proches du point d’ébullition du phénol, il peut déplacer les acides carboxyliques tels que l’acide acétique de leurs sels, ce qui entraîne la formation de phénolates.
Le groupe hydroxyle peut facilement être estérifié (par exemple en acétate de phényle) et éthérifié (par exemple en éther diphénylique).
2.2. Réactions du cycle aromatique
L’acidité du phénol est due au fait que la paire d’électrons non partagés est délocalisée sur le cycle aromatique et ainsi stabilisée. L’excès d’électrons dans le cycle aromatique aux positions ortho et para rend le phénol très sensible à la substitution électrophile.
Un exemple est la réaction avec le brome en solution aqueuse pour donner du 2,4,6-tribromophénol avec un rendement élevé.
Une autre réaction importante est le couplage du dioxyde de carbone avec du phénoxyde de sodium à 125 ° C pour donner le salicylate de sodium (réaction de Kolbe). A 125 °C, le dioxyde de carbone est remplacé en position ortho, alors qu’à des températures supérieures à 250 °C, l’isomère para est favorisé.
Les autres réactions suivant la substitution électrophile sont la chloration, la sulfonation et la nitration.
2.3. Oxydation en phase liquide
L’oxydation des substances organiques par l’oxygène moléculaire conduit à un grand nombre de produits intermédiaires, par exemple l’hydroperoxyde de cumène.
Ces processus procèdent par un mécanisme radicalaire complexe. Le phénol agit comme un inhibiteur dans de telles réactions en réagissant avec les radicaux libres pour former des radicaux phénoxy.
Ce sont des radicaux relativement stables qui ne propagent pas le mécanisme en chaîne. Par conséquent, toute pénétration indésirable de phénol dans de tels procédés d’oxydation doit être évitée.
3. Utilisations du phénol
La capacité de production totale dans le monde est de plus de 9 millions de tonnes. Environ 37 % de la production mondiale sont utilisés pour la production de bisphénol A. Le bisphénol A est surtout utilisé pour la production de polycarbonates de haute qualité pour disques compacts, pour le vitrage et pour l’industrie automobile. Le bisphénol A est également utilisé pour la production de résines époxy.
La deuxième plus grande consommation de phénol concerne la production de résines phénoliques avec du formaldéhyde. Ils sont principalement utilisés pour les applications de sous-étanchéité dans l’industrie automobile.
Le phénol est également utilisé pour la production de caprolactame via le cyclohexanol–cyclohexanone. De nombreux autres dérivés du phénol sont produits tels que l’aniline, les alkylphénols, les diphénols et l’acide salicylique.
Comme l’industrie automobile est un important consommateur de dérivés du phénol tels que les polycarbonates et les résines phénoliques, l’ensemble de la demande de phénol a toujours tendance à être étroitement liée à ce marché.
Référence
- Phenol; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a19_299.pub3
