Nitration des composés aromatiques
1. Démêler l’histoire des réactions de nitration aromatique
Au début du 19e siècle, des progrès significatifs ont été réalisés dans la synthèse des composés nitrés aromatiques. Mitscherlich en 1834 a obtenu avec succès de tels composés en soumettant des hydrocarbures dérivés du goudron de houille à de l’acide nitrique fumant.
Laurent a poursuivi ce travail en 1835, en se concentrant sur la nitration du naphtalène, l’hydrocarbure aromatique pur le plus facilement disponible à cette époque. En 1838, Dale a présenté ses découvertes sur les composés nitrés mixtes dérivés du benzène brut lors de la réunion annuelle de la British Association for the Advancement of Science.
Cependant, ce n’est qu’en 1845 que Hofmann et Muspratt ont rapporté leurs recherches systématiques sur la nitration du benzène, aboutissant à des mono- et dinitrobenzènes utilisant un mélange d’acides nitrique et sulfurique.
Table des matières
La production initiale de nitrobenzène a été réalisée à petite échelle et soigneusement distillée pour donner un liquide jaune avec un arôme d’amande amère. Ce produit, appelé « essence de mirbane », était vendu aux fabricants de savons et de parfums.
Le procédé de réduction du fer de Bechamp, qui augmentait la disponibilité de l’aniline, a été publié en 1854. Par la suite, la découverte par Perkin de l’aniline mauve en 1856 a marqué le début de l’industrie européenne des colorants à l’aniline, servant de base à l’industrie mondiale des colorants synthétiques, avec des ventes estimées. de 6 $ x 109 en 1988.
Le développement et la mise à l’échelle des procédés de nitration et de réduction, initiés par Perkin et poursuivis par de nombreux autres, ont considérablement réduit le prix commercial de l’aniline de 50 Fr/kg en 1858 à 10 Fr/kg en 1863.
En 1871, la production européenne d’aniline avait atteint 3500 t/a. En 1985, la production européenne d’aniline est passée à 500 000 t/a, son utilisation dans les colorants ne représentant que 4 % de la production globale d’aniline.
La majorité de la croissance a été attribuée aux produits chimiques du caoutchouc et aux isocyanates, consommant plus de 50 % de la production de nitrobenzène pour la fabrication de diphényldiisocyanate de méthylène.
Les composés nitroaromatiques naturels sont en nombre limité, le chloramphénicol étant le premier reconnu en 1949, extrait de cultures de Streptomyces venezuelae, une moisissure du sol.
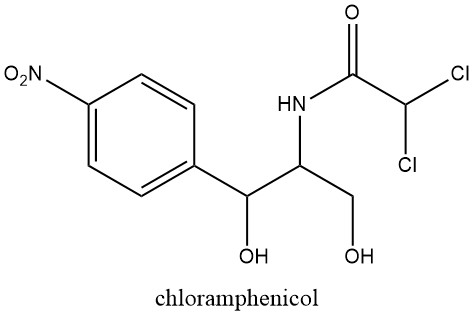
Cette découverte a incité de nouvelles recherches sur l’activité pharmacologique du groupe nitro, suite à la découverte antérieure des propriétés antibactériennes des dérivés du nitrofurane en 1943.
De nombreux produits pharmaceutiques et agrochimiques synthétiques contiennent également des groupes nitroaromatiques, bien que le rôle précis du groupe nitro dans ces composés reste souvent incertain.
La principale méthode d’introduction de groupes nitro dans les systèmes aromatiques est la nitration.
Bien qu’il existe certaines méthodes indirectes disponibles, telles que l’oxydation des composés nitroso ou amino, le remplacement des groupes diazonium (réaction de Sandmeyer), le réarrangement des nitramines et les réactions de déplacement nucléophile, elles ont une importance industrielle limitée.
Les procédés unitaires, comme la sulfonation, l’halogénation ou l’amination, sont couramment appliqués aux matières de départ nitro primaires, principalement dérivées du nitrobenzène, des nitrotoluènes et des nitrochlorobenzènes, pour produire divers composés nitrés importants.
Le déplacement nucléophile des groupes nitro activés a un certain potentiel de synthèse et sa nucléofugicité peut être comparable à celle des substituants fluorés. Certains composés nitrés facilement disponibles, comme le 1,3-dinitrobenzène, réagissent avec des réactifs spécifiques pour former des dérivés utiles.
Les composés nitrés ou leurs dérivés servent d’intermédiaires pour les colorants, les produits agrochimiques, les produits pharmaceutiques, les produits chimiques fins, les matériaux synthétiques et les explosifs, avec peu de débouchés majeurs pour la production à grande échelle.
2. Réaction de nitration
Le processus de nitration peut être décrit comme l’introduction irréversible d’un ou plusieurs groupes nitro (NO2) dans un noyau aromatique, en remplacement d’un atome d’hydrogène.
La nitration est une réaction de substitution électrophile, représentée par l’équation :
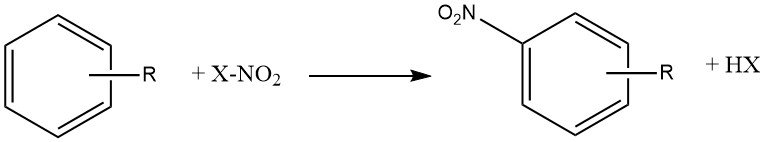
L’introduction du groupe nitro désactive le cycle vers une substitution électrophile supplémentaire, faisant de la dinitation un événement rare dans les conditions utilisées pour la mononitration.
Des conditions plus vigoureuses sont généralement requises pour la dinitration, nécessitant un excès d’acide plus fort et une température plus élevée. Ces conditions sont souvent appliquées à des composés mononitro isolés, plutôt que d’effectuer des réactions par étapes in situ.
La réaction de nitration est fortement exothermique, comme en témoigne la mononitration du benzène (ΔH = -117 kJ/mol) et du naphtalène (ΔH = -209 kJ/mol). Par conséquent, il s’agit de l’un des processus unitaires les plus potentiellement dangereux exploités industriellement.
La chaleur générée lors de la nitration peut amener l’acide nitrique à dégrader de manière exothermique les matières organiques en produits gazeux avec une violence explosive.
Les composés nitroaryliques, en particulier ceux comportant plusieurs groupes nitro, présentent des risques potentiels en raison de leur forte teneur en oxygène.
Certains composés polynitro, comme le trinitrotoluène et l’acide picrique, sont détonables et ont une longue histoire d’utilisation comme explosifs. De plus, les composés nitroaromatiques peuvent subir de violentes réactions de décomposition lorsqu’ils sont chauffés avec un alcali.
Le processus de nitration peut être effectué en utilisant soit une base discontinue (discontinue) soit une base continue. Les réactions discontinues conviennent aux exigences de tonnage inférieur et sont effectuées dans des nitrateurs conçus pour traiter divers produits.
Pour des raisons de sécurité, ces réacteurs sont généralement limités à une capacité d’environ 6 000 litres et équipés d’agitateurs et de systèmes de refroidissement efficaces.
D’autre part, la réaction en continu, adaptée aux intermédiaires de gros tonnage comme le nitrobenzène et les nitrotoluènes, offre des avantages en termes de sécurité et de rentabilité.
La production nitroaromatique repose principalement sur des procédés à haut rendement, avec plus de 80 % du coût total attribué aux matières premières. Par conséquent, les économies d’exploitation sont limitées.
Cependant, des améliorations ont été apportées dans des domaines tels que le recyclage de l’acide sulfurique, une exigence essentielle dans les procédés de nitration efficaces, et le contrôle et la séparation des isomères, contribuant à l’amélioration de l’efficacité du procédé.
3. Agents nitrants
Pour des raisons pratiques et économiques, la nitration à l’échelle industrielle est couramment réalisée à l’aide d’un acide mixte, qui est une combinaison d’acides nitrique et sulfurique. Occasionnellement, d’autres combinaisons, telles que l’acide nitrique aqueux, l’acide nitrique dans l’acide acétique ou l’acide nitrique dans l’anhydride acétique, sont utilisées.
Dans certaines études de support importantes, des acides composants alternatifs comme l’acide perchlorique, l’acide fluorhydrique ou le trifluorure de bore peuvent être utilisés, mais leur application est limitée. Ces réactions alternatives peuvent avoir lieu dans des solvants organiques inertes comme les hydrocarbures chlorés ou le sulfolane pour créer des mélanges réactionnels homogènes.
La force de l’agent nitrant (X-NO2) diminue à mesure que l’électronégativité de X diminue. L’espèce la plus active dans ces systèmes est l’ion nitronium (NO2+). Dans le système commun, l’équation globale est un composite de divers équilibres présents dans les mélanges HNO3 – H2SO4 – H2O, qui doivent être pris en compte lors de l’évaluation de la réactivité du substrat et de l’étendue de la nitration requise.
Pour la mononitration aromatique à grande échelle, un agent de nitration typique se compose de 20 % d’acide nitrique, 60 % d’acide sulfurique et 20 % d’eau, souvent appelé « acide mixte 20/60/20 ». Alternativement, dans certaines situations, il peut être décrit comme 15 % en moles d’acide nitrique, 30 % en moles d’acide sulfurique et 55 % en moles d’eau.
Le substrat aromatique liquide et le produit nitré forment typiquement une phase séparée de l’acide mixte aqueux. Par conséquent, une agitation efficace est cruciale pour maximiser le contact avec la phase organique et minimiser la résistance au transfert de masse.
Les substrats solides sont mieux dissous dans la phase d’acide sulfurique. Il est essentiel d’optimiser diverses variables, telles que la concentration d’acide nitrique, la température et d’autres paramètres pour chaque nitration spécifique afin d’obtenir la formation d’isomères souhaitée et de minimiser les réactions secondaires.
Les réactions radicalaires, généralement employées en phase vapeur avec de l’acide nitrique ou du dioxyde d’azote comme agent de nitration, ne sont pas couramment utilisées dans la nitration aromatique. Ils sont plus adaptés à la nitration aliphatique.
4. Mécanismes de réaction de nitration
De nombreuses expérimentations ont été menées sur la nitration aromatique depuis la confirmation de l’ion nitronium (NO2+) comme espèce active par l’école Ingold-Hughes en 1950, en utilisant l’analyse des spectres Raman.
Alors que la température et le degré de mélange jouent un rôle crucial dans tous les agents de nitration, d’autres variables conduisent souvent à des résultats incohérents. Dans la nitration commerciale utilisant HNO3-H2SO4, les constantes de vitesse relatives présentent une large plage, ce qui entraîne des temps de réaction variant de plusieurs secondes pour les substrats actifs à plusieurs heures pour les substrats inactifs.
Il a été avancé que dans les conditions non idéales de la production à grande échelle, le transfert de masse peut avoir plus de contrôle sur la nitration que la cinétique, remettant en question l’hypothèse de nombreuses études en laboratoire selon laquelle la résistance au transfert de masse est négligeable.
De plus, une hypothèse antérieure selon laquelle le taux de nitration s’aligne sur la formation à l’équilibre de l’ion nitronium a été remise en question en raison de la prise de conscience que différents mécanismes peuvent s’appliquer à différentes forces d’acide.
La figure 1 illustre le mécanisme qui peut rendre compte de tous les faits disponibles sur la nitration de substrats simples tels que le benzène et le toluène (à l’exclusion des phénols ou des polyalkylbenzènes). Ce mécanisme implique quatre constantes de vitesse et trois réactions réversibles significatives, ce qui rend la cinétique très complexe, même si la réaction est entièrement contrôlée cinétiquement.
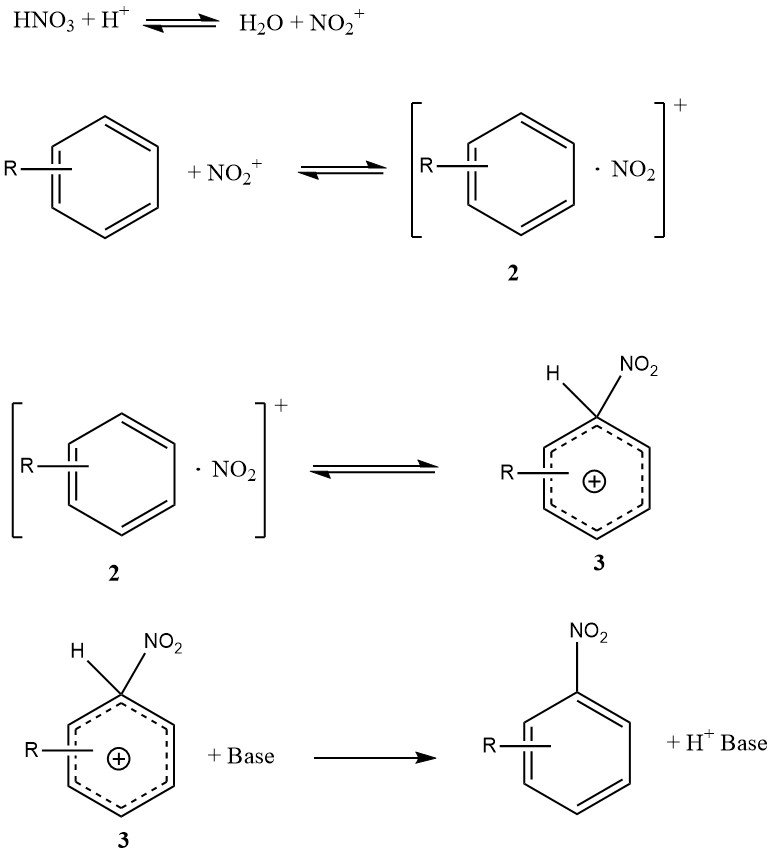
Le complexe de rencontre ou paire de rencontre (2) est une nouvelle caractéristique de ce mécanisme. Il s’agit d’un complexe moléculaire de nature moins spécifique par rapport au concept antérieur de complexe p intermédiaire. Il est important de noter que le complexe de rencontre (2) joue un rôle cinétique et peut en effet être déterminant pour la vitesse.
La conversion du complexe s (3), parfois appelé intermédiaire de Wheland, en produit n’est pas limitante car la réaction de nitration ne présente pas d’effet isotopique cinétique primaire.
Dans des conditions spécifiques, la formation de l’ion nitronium peut être déterminante pour la vitesse, mais pour les substrats réactifs dans l’acide sulfurique aqueux, la formation du complexe de rencontre (2) est principalement l’étape déterminante pour la vitesse.
En revanche, la nitration du toluène, du benzène et d’autres composés aromatiques moins réactifs suit une loi de vitesse globale où la formation du complexe s (3) est principalement l’étape déterminant la vitesse.
Dans le cas du phénol, lorsque le cycle est fortement activé vis-à-vis de l’attaque électrophile, l’ion nitrosonium (NO+) devient significatif et conduit à la formation d’un composé nitroso intermédiaire. Cet intermédiaire est ensuite oxydé par l’acide nitrique pour donner le dérivé nitré tout en régénérant l’acide nitreux.
Une autre exception au mécanisme général est l’attaque ipso-électrophile en position de substituant. Avec les di- et polyalkylbenzènes, l’ion ipso-nitroarénium (4) peut se former à la place de l’intermédiaire Wheland classique (3).
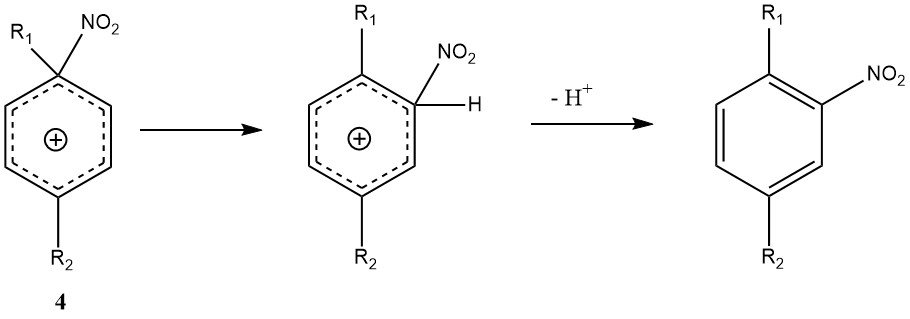
Le réarrangement de 4 en l’intermédiaire de Wheland peut se produire, mais il s’accompagne de réactions secondaires telles que la nitro-désalkylation, ce qui rend la nitration des polyalkylbenzènes produisant potentiellement des produits de mélange plus variables que les autres nitrations.
Une meilleure compréhension de la formation des intermédiaires ipso-Wheland a conduit à leur utilisation dans d’autres réactions, en particulier avec des nucléophiles.
Référence
- Nitro Compounds, Aromatic; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a17_411
FAQ
La réaction de nitration est un processus chimique dans lequel un ou plusieurs groupes nitro (NO2) sont introduits dans un noyau aromatique en remplaçant un atome d’hydrogène. Il s’agit d’une réaction de substitution électrophile couramment utilisée pour modifier les composés aromatiques en fixant des groupes nitro, ce qui peut modifier considérablement leurs propriétés et leur réactivité.
Les principaux produits chimiques utilisés dans la nitration sont l’acide nitrique (HNO3) et l’acide sulfurique (H2SO4), qui forment ensemble un mélange appelé acide mixte. D’autres produits chimiques qui peuvent être occasionnellement utilisés comprennent l’acide nitrique aqueux, l’acide nitrique dans l’acide acétique ou l’acide nitrique dans l’anhydride acétique. L’acide perchlorique, l’acide fluorhydrique ou le trifluorure de bore peuvent être utilisés dans des études complémentaires spécifiques.
Dans la nitration aromatique, l’électrophile responsable de l’attaque du noyau aromatique est l’ion nitronium (NO2+). L’ion nitronium est formé par la réaction entre l’acide nitrique et l’acide sulfurique et agit comme électrophile, acceptant une paire d’électrons du cycle aromatique lors de la réaction de substitution électrophile.
L’acide sulfurique dans la nitration aromatique agit comme un catalyseur dans la formation de l’ion nitronium (NO2+) à partir de la réaction entre l’acide nitrique et l’acide sulfurique. De plus, l’acide sulfurique aide à déshydrater l’acide nitrique, ce qui en fait un agent de nitration plus puissant. De plus, l’acide sulfurique aide à dissoudre et à solubiliser le substrat aromatique, permettant une réaction efficace et maximisant le contact avec l’agent de nitration.
Les principaux produits de la nitration sont des composés nitroaromatiques monosubstitués, qui se forment lorsqu’un groupe nitro est introduit dans le noyau aromatique. Cinq produits potentiels de la nitration peuvent inclure :
1. Nitrobenzène (C6H5NO2)
2. Nitrotoluènes (par exemple, ortho-nitrotoluène, méta-nitrotoluène et para-nitrotoluène)
3. Nitronaphtalènes (par exemple, alpha-nitronaphtalène et bêta-nitronaphtalène)
4. Nitrophénols (par exemple, ortho-nitrophénol, méta-nitrophénol et para-nitrophénol)
5. Nitroanilines (par exemple, ortho-nitroaniline, méta-nitroaniline et para-nitroaniline)
