Méthodes de production d’amines aliphatiques
La production d’amines implique différentes méthodes, chacune adaptée à des matières premières spécifiques et aux produits souhaités. Les amines aliphatiques sont produites à partir d’alcools, de composés carbonylés, de nitriles, d’halogénures d’alkyle, de composés nitrés et d’oléfines.
Table des matières
1. Production d’amines à partir d’alcools
La technique la plus répandue pour synthétiser des alkylamines inférieures implique la réaction entre un alcool approprié et de l’ammoniac en utilisant un catalyseur approprié. Cette réaction donne un mélange d’amines primaires, secondaires et tertiaires en raison de la capacité de l’amine primaire initialement formée à réagir davantage avec une ou deux molécules d’alcool.
Alors que la conversion de l’alcool en amine primaire présente des caractéristiques thermoneutres, la formation d’amines secondaires et tertiaires est exothermique, favorisant la thermodynamique. De plus, l’amine primaire présente une réactivité plus élevée que l’ammoniac en raison de sa plus grande nature nucléophile.
La distribution des produits peut être partiellement contrôlée en ajustant les conditions de réaction telles que la température, l’excès d’ammoniac et le temps de séjour. Comme le mélange d’amines obtenu ne répond souvent pas aux exigences du marché, les amines non commercialisables peuvent être recyclées, augmentant ainsi le rendement de l’amine souhaitée à plus de 90 %.
RCH2OH + NH3 ↔ RCH2NH2 + H2O
RCH2NH2 + RCH2OH ↔ (RCH2)2NH + H2O
(RCH2)2NH + RCH2OH ↔ (RCH2)3N + H2O
Auparavant, cette réaction était menée à l’aide de catalyseurs de déshydratation purs tels que l’alumine, la silice, l’oxyde de titane, l’oxyde de thorium, l’oxyde de tungstène, les oxydes de chrome, les phosphates ou divers oxydes mixtes (par exemple, la silice-alumine, les argiles, les zéolithes) à des températures allant jusqu’à 500 °C. . Cependant, l’utilisation de ces catalyseurs est maintenant limitée à la production de méthylamine.
Pour la conversion d’alcools contenant deux atomes de carbone ou plus, les catalyseurs ayant des propriétés d’hydrogénation et de déshydrogénation ont pris de l’importance. Des catalyseurs à base de nickel, de cobalt, de cuivre, de fer, de platine ou de palladium sont principalement utilisés, les catalyseurs de métaux nobles ayant tendance à provoquer un clivage de la liaison C-C ou C-N, conduisant à des sélectivités plus faibles. Des promoteurs tels que Ag, Zn, In, Mn, Mo et des métaux alcalins sont ajoutés pour améliorer les performances du catalyseur.
Généralement, les composants actifs sont supportés sur des supports tels que Al2O3, SiO2 ou ZrO2. Les zéolithes ont été proposées comme supports pour améliorer la sélectivité vis-à-vis des amines primaires. Dans ce procédé continu, l’alcool, l’ammoniac et l’hydrogène passent sur le catalyseur dans un réacteur à lit fixe. La réaction se produit à des pressions d’environ 0,5 à 25 MPa et à des températures d’environ 100 à 250 °C, selon le catalyseur et le choix entre les procédés en phase liquide et en phase gazeuse.
L’étape initiale et déterminante de la vitesse est la déshydrogénation de l’alcool pour former le composé carbonyle. L’ajout ultérieur d’ammoniac entraîne une perte d’eau et la formation d’une imine ou d’une énamine, qui est ensuite hydrogénée pour donner l’amine finale.
Les réactions secondaires comprennent la dismutation des amines, en particulier à des températures de réaction plus élevées, et dans des cas moins fréquents , la condensation aldolique d’aldéhydes intermédiaires, la formation de base de Schiff entre ces aldéhydes et le produit aminé, et la formation de nitrile à des températures élevées et de faibles pressions d’hydrogène.
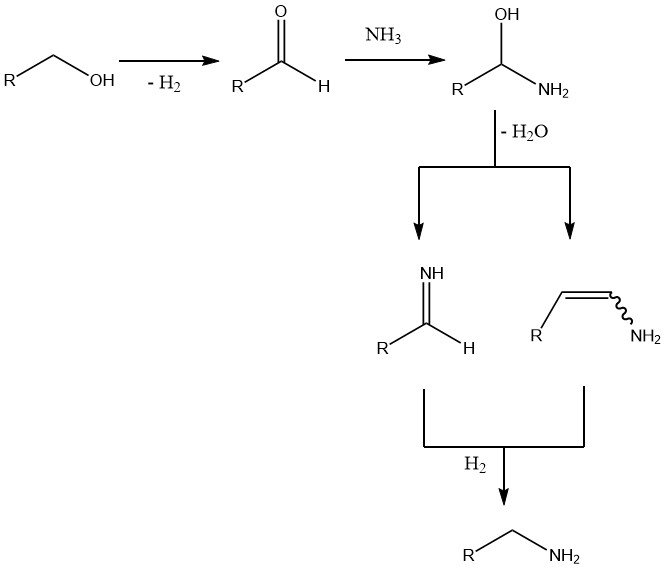
Un excès de deux à huit fois la quantité d’ammoniac est utilisé pour déplacer l’équilibre vers les amines primaires. Bien que l’hydrogène n’intervienne pas directement dans la réaction, son absence entraîne la formation d’imines, d’énamines et même de nitriles.
De plus, l’hydrogène aide à maintenir l’activité du catalyseur en éliminant les dépôts carbonés et les carbures ou nitrures métalliques, ainsi qu’en empêchant la dismutation des produits aminés.
L’amination des diols et des polyols suit des principes similaires à ceux des monoalcools, bien que l’apparition de réactions secondaires telles que les cyclisations complique le processus.
La même méthodologie peut être utilisée pour alkyler des amines primaires ou secondaires au lieu de l’ammoniac. Lorsqu’une amine et un alcool avec différents substituants aliphatiques réagissent, une amine aliphatique mixte est produite. Par exemple, la N,N-diméthyléthylamine peut être synthétisée à partir de diméthylamine et d’éthanol.
Pour éviter la transalkylation au niveau de l’atome d’azote lors de telles réactions, des catalyseurs au cuivre sont recommandés. Le chromite de cuivre, en particulier, est un catalyseur efficace pour les amines tertiaires à longue chaîne comme la diméthyldodécylamine.
2. Production d’amines à partir de composés carbonylés
Si c’est plus rentable, les aldéhydes et les cétones sont préférés aux alcools pour la synthèse des amines. Cependant, cela est généralement limité aux aldéhydes inférieurs obtenus à partir de la synthèse oxo et à l’acétone produite comme sous-produit de la production de phénol (synthèse de Hock).
La réaction entre un composé carbonylé et l’ammoniac ou une amine se déroule en deux étapes. Initialement, une imine ou une base de Schiff est formée, qui est ensuite hydrogénée avec de l’hydrogène dans une deuxième étape pour donner l’amine. La procédure typique est similaire à la conversion d’alcool, où le mélange réactionnel contenant le composé carbonyle, l’ammoniac et l’hydrogène est passé sur un catalyseur à lit fixe.
Dans certains cas, il peut être avantageux d’effectuer la réaction en deux étapes. Le composé carbonyle et l’ammoniac ou l’amine réagissent en premier, l’eau résultante est éliminée, puis l’étape d’hydrogénation est effectuée.
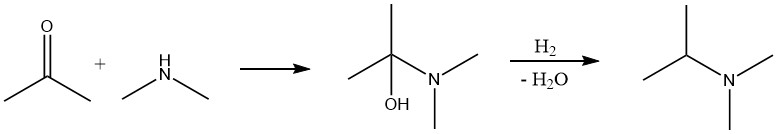
La principale différence entre l’amination d’un aldéhyde ou d’une cétone et d’un alcool est que l’hydrogène agit comme un réactif et est consommé en quantité stoechiométrique dans le premier cas.
En raison de la chaleur de réaction considérablement plus élevée dans ce procédé (par exemple, 60,4 kJ/mol pour l’acétone par rapport à 7,1 kJ/mol pour l’alcool isopropylique), une conception de réacteur différente est nécessaire.
Typiquement, le procédé est conduit en phase vapeur à des températures de 100 à 160 °C et à la pression atmosphérique ou légèrement supérieure. Des procédés à haute pression peuvent également être utilisés si la chaleur de réaction est efficacement éliminée, par exemple grâce à un taux de recyclage élevé ou à l’aide d’un réacteur multitubulaire.
Des températures de réaction plus basses par rapport aux réactions alcooliques permettent généralement des sélectivités plus élevées en principe.
En général, les mêmes catalyseurs utilisés pour l’amination hydrogénante des alcools peuvent être utilisés. Le contrôle de la distribution du produit en ajustant l’excès d’ammoniac et le traitement basé sur la distillation sont également similaires. Des revues détaillées discutant des possibilités industrielles et préparatives pour synthétiser des amines à partir de composés carbonylés sont disponibles.
Bien que des agents réducteurs alternatifs puissent être utilisés à la place de l’hydrogène, leur importance industrielle est limitée en raison des difficultés de manipulation et de leur coût (par exemple, sélénophénol ou NaBH4).
La réaction de Leuckart-Wallach, qui utilise du formiate d’ammonium pour aminer le composé carbonyle avec la génération de CO2 comme sous-produit, a trouvé une certaine application.
3. Production d’amines à partir de nitriles
Dans de nombreux cas, les nitriles sont plus rentables à obtenir que leurs alcools ou composés carbonylés correspondants. Il existe plusieurs méthodes pour synthétiser les nitriles, y compris l’ammoxydation, l’addition d’une amine ou d’un alcool à l’acrylonitrile, ou la conversion à partir de l’acide carboxylique correspondant.
Pour convertir les nitriles en amines correspondantes, l’hydrogénation catalytique est préférée. Des catalyseurs de métaux nobles tels que le palladium, le platine et le rhodium, ainsi que des catalyseurs de nickel, de cobalt et de plus en plus de fer, sont couramment utilisés.
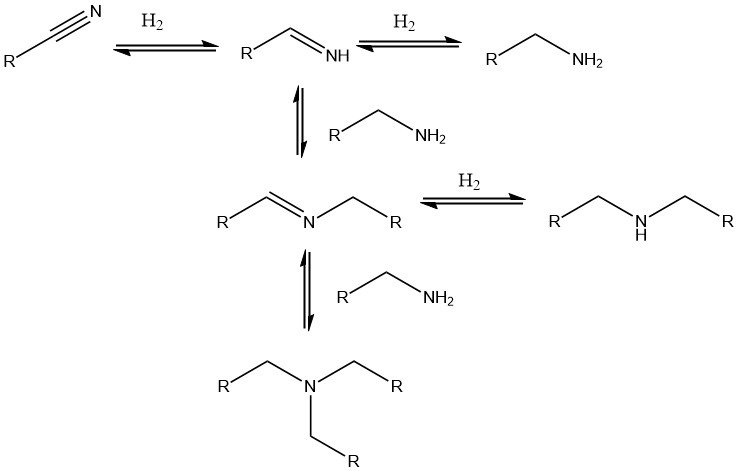
Les catalyseurs de métaux nobles supportés permettent des conditions de réaction plus douces (20-100 °C, 0,1-0,5 MPa), tandis que les catalyseurs au nickel ou au cobalt nécessitent des pressions plus élevées allant jusqu’à 25 MPa et des températures allant jusqu’à 180 °C. Lorsque des di- ou polynitriles sont hydrogénés en di- ou polyamines, une base telle que NaOH est souvent ajoutée au catalyseur.
Il existe différentes variantes du procédé, mais les plus couramment utilisées sont le procédé discontinu avec un catalyseur en suspension et le procédé continu avec un catalyseur à lit fixe.
Les réactions secondaires conduisant à la formation d’amines secondaires sont inévitables, mais elles peuvent être supprimées en ajoutant de l’ammoniac, une solution d’hydroxyde de sodium ou un acide.
En variante, les conditions du procédé peuvent être ajustées pour donner la priorité à la formation d’amines secondaires ou tertiaires. Cette approche est utile, par exemple, dans la synthèse de di- et triéthylamine à partir d’acétonitrile ou de dibutylamine à partir de butyronitrile.
L’hydrogénation de l’acrylonitrile est un cas particulier. Alors que les amines saturées sont généralement les seuls produits de cette réaction, l’utilisation de chromite de cuivre comme catalyseur au lieu de métaux nobles, de nickel ou de cobalt conduit à la formation d’allylamine et de diallylamine.
De nombreuses hydrogénations importantes de nitrile pour produire les amines correspondantes sont basées sur des réactions d’addition précédentes impliquant de l’acrylonitrile. Les alcools ne peuvent s’ajouter à l’acrylonitrile qu’en présence d’un catalyseur basique comme NaOH, KOH ou des hydroxydes d’ammonium quaternaire.
Puisque les amines elles-mêmes sont suffisamment basiques, l’addition se produit facilement. Dans certains cas, des températures plus élevées peuvent être nécessaires pour la cyanoéthylation, et des stabilisants ont été décrits pour empêcher la polymérisation de l’acrylonitrile.
4. synthèse d’amines à partir d’halogénures d’alkyle
Lorsqu’un halogénure d’alkyle réagit avec l’ammoniac ou une amine, un halogénure d’alkylammonium se forme, qui peut être converti en amine par traitement avec une solution fortement alcaline. Bien que cette méthode soit couramment utilisée en chimie préparative, elle a une importance industrielle limitée, principalement utilisée pour la production d’éthylènediamine, de polyamines et de quelques amines spécialisées comme l’allylamine et certains produits pharmaceutiques avec de faibles volumes de production.
Les raisons de son utilisation limitée à l’échelle industrielle sont le coût élevé des matières premières, les défis liés à la corrosion et à la qualité du produit lors du traitement des halogénures, et la nécessité d’éliminer le sous-produit salin résultant.
5. Synthèse des amines à partir de composés nitrés
Bien que la réduction des composés nitrés soit une méthode vitale pour la synthèse des amines aromatiques, elle n’a pas acquis une importance significative dans la production d’amines aliphatiques. En raison de la disponibilité limitée de nitroalcanes appropriés, cette méthode n’est utilisée que dans des cas spécifiques, tels que la production de 2-amino-2-méthyl-1-propanol utilisé dans la formulation de solutions tampons, de revêtements en latex, de fluides de travail des métaux et de cosmétiques.
Le processus de réduction implique la formation d’un intermédiaire nitroso ou hydroxylamine et, dans certains cas, peut se produire à température ambiante, donnant des produits amines avec des rendements de 90% ou plus. Des catalyseurs d’hydrogénation tels que le platine, le palladium, le rhodium, le nickel ou le cuivre sont utilisés.
La réaction est hautement exothermique (environ 500 kJ/mol par groupe nitro), nécessitant une élimination efficace de la chaleur pour le contrôle du procédé. Les nitroparaffines posent de plus grands défis pour l’hydrogénation par rapport à leurs homologues aromatiques.
La fonctionnalisation d’alcènes à l’aide de NO ou de NO2 a été rapportée, procédant par un mécanisme radicalaire et aboutissant à un mélange de produits comprenant des nitroalcènes. Cependant, la réduction des nitroalcènes en amines n’a pas trouvé d’application industrielle jusqu’à présent.
De même, des amines primaires ont été obtenues à partir de paraffines par nitration avec HNO3 ou NO2 liquide, suivie d’une hydrogénation du mélange résultant de nitroparaffines et de cétones en présence d’ammoniac.
6. Production d’amines à partir d’oléfines
Les amines qui ont un groupe alkyle tertiaire à côté de l’atome d’azote, comme la tert-butylamine, sont difficiles à synthétiser à l’aide de méthodes conventionnelles. Cependant, ces composés peuvent être facilement préparés en ajoutant du cyanure d’hydrogène à un alcène, tel que le 2-méthylpropène, en milieu acide.
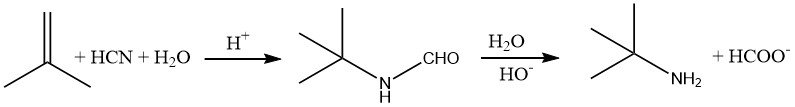
Cette réaction, connue sous le nom de réaction de Ritter, est généralement effectuée à des températures de 30 à 60 °C. L’intermédiaire formamide résultant est ensuite hydrolysé en chauffant le mélange réactionnel à environ 100 °C.
Pour isoler l’amine, le mélange acide est neutralisé, ce qui entraîne la formation de formiate de sodium et du sel de l’acide d’origine (par exemple, le sulfate de sodium).
En raison des difficultés liées à la manipulation de l’acide cyanhydrique, qui est corrosif et pose des problèmes de sécurité, un atome de carbone est perdu sous forme de formiate au cours de la réaction, et une quantité importante de sel (environ 3,3 kg/kg de tert-butylamine) doit être éliminée dans des puits profonds. De ce fait, ce procédé est limité à la synthèse d’amines qui ne peuvent être obtenues par d’autres méthodes.
Bien que l’addition directe d’ammoniac ou d’une amine sur une double liaison oléfinique soit thermodynamiquement favorable, elle est limitée à quelques cas particuliers impliquant des amines activées ou des composés à doubles liaisons activées. Un exemple est l’addition d’une amine à l’acrylonitrile.
Cependant, il est possible de réaliser l’addition d’ammoniac sur des alcènes non activés sous pression à l’aide de catalyseurs. Les zéolithes acides sont des catalyseurs particulièrement efficaces pour cette réaction. La première démonstration réussie a été la formation d’éthylamine à partir d’éthylène et d’ammoniac à l’aide de H-mordénite.
Bien que la conversion dans l’amination directe des alcènes soit généralement faible en raison des limitations cinétiques et thermodynamiques, la sélectivité pour les monoalkylamines peut être excellente avec le choix approprié de la zéolite et de l’alcène. Les zéolithes à petits pores sont bien adaptées à la production d’éthylamines, tandis que les zéolithes à pores moyens peuvent être utilisées pour la synthèse de tert-butylamine. Certaines zéolithes à gros pores ont montré des améliorations par rapport aux zéolithes à pores moyens.
Des sélectivités élevées (>95%) avec des conversions acceptables (10-15%) ont été obtenues dans l’amination de l’isobutène sur des zéolites RE-Y et des zéolites de type pentasil substituées par Al, Fe ou B à des températures de 250- 300 °C et des pressions autour de 30 MPa. Ces zéolithes présentent une excellente stabilité à long terme par rapport aux zéolithes X et Y.
L’amination d’alcènes catalysée de manière homogène est limitée à des cas spécifiques. Bien que peu sélective, l’hydroformylation d’alcènes en présence d’ammoniac ou d’amines présente un potentiel pour de futures applications.
Cependant, cette méthode est actuellement confrontée à des défis, car des quantités importantes d’alcools et de produits de dimérisation sont formés en plus des amines souhaitées dérivées du n-aldéhyde et de l’isoaldéhyde.
7. Autres processus
L’hydrogénation des amines aromatiques en cycloalkylamines est principalement limitée à la production de cyclohexylamine à l’échelle industrielle. D’autres cycloalkylamines ne sont pas couramment synthétisées par cette méthode au niveau industriel.
Un procédé de synthèse d’amines à partir de monoxyde de carbone, d’hydrogène et d’ammoniac ou d’amines à l’aide d’un catalyseur au fer activé basé sur la réaction de type Fischer-Tropsch était decrit. Cependant, cette méthode est peu utilisée à l’échelle industrielle.
La réduction des amides et autres voies de synthèse évoquées dans la littérature, bien qu’existantes, sont principalement des méthodes de laboratoire adaptées aux préparations à petite échelle. Ces méthodes sont rarement utilisées au niveau industriel, avec seulement des cas isolés où elles sont mises en œuvre.
Références
- Amines, Aliphatic; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a02_001.pub2
