Hydroquinone: production, réactions et utilisations
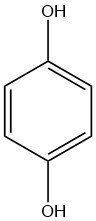
L’hydroquinone a été décrite pour la première fois en 1844 par WOEHLER, c’est un solide cristallin incolore lorsqu’il est pur et a été obtenu par addition d’hydrogène à la 1,4-benzoquinone.
L’hydroquinone est naturellement présente sous forme d’hydroquinone b-D-glucopyranoside (arbutine) dans les feuilles de plusieurs plantes, notamment la busserole, la canneberge, l’airelle rouge et certaines variétés de poire, généralement accompagnée de son éther méthylique, la méthylarbutine.
L’arbutine est facilement hydrolysée en hydroquinone et en glucose dans un acide aqueux chaud et dilué; l’hydrolyse de la méthylarbutine produit de l’éther monométhylique d’hydroquinone et du glucose.
Table des matières
1. Production d’hydroquinone
Trois procédés sont utilisés pour la production industrielle d’hydroquinone : l’hydroperoxydation du p-diisopropylbenzène, l’hydroxylation du phénol et l’oxydation de l’aniline.
1.1. Hydroperoxydation du p-diisopropylbenzène
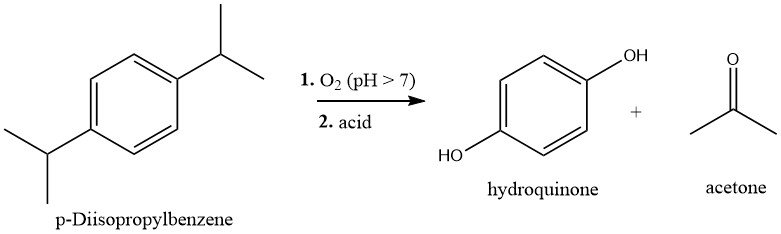
Le p-diisopropylbenzène (p-DIPB) est produit par alkylation Friedel-Crafts du benzène avec du propène. Le p-DIPB purifié est ensuite converti en dihydroperoxyde (DHP) par oxydation à l’air dans des conditions légèrement alcalines à 80 – 90°C.
Le DHP est séparé du mélange réactionnel soit par extraction, soit par cristallisation, puis est clivé en hydroquinone et acétone par un réarrangement de Hock catalysé par un acide; la solution DHP est traitée avec un catalyseur d’acide sulfurique (0,2 – 1,0 %) à 60 – 80 °C.
L’hydroquinone est cristallisée et isolée. Le rendement global en hydroquinone (basé sur le p-DIPB) est d’env. 80 %.
1.2. Hydroxylation du Phénol
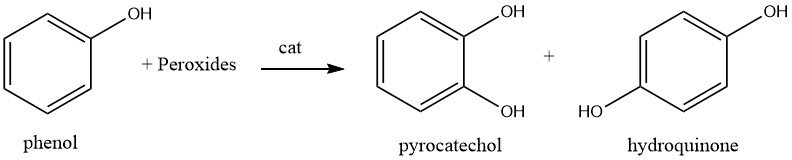
L’hydroxylation catalysée du phénol à env. 80 °C avec du peroxyde d’hydrogène aqueux à 70 % produit un mélange d’hydroquinone et de catéchol.
Le catalyseur peut être un acide minéral fort, le fer(II) ou un sel de cobalt(II).
Selon le choix du catalyseur, le rapport du catéchol à l’hydroquinone peut varier de 3 : 1 à 0,1 : 1 ; en pratique, le rapport est typiquement de 1,5 : 1, c’est-à-dire que le catéchol est le produit principal.
La réaction se déroule par un mécanisme ionique dans lequel le peroxyde d’hydrogène est polarisé par le catalyseur acide fort et le phénol est ensuite hydroxylé.
Les isomères résultants sont séparés par une série d’extractions et d’opérations d’élimination du solvant.
Le rapport des produits hydroquinone et catéchol peut être influencé par la présence de superacides ou de zéolithes à sélection de forme.
Ainsi, l’utilisation d’un polymère perfluorosulfonate Nafion modifié au vanadium pour l’oxydation du phénol a donné un rapport hydroquinone-catéchol de 12, 5 : 1.
L’utilisation d’une zéolite à sélection de forme dans l’hydroxylation du phénol a donné de l’hydroquinone avec une sélectivité de 99 %.
1.3. Oxydation de l’aniline
L’oxydation de l’aniline est le procédé le plus ancien utilisé pour la production d’hydroquinone.
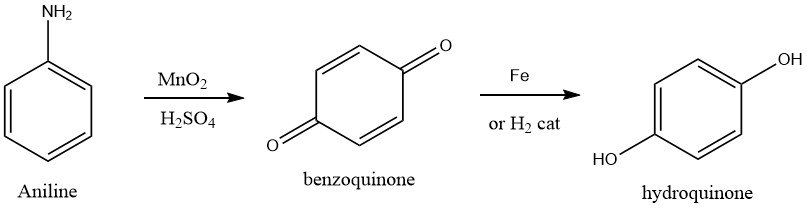
L’aniline est oxydée avec du dioxyde de manganèse (excès de 15 à 20 %) dans de l’acide sulfurique aqueux à 0 à 5 °C pour produire de la p-benzoquinone.
Cet intermédiaire est éliminé du mélange réactionnel par entraînement à la vapeur et recueilli.
Un sous-produit, le sulfate de manganèse, peut être extrait du mélange réactionnel appauvri et vendu pour des applications agricoles.
L’hydroquinone est obtenue à partir de l’intermédiaire p-benzoquinone par réduction avec du fer à 55 – 65 °C ou par hydrogénation catalytique.
Le produit (généralement de qualité technique) est cristallisé, isolé du flux généralement aqueux par centrifugation et séché dans un sécheur sous vide.
Le rendement global en hydroquinone à partir d’aniline est d’env. 85 %.
L’oxydation de l’aniline est un processus discontinu et, par conséquent, demande relativement beaucoup de main-d’œuvre.
L’utilisation de minerai de manganèse broyé et de fer finement divisé conduit à des conditions de traitement extrêmement abrasives ; beaucoup d’entretien est généralement nécessaire.
L’élimination des coproduits inorganiques (représentant environ 85 % du poids total des produits) est préoccupante pour l’environnement.
1.4. Autres processus
Les esters carboxylates de diols aromatiques peuvent être préparés par oxydation Baeyer – Villiger d’une cétone aromatique 4-hydroxy-substituée avec une conversion de 97% et une efficacité de 97%.
L’oxydation microbiologique du benzène ou du phénol produit de l’hydroquinone avec une sélectivité très élevée.
L’oxydation à l’air catalysée par le cuivre du phénol fournit de la p-benzoquinone avec une sélectivité supérieure à 90 %. Le benzène a été oxydé en hydroquinone en présence de chlorure de cuivre (I) ou de titane.
L’oxydation du benzène en solution aqueuse avec de l’ozone donne la p-benzoquinone et l’hydroquinone.
D’autres procédés de préparation comprennent la réaction du p-isopropénylphénol avec du peroxyde d’hydrogène aqueux à 30 % dans des conditions acides ; Le p-isopropénylphénol peut être obtenu à partir du bisphénol A par craquage alcalin.
L’hydroquinone peut également être produite par la carbonylation de l’acétylène; hydrogénation catalytique du nitrobenzène en solution acide ; l’hydrolyse acide du nitrobenzène ou du p-nitrosophénol ; et oxydation électrochimique du benzène ou du phénol dans de l’acide sulfurique dilué, suivie d’une réduction.
2. Réactions chimiques de l’hydroquinone
L’hydroquinone est facilement convertie par la plupart des agents oxydants en p-benzoquinone; même les solutions aqueuses neutres d’hydroquinone noircissent lorsqu’elles sont exposées à l’air.
La vitesse d’oxydation de l’hydroquinone par l’air est accélérée en solution alcaline. Le produit d’oxydation peut ajouter de l’eau pour donner du 1,2,4-benzènetriol ; une oxydation ultérieure peut entraîner la formation d’acides humiques.
Le potentiel redox E0 de l’hydroquinone est de 699 mV ; le potentiel demi-onde E1 / 2 est de 560 mV à pH 0 et de 234 mV à pH 5 – 6. L’oxydation de l’hydroquinone implique la perte d’un électron et l’élimination d’un proton pour donner le radical semibenzoquinone relativement stable.
La capacité de l’hydroquinone à agir comme antioxydant est une conséquence de la formation et de la stabilité de ce radical.
Un deuxième transfert d’un électron et une élimination de protons entraînent la formation de p-benzoquinone. L’hydroquinone et la p-benzoquinone forment le complexe équimolaire de transfert de charge quinhydrone. Le complexe quinhydrone est typiquement noir verdâtre foncé, PF 171°C.
L’hydroquinone est un agent réducteur dont le potentiel de réduction est adapté à la réduction de l’halogénure d’argent. Les grains d’halogénure d’argent qui ont été exposés à la lumière sont réduits beaucoup plus rapidement que les grains non exposés ou sous-exposés.
Cette propriété est à la base de l’utilisation de l’hydroquinone comme révélateur en photographie. La sélectivité est le résultat de changements dans les cristaux d’halogénure d’argent exposés, qui réduisent la barrière énergétique pour la réaction avec l’hydroquinone pour former de l’argent élémentaire et de la p-benzoquinone.
Du sulfite de sodium est ajouté à la solution de développement pour empêcher la formation de quinhydrone en convertissant la p-benzoquinone en 2,5-dihydroxybenzènesulfonate de sodium, un agent de développement plus faible que l’hydroquinone.
La réactivité de l’hydroquinone est généralement similaire à celle du phénol. Un ou les deux groupes hydroxyle peuvent être convertis en un éther ou un ester. Les dérivés d’oxygène commercialement importants comprennent l’éther monométhylique d’hydroquinone, l’éther diméthylique d’hydroquinone et l’éther bis(2-hydroxyéthyl) d’hydroquinone.
Les esters d’hydroquinone subissent le réarrangement de Fries pour donner des hydroquinones à substitution acyle.
L’hydroquinone et ses éthers peuvent être C-alkylés dans des conditions Friedel – Crafts pour produire une variété de produits mono- et disubstitués. Parmi les dérivés alkylés commercialement importants figurent la 2-tert-butylhydroquinone, la 2,5-bis[2-(2-méthylbutyl)]hydroquinone et le 2-tert-butyl-4-méthoxyphénol (BHA).
L’hydroquinone réagit avec les alkylamines ou les arylamines pour former des arylamines substituées. Les produits commercialement importants comprennent le p-N-méthylaminophénol, généralement commercialisé sous forme de sel de sulfate, et la N,N’-diphényl-p-phénylènediamine.
L’hydroquinone peut être chlorée avec du chlore ou du chlorure de sulfuryle pour fournir des dérivés allant de mono- à tétrachloré.
La carboxylation de Kolbe – Schmitt de l’hydroquinone avec du dioxyde de carbone conduit à l’acide 2,5-dihydroxybenzoïque (acide gentisique).
La quinizarine (1,4-dihydroxyanthraquinone) peut être préparée par condensation d’hydroquinone avec de l’anhydride phtalique.
L’hydrogénation catalytique de l’hydroquinone donne le 1,4-cyclohexanediol.
La sulfonation de l’hydroquinone entraîne la formation d’acide mono- ou disulfonique d’hydroquinone, généralement isolé sous forme de sel de potassium correspondant.
3. Utilisations de l’hydroquinone
L’hydroquinone et ses dérivés sont utilisés dans les applications photographiques, l’industrie du caoutchouc, les inhibiteurs de monomères, les colorants et pigments, les antioxydants, les produits chimiques agricoles et d’autres applications diverses et spéciales.
La plus grande demande d’hydroquinone est en tant que révélateur photographique, principalement pour les films noir et blanc, la lithographie, l’usinage photochimique, les microfilms et les films radiographiques.
De nombreux dérivés de l’hydroquinone sont utilisés dans les applications photographiques, par exemple le sulfate de p-N-méthylaminophénol et le 2,5-dihydroxybenzènesulfonate de potassium.
Le deuxième consommateur d’hydroquinone est l’industrie du caoutchouc, qui a besoin d’hydroquinone pour la production d’antioxydants et d’antiozonants. Les dérivés d’hydroquinone utilisés dans ce domaine comprennent les N,N’-diaryl-p-phénylènediamines (par exemple, N,N’-diphényl-p-phénylènediamine), les hydroquinones dialkylées, les N-alkyl-p-aminophénols, les dialkyl-p-phénylènediamines et les aralkyl-p-phénylènediamines.
L’hydroquinone, l’éther monométhylique d’hydroquinone et la p-benzoquinone sont largement utilisés dans l’industrie des monomères vinyliques pour inhiber la polymérisation radicalaire pendant le traitement et le stockage.
L’hydroquinone, la p-benzoquinone, la 2-méthylhydroquinone (toluhydroquinone), la 2-tert-butylhydroquinone et la 2,5-di-tert-butylhydroquinone sont utilisées comme stabilisants pour les résines de polyester insaturé.
Les antioxydants de qualité alimentaire comprennent la 2-tert-butylhydroquinone et le 2-tert-butyl-4-méthoxyphénol.
L’éther diméthylique d’hydroquinone est utilisé comme matière première pour une famille de colorants et de pigments basés sur les dérivés 2-amino- et 2-amino-5-chloro.
La quinizarine est un intermédiaire pour les colorants textiles. Le fongicide Chloroneb est produit à partir de matière première.
L’herbicide éthofumesate est produit à partir de p-benzoquinone. Le fluazifop-butyl est représentatif d’une nouvelle famille d’herbicides basés sur l’o-alkylation de l’hydroquinone avec des dérivés d’acide 2-halo propionique.
L’éther bis(2-hydroxyéthyl) d’hydroquinone, produit de la réaction de l’hydroquinone avec l’oxyde d’éthylène, est utilisé comme allongeur de chaîne dans les polymères d’uréthane thermodurcissables.
L’hydroquinone (qualité U.S.P.) et plusieurs dérivés sont utilisés dans des formulations topiques comme agents de blanchiment et de dépigmentation de la peau.
Plusieurs nouvelles applications de l’hydroquinone et de ses dérivés voient le jour. Les propriétés de désoxygénation de l’hydroquinone sont exploitées pour être utilisées dans le traitement de l’eau de chaudière.
L’hydroquinone et certains dérivés C-alkylés ou carylés sont des monomères utiles pour la préparation d’une variété de polymères, y compris les polyesters à cristaux liquides pour les plastiques, composites et fibres hautes performances. En plus de résistances élevées à la traction et aux chocs, ces matériaux présentent une bonne résistance aux intempéries, une résistance aux solvants, un retardateur de flamme, une transparence au rayonnement micro-ondes et une rétention de résistance à température élevée.
Les références
- Hydroquinone; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a13_499
