Dioxane : propriétés, réactions, production et utilisations
Le dioxane, ou 1,4-dioxane, est un diéther hétérocyclique de formule C4H8O2. C’est un liquide incolore et inflammable avec une légère odeur sucrée semblable à celle de l’éther diéthylique. Il est connu sous d’autres noms tels que p-dioxane, oxyde de diéthylène, dioxyde de diéthylène, éther de diéthylène, 1,4-dioxacyclohexane, éther de dioxyéthylène et dioxane.
Le dioxane a été produit pour la première fois par A. V. Lourenço en 1863 en faisant réagir de l’éthylène glycol avec du 1,2-dibromoéthane. Cependant, la production commerciale n’a eu lieu qu’en 1929.
Table of Contents
1. Propriétés physiques du dioxane
Le dioxane est un bon solvant aux propriétés exceptionnelles. Il dissout facilement une large gamme de composés organiques, notamment les hydrocarbures aliphatiques et aromatiques, les éthers, les alcools, les cétones et les hydrocarbures chlorés, en particulier ceux ayant un poids moléculaire inférieur.
Le 1,4-dioxane est miscible à l’eau en toutes proportions et dissout également divers composés et éléments inorganiques, notamment les chlorures de fer, le chlorure mercurique, les acides minéraux (chlorhydrique, sulfurique et phosphorique), les halogènes (brome, chlore et iode), les huiles animaux et végétales, les huiles de paraffine et les résines synthétiques et naturelles.
À température ambiante, le 1,4-dioxane se présente sous la forme d’un liquide clair à l’odeur éthérée. Sa stabilité chimique est comparable à celle des autres éthers aliphatiques. Semblable à ces éthers, le dioxane forme des peroxydes lorsqu’il est exposé à l’air.
Les propriétés physiques les plus importantes du dioxane sont répertoriées dans le tableau 1.
| Propriété | Valeur |
|---|---|
| Poids moléculaire | 88,11 g/mol |
| Point d'ébullition | 101,3 °C |
| Point de congélation | 11,8 °C |
| Densité | 1,0356 g/cm3 |
| Chaleur latente d'évaporation | 413 kJ/kg |
| Chaleur de fusion | 141 kJ/kg |
| Chaleur spécifique (20 °C) | 1,76 kJ kg-1 K-1 |
| Indice de réfraction | 1.4224 |
| Pression de vapeur (20 °C) | 4,13 kPa (41,3 mbar) |
| Constante diélectrique (20 °C) | 2.23 |
| Tension superficielle (20 °C) | 36,9 mN/m |
| Température critique | 312 °C |
| Pression critique | 5,14 MPa |
| Point d'éclair (coupelle fermée) | 11 °C |
| Limites d'inflammabilité (dans l'air) |
Inférieur : 2 % en volume Supérieur : 22 vol % |
| Chaleur de combustion | 27 600 kJ/kg |
| Température d'auto-inflammation | 180 °C |
Le dioxane forme des mélanges azéotropiques avec de nombreux solvants. Des exemples courants sont donnés dans le tableau 2.
| Composant | Composante pb, °C | Dioxane, % en poids | Pb azéotropique, °C |
|---|---|---|---|
| Acide formique | 100,7 | 57 | 113.35 |
| Nitrométhane | 100,8 | 43,5 | 100,55 |
| Acide acétique | 117,9 | 20,5 – 23 | 119,4 |
| Éthanol | 78,5 | 9.3 | 78.1 |
| 3-Iodo-1-propène | 103 | 44 | 98,5 |
| 1-Propanol | 97,4 | 45 | 95,3 |
| alcool tert-amylique | 102,5* | 20 | 100,65 |
| Cyclohexane | 80,7 | 24.6 | 79,5 |
| Heptane | 98,4 | 44 | 91,85 |
| Eau | 100 | 82 | 87,8 |
| * À 8 kPa | |||
2. Réactions chimiques du dioxane
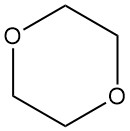
Semblable à d’autres éthers, le dioxane forme facilement des peroxydes lorsqu’il est exposé à l’air. Ces peroxydes sont souvent hautement explosifs et instables. Le peroxyde primaire formé est le 2-hydroperoxy-1,4-dioxane (1), qui se décompose pour donner de la dioxanone (2) et de l’eau.
L’hydrolyse ultérieure conduit à la formation d’acide 2-(2-hydroxyéthoxy)acétique (3). Heureusement, le cheminement réactionnel favorise la formation du produit final, limitant la concentration en peroxyde.
Malgré cela, la manipulation du dioxane nécessite les mêmes précautions que celles des autres éthers pour éviter la formation de peroxyde. Le barbotage de gaz inerte, généralement avec de l’azote, est une pratique recommandée. De plus, les peroxydes ne doivent jamais être concentrés ou distillés à sec.
Les méthodes établies pour leur élimination impliquent des agents réducteurs tels que les chlorures de fer (II) ou d’étain (II), le bisulfite de sodium ou des matériaux adsorbants tels que le charbon actif, l’alumine ou les résines échangeuses d’anions.
Le 1,4-dioxane est capable de se dissoudre et de former des complexes avec divers halogènes (Cl2, Br2, et I2) et acides halogènes. Ces complexes peuvent modérer la réactivité des halogènes ou des acides halogènes lors des réactions. A titre d’exemple, le complexe dibromure de dioxane peut être utilisé pour la bromation contrôlée de phénols, d’aldéhydes/amines aromatiques et de cétones.
La chloration du dioxane peut donner des dérivés chlorés contenant de 1 à 8 atomes de chlore. La distribution spécifique des isomères dépend des conditions de réaction (température, catalyseurs) utilisées.
Les dioxanes contenant moins d’atomes de chlore sont utilisés comme précurseurs de composés d’addition, tels que les groupes éthoxy ou éthyle, en utilisant des réactifs appropriés comme NaOCH2CH3 ou CH3CH2MgBr, respectivement.
Le 2,3-dichloro-1,4-dioxane est très réactif et se condense facilement avec d’autres groupes fonctionnels comme les acides carboxyliques, les alcools et les glycols pour former les diesters et éthers correspondants.
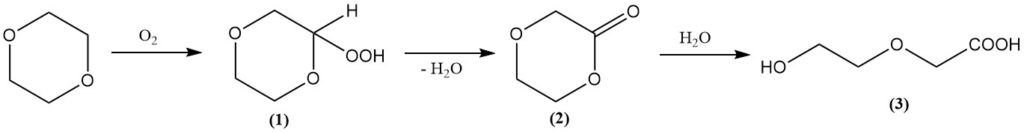
Bien que le cycle dioxane soit stable, des acides forts soumis à une température et une pression élevées peuvent le cliver. Dans de telles conditions, les réactions avec l’anhydride acétique donnent du diacétate d’éthylène glycol et du diacétate de diéthylène glycol.
Le dioxane peut être décomposé par le peroxyde d’hydrogène à 25 °C en utilisant FeSO4 comme catalyseur.
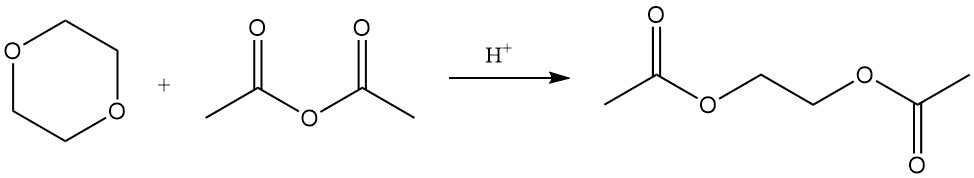
Les réactions catalysées par l’acide de Lewis du 1,4-dioxane avec le chlorure de benzoyle ou le chlorure d’acétyle produisent respectivement les esters 2-chloroéthyle de l’acide benzoïque et de l’acide acétique.
En utilisant le peroxyde de benzoyle comme catalyseur, le dioxane réagit avec les α-oléfines à une température de 80 à 140 °C pendant 5 à 10 h pour produire une variété de polymères utilisés comme lubrifiants.
Des réactions similaires peuvent se produire avec le tétrafluoroéthylène, où des réactions catalysées par le peroxyde à des températures et des pressions élevées donnent des polymères analogues.
De nombreux catalyseurs alternatifs ont été rapportés pour ces polymérisations, notamment les peroxydes (organiques et inorganiques), les bases (borax, phosphate disodique, hydrazine) et les acides de Lewis (chlorure de zinc, acide phosphorique).
Outre les halogènes, le 1,4-dioxane forme des complexes avec divers groupes fonctionnels, tels que AlBr3, AlCl3, AuCl3, BBr3, BCl3, BF3, CuCl2, CoCl2, FeCl3, HgCl2, LiBr, LiCl, LiI, ZnCl2, PtCl4, HCl, H2SO4, H3PO4, SO2, SO3 et trinitrophénol.
Ces complexes sont utilisés comme catalyseurs, agents modérateurs dans des réactions telles que la bromation ou la sulfonation, ou comme milieux réactionnels pour les systèmes acides anhydres.
3. Production de dioxane
Le dioxane est principalement produit par un processus en boucle fermée impliquant la déshydratation et la fermeture ultérieure du cycle du diéthylèneglycol. L’acide sulfurique concentré (environ 5 %) est utilisé comme catalyseur de cette réaction. Cependant, d’autres catalyseurs comme l’acide phosphorique, l’acide p-toluènesulfonique et des résines échangeuses d’ions fortement acides peuvent également être utilisés.
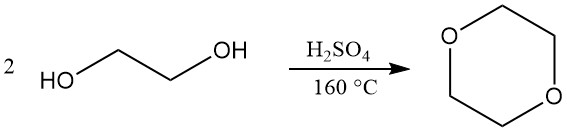
Les conditions opératoires de ce procédé peuvent varier. Les températures de réaction varient généralement de 130 à 200 °C, tandis que la pression peut varier légèrement au-dessus de la pression atmosphérique jusqu’à un vide partiel (25 à 110 kPa). Une température de réaction de 160 °C est souvent considérée comme optimale.
La configuration de réaction permet une production continue, le dioxane formé étant vaporisé directement à partir du récipient de réaction. Ces vapeurs passent ensuite à travers un piège à acide et une série de colonnes de distillation pour éliminer l’eau et purifier le produit final. Des rendements d’environ 90 % sont réalisables.
Il est important de noter que ce processus génère des sous-produits indésirables tels que le 2-méthyl-1,3-dioxolane, acétaldéhyde, crotonaldéhyde et polyglycol.
Bien que la déshydratation du diéthylèneglycol soit la voie commerciale dominante, d’autres méthodes existent pour synthétiser le 1,4-dioxane. Ces méthodes moins courantes incluent :
- Déshydrohalogénation du 2-chloro-2′-hydroxyéthyléther
- Réaction de l’éthylène glycol avec le 1,2-dibromoéthane
- Dimérisation de l’oxyde d’éthylène à l’aide de catalyseurs tels que NaHSO4, SiF4 ou BF3, ou par des réactions à haute température avec des résines échangeuses de cations acides
4. Utilisations du Dioxane
L’application industrielle la plus importante du 1,4-dioxane est la stabilisation du 1,1,1-trichloroéthane contre une réaction avec l’aluminium. Un film d’oxyde d’aluminium se forme sur la surface métallique, empêchant tout contact direct avec le 1,1,1-trichloroéthane.
Cependant, lorsque cette couche protectrice est perturbée, le 1,1,1-trichloroéthane réagit avec l’aluminium exposé, extrayant le chlore et formant le chlorure d’aluminium, qui favorise ensuite la déshydrohalogénation du 1,1,1-trichloroéthane pour produire de l’acide chlorhydrique et du chlorure de vinylidène.
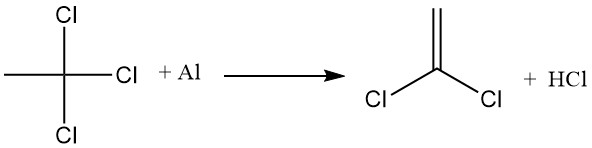
Le 1,4-dioxane inhibe ces réactions en formant un complexe insoluble entre le dioxane et le chlorure d’aluminium. Ce complexe désactive le catalyseur AlCl3 et scelle toutes les ouvertures du film d’oxyde d’aluminium, empêchant ainsi le contact direct entre le métal et le 1,1,1-trichloroéthane.
Le dioxane est utilisé comme agent mouillant et dispersant dans le traitement des textiles, les bains de teinture, les teintures et les compositions d’impression. De plus, il facilite la préparation de lames histologiques.
Le dioxane est utilisé dans d’autres secteurs, notamment :
- Solvants : Il est utilisé comme solvant dans la formulation d’encres, de revêtements, d’adhésifs, de compteurs à scintillation et pour l’extraction d’huiles animales et végétales.
- Intermédiaire chimique : les produits dérivés du dioxane sont précieux comme insecticides, herbicides, plastifiants et monomères.
- Catalyse et réactifs : les complexes d’oxonium formés par le dioxane avec des sels, des acides minéraux, des halogènes et du trioxyde de soufre fonctionnent comme catalyseurs et réactifs dans les réactions acides anhydres, les bromations et les sulfonations.
- Applications en laboratoire : Dans les laboratoires, le 1,4-dioxane est utilisé comme solvant cryoscopique pour déterminer les masses moléculaires, et sa stabilité en fait un milieu réactionnel approprié pour diverses transformations chimiques.
- Traditionnellement, le dioxane était utilisé dans la fabrication de polymères et comme solvant pour les résines naturelles et synthétiques, notamment les dérivés de cellulose, les résines polyvinylacétal et les copolymères acrylonitrile-méthylvinylpyridine.
5. Toxicologie du dioxane
Le dioxane a une toxicité aiguë relativement faible. Les valeurs DL50 orales et cutanées chez le rat et le lapin, respectivement, sont de 5 170 mg/kg et 7 600 mg/kg. L’exposition par inhalation pendant 4 heures à 14 260 ppm (51 880 mg/m³) est mortelle pour 50 % de la population de rats exposée (CL50).
Limites d’exposition professionnelle :
- Valeur limite de seuil de l’American Conference of Governmental Industrial Hygienists (ACGIH) – Moyenne pondérée dans le temps (TLV-TWA) : 25 ppm (90 mg/m³) avec une notation « peau ».
- Administration américaine de la sécurité et de la santé au travail (OSHA) : 100 ppm (360 mg/m³)
- Deutsche Forschungsgemeinschaft (MAK) : >50 ppm (180 mg/m³) avec une notation IIIB (cancérogène suspecté)
Mesures de contrôle de l’exposition
En raison du risque d’irritation de la peau et des yeux et de dommages au système respiratoire à des concentrations élevées, les lieux de travail utilisant du 1,4-dioxane devraient mettre en œuvre des mesures de contrôle pour minimiser l’exposition des travailleurs.
Ceux-ci incluent des contrôles techniques pour minimiser les niveaux de vapeurs en suspension dans l’air et l’utilisation d’équipements de protection individuelle tels que des gants, des lunettes de protection et des respirateurs, si nécessaire.
Cancérogénicité
Les premières études animales utilisant de fortes doses orales de dioxane (7 à 18 000 mg/kg) ont abouti à des tumeurs nasales et hépatiques. Cependant, des études ultérieures à des doses plus faibles (1 000 mg/kg et moins) n’ont montré aucune formation de tumeur, ce qui suggère un possible effet de seuil. De plus, les tests de mutagénicité n’ont révélé aucune interaction directe du dioxane avec l’ADN.
Ces résultats suggèrent que les tumeurs chez les rongeurs pourraient résulter de lésions tissulaires répétées plutôt que d’une génotoxicité directe.
Métabolisme et élimination
Des études utilisant du dioxane radiomarqué indiquent que de faibles doses sont rapidement converties et éliminées dans l’urine sous forme d’acide 2-hydroxyéthoxyacétique. Ce processus de conversion devient moins efficace à fortes doses, ce qui entraîne une élimination plus lente.
Expositions humaines et évaluation des risques de cancérogénicité
Des incidents d’exposition humaine à des concentrations estimées à 470 ppm de dioxane ont entraîné des décès. Cependant, les études épidémiologiques portant sur des travailleurs exposés à des niveaux allant jusqu’à 51 ppm n’ont montré aucun effet nocif sur la santé.
La cancérogénicité potentielle du 1,4-dioxane a incité divers organismes de réglementation internationaux à établir des lignes directrices concernant sa présence dans l’eau potable et dans l’environnement.
Le Centre international de recherche sur le cancer (CIRC) classe le 1,4-dioxane comme cancérogène du groupe 2B (probablement cancérogène pour l’homme) sur la base d’études animales montrant une incidence accrue de carcinomes des fosses nasales, du foie et de la vésicule biliaire chez les rats, les souris et les cobayes. , respectivement.
Dioxane dans l’eau potable
L’Organisation mondiale de la santé (OMS) recommande une valeur guide de 50 μg/L pour le 1,4-dioxane dans l’eau potable.
L’Environmental Protection Agency (EPA) des États-Unis et le National Center for Environmental Assessment ont proposé un niveau consultatif fondé sur la santé de 3 μg/L dans l’eau potable.
Le système intégré d’information sur les risques de l’EPA suggère un risque potentiel de cancer de 1 sur 1 000 000 pour une exposition à vie de 0,35 μg/L. Par conséquent, la règle de surveillance des contaminants non réglementés (UCMR3) fixe un niveau de déclaration minimum de 0,07 μg/L.
L’Agence fédérale allemande pour l’environnement recommande une limite de précaution de 0,1 μg/L pour les cancérogènes non génotoxiques comme le 1,4-dioxane dans l’eau potable.
Le Japon a établi une norme environnementale de 50 μg/L pour le 1,4-dioxane.
Aux États-Unis, plusieurs États ont fixé leurs propres niveaux consultatifs pour le 1,4-dioxane dans l’eau potable, reflétant une mosaïque de réglementations à travers le pays.
Références
- Dioxane; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a08_545.pub2
- 1,4-Dioxane; https://onlinelibrary.wiley.com/doi/10.1002/9781119407621.ch4
