Wat is dioxaan?
Dioxaan, of 1,4-dioxaan, is een heterocyclische diether met de formule C4H8O2. Het is een ontvlambare, kleurloze vloeistof met een zwakke, zoete geur die lijkt op di-ethylether. Het is bekend onder andere namen zoals p-dioxaan, di-ethyleenoxide, di-ethyleendioxide, di-ethyleenether, 1,4-dioxacyclohexaan, dioxyethyleenether en dioxaan.
Dioxaan werd voor het eerst geproduceerd door A. V. Lourenço in 1863 door ethyleenglycol te laten reageren met 1,2-dibroomethaan. Commerciële productie vond echter pas plaats in 1929.
Inhoudsopgave
1. Fysieke eigenschappen van dioxaan
Dioxaan is een goed oplosmiddel met uitzonderlijke eigenschappen. Het lost gemakkelijk een breed scala aan organische verbindingen op, waaronder alifatische en aromatische koolwaterstoffen, ethers, alcoholen, ketonen en gechloreerde koolwaterstoffen, met name die met een lager moleculair gewicht.
1,4-dioxaan is mengbaar met water in alle verhoudingen en lost ook verschillende anorganische verbindingen en elementen op, waaronder ijzerchloriden, kwikchloride, minerale zuren (zoutzuur, zwavelzuur en fosforzuur), halogenen (broom, chloor en jodium), dierlijke en plantaardige oliën, paraffine-oliën en synthetische en natuurlijke harsen.
Bij kamertemperatuur verschijnt 1,4-dioxaan als een heldere vloeistof met een etherische geur. De chemische stabiliteit ervan is vergelijkbaar met die van andere alifatische ethers. Net als deze ethers vormt dioxaan peroxiden bij blootstelling aan lucht.
De belangrijkste fysische eigenschappen van dioxaan staan vermeld in Tabel 1.
| Eigenschap | Waarde |
|---|---|
| Moleculair gewicht | 88,11 g/mol |
| Kookpunt | 101,3 °C |
| Vriespunt | 11,8 °C |
| Dichtheid | 1,0356 g/cm3 |
| Latente warmte van Verdamping | 413 kJ/kg |
| Smeltwarmte | 141 kJ/kg |
| Soortelijke warmte (20 °C) | 1,76 kJ kg-1 K-1 |
| Breukindex | 1,4224 |
| Dampspanning (20 °C) | 4,13 kPa (41,3 mbar) |
| Diëlektrische constante (20 °C) | 2,23 |
| Oppervlaktespanning (20 °C) | 36,9 mN/m |
| Kritische temperatuur | 312 °C |
| Kritische druk | 5,14 MPa |
| Vlampunt (gesloten beker) | 11 °C |
| Ontvlambaarheidsgrenzen (in lucht) |
Onder: 2 vol % Boven: 22 vol % |
| Warmte van Verbranding | 27 600 kJ/kg |
| Zelfontbrandingstemperatuur | 180 °C |
Dioxaan vormt azeotrope mengsels met veel oplosmiddelen. Veelvoorkomende voorbeelden staan in Tabel 2.
| Component | Kookpunt component, °C | Dioxaan, gew.% | Azeotropisch kookpunt, °C |
|---|---|---|---|
| Mierenzuur | 100,7 | 57 | 113,35 |
| Nitromethaan | 100,8 | 43,5 | 100,55 |
| Azijnzuur | 117,9 | 20,5 – 23 | 119,4 |
| Ethanol | 78,5 | 9,3 | 78,1 |
| 3-jood-1-propeen | 103 | 44 | 98,5 |
| 1-propanol | 97,4 | 45 | 95,3 |
| tert-amylalcohol | 102,5* | 20 | 100,65 |
| Cyclohexaan | 80,7 | 24,6 | 79,5 |
| Heptaan | 98,4 | 44 | 91,85 |
| Water | 100 | 82 | 87,8 |
2. Chemische reacties van dioxaan
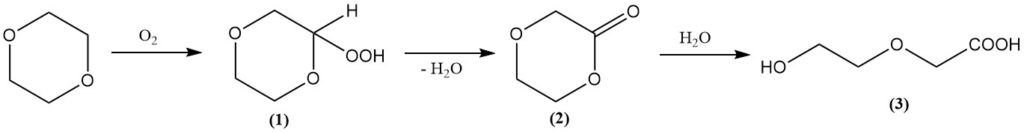
Dioxaan vormt net als andere ethers gemakkelijk peroxiden bij blootstelling aan lucht. Deze peroxiden zijn vaak zeer explosief en instabiel. Het primaire peroxide dat wordt gevormd, is 2-hydroperoxy-1,4-dioxaan (1), dat ontleedt tot dioxanon (2) en water.
Vervolgens leidt hydrolyse tot de vorming van 2-(2-hydroxyethoxy)azijnzuur (3). Gelukkig bevordert het reactiepad de vorming van het eindproduct, waardoor de peroxideconcentratie wordt beperkt.
Ondanks dit vereist het hanteren van dioxaan dezelfde voorzorgsmaatregelen als bij andere ethers om peroxidevorming te voorkomen. Inert gas spargen, meestal met stikstof, is een aanbevolen praktijk. Ook mogen peroxiden nooit worden geconcentreerd of gedestilleerd tot ze droog zijn.
Vastgestelde methoden voor het verwijderen ervan omvatten reductiemiddelen zoals ijzer(II)- of tin(II)chloriden, natriumbisulfiet of adsorberende materialen zoals actieve kool, aluminiumoxide of anionenuitwisselingsharsen.
1,4-dioxaan is in staat om op te lossen en complexen te vormen met verschillende halogenen (Cl2, Br2 en I2) en halogeenzuren. Deze complexen kunnen de reactiviteit van de halogenen of halogeenzuren tijdens reacties matigen. Zo kan het dioxaandibromidecomplex bijvoorbeeld worden gebruikt voor gecontroleerde bromering van fenolen, aromatische aldehyden/aminen en ketonen.
De chlorering van dioxaan kan gechloreerde derivaten opleveren die 1 tot 8 chlooratomen bevatten. De specifieke isomeerverdeling is afhankelijk van de gebruikte reactieomstandigheden (temperatuur, katalysatoren).
Dioxanen met minder chlooratomen worden gebruikt als voorlopers voor additieverbindingen, zoals ethoxy- of ethylgroepen, met behulp van geschikte reagentia zoals NaOCH2CH3 of CH3CH2MgBr, respectievelijk.
2,3-dichloor-1,4-dioxaan is zeer reactief en condenseert gemakkelijk met andere functionele groepen zoals carbonzuren, alcoholen en glycolen om de overeenkomstige diesters en ethers te vormen.
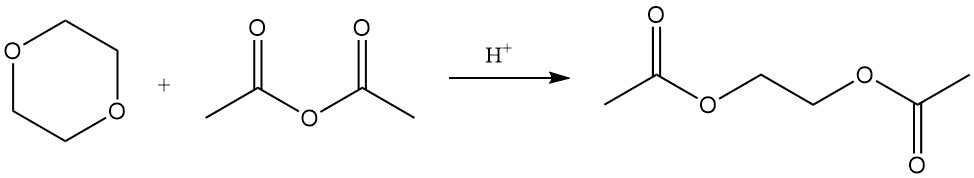
Hoewel de dioxaanring stabiel is, kunnen sterke zuren onder verhoogde temperatuur en druk deze splitsen. Onder dergelijke omstandigheden leveren reacties met azijnzuuranhydride ethyleenglycoldiacetaat en di-ethyleenglycoldiacetaat op.
Dioxaan kan worden ontleed door waterstofperoxide bij 25 °C met FeSO4 als katalysator.
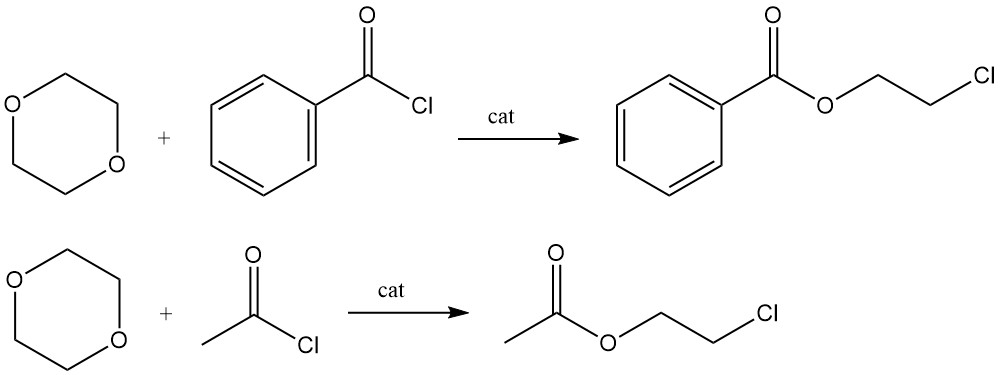
Lewiszuur-gekatalyseerde reacties van 1,4-dioxaan met benzoylchloride of acetylchloride produceren respectievelijk de 2-chloorethylesters van benzoëzuur en azijnzuur.
Met behulp van benzoylperoxide als katalysator reageert dioxaan met α-olefinen bij een temperatuur van 80–140 °C gedurende 5–10 uur om een verscheidenheid aan polymeren te produceren die als smeermiddelen worden gebruikt.
Vergelijkbare reacties kunnen optreden met tetrafluorethyleen, waarbij peroxide-gekatalyseerde reacties bij hoge temperaturen en druk analoge polymeren opleveren.
Er zijn talloze alternatieve katalysatoren gerapporteerd voor deze polymerisaties, waaronder peroxiden (organisch en anorganisch), basen (borax, dinatriumfosfaat, hydrazine) en Lewis-zuren (zinkchloride, fosforzuur).
Anders dan halogenen vormt 1,4-dioxaan complexen met verschillende functionele groepen, zoals AlBr3, AlCl3, AuCl3, BBr3, BCl3, BF3, CuCl2, CoCl2, FeCl3, HgCl2, LiBr, LiCl, LiI, ZnCl2, PtCl4, HCl, H2SO4, H3PO4, SO2, SO3 en trinitrofenol.
Deze complexen worden gebruikt als katalysatoren, moderatoren in reacties zoals bromering of sulfonering, of als reactiemedia voor watervrije zuursystemen.
3. Productie van dioxaan
Dioxaan wordt voornamelijk geproduceerd door een gesloten-lusproces waarbij dehydratie en daaropvolgende ringsluiting van di-ethyleenglycol betrokken is. Geconcentreerd zwavelzuur (ongeveer 5%) wordt gebruikt als katalysator voor deze reactie. Alternatieve katalysatoren zoals fosforzuur, p-tolueensulfonzuur en sterk zure ionenuitwisselingsharsen kunnen echter ook worden gebruikt.
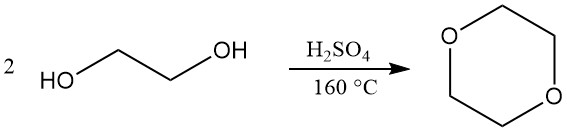
De bedrijfsomstandigheden voor dit proces kunnen variëren. Reactietemperaturen variëren doorgaans van 130 tot 200 °C, terwijl de druk kan variëren van iets boven atmosferische druk tot een gedeeltelijk vacuüm (25–110 kPa). Een reactietemperatuur van 160 °C wordt vaak als optimaal beschouwd.
De reactieopstelling maakt continue productie mogelijk, waarbij de gevormde dioxaan direct uit het reactievat wordt verdampt. Deze dampen worden vervolgens door een zuurval en een reeks destillatiekolommen geleid om water te verwijderen en het eindproduct te zuiveren. Opbrengsten van ongeveer 90% zijn haalbaar.
Het is belangrijk om op te merken dat dit proces ongewenste bijproducten genereert, zoals 2-methyl-1,3-dioxolaan, aceetaldehyde, crotonaldehyde en polyglycol.
Hoewel de dehydratie van di-ethyleenglycol de dominante commerciële route is, bestaan er andere methoden voor het synthetiseren van 1,4-dioxaan. Deze minder gebruikelijke methoden omvatten:
- Dehydrohalogenering van 2-chloor-2′-hydroxyethylether
- Reactie van ethyleenglycol met 1,2-dibroomethaan
- Dimerisatie van ethyleenoxide met behulp van katalysatoren zoals NaHSO4, SiF4 of BF3, of door reacties bij hoge temperaturen met zure kationenuitwisselingsharsen
4. Toepassingen van dioxaan
De belangrijkste industriële toepassing van 1,4-dioxaan is de stabilisatie van 1,1,1-trichloorethaan tegen reactie met aluminium. Er vormt zich een aluminiumoxidefilm op het metaaloppervlak, waardoor direct contact met 1,1,1-trichloorethaan wordt voorkomen.
Wanneer deze beschermende laag echter wordt verstoord, reageert 1,1,1-trichloorethaan met het blootgestelde aluminium, waarbij chloor wordt onttrokken en aluminiumchloride wordt gevormd, wat vervolgens de dehydrohalogenering van 1,1,1-trichloorethaan bevordert om zoutzuur en vinylideenchloride te produceren.
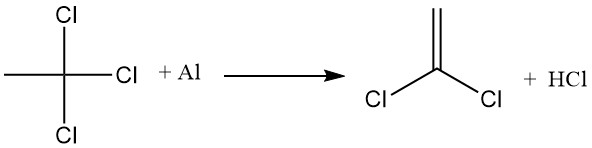
1,4-dioxaan remt deze reacties door een onoplosbaar complex te vormen tussen dioxaan en aluminiumchloride. Dit complex deactiveert de AlCl3-katalysator en dicht alle openingen in de aluminiumoxidefilm af, waardoor direct contact tussen het metaal en 1,1,1-trichloorethaan wordt voorkomen.
Dioxaan wordt gebruikt als bevochtigings- en dispergeermiddel bij textielverwerking, verfbaden, beitsen en drukcomposities. Bovendien helpt het bij de voorbereiding van histologische preparaten.
Dioxaan wordt gebruikt in andere sectoren, waaronder:
- Oplosmiddelen: Het wordt gebruikt als oplosmiddel bij het formuleren van inkten, coatings, kleefstoffen, scintillatietellers en voor het extraheren van dierlijke en plantaardige oliën.
- Chemische tussenproducten: producten afgeleid van dioxaan zijn waardevol als insecticiden, herbiciden, weekmakers en monomeren.
- Katalyse en reagentia: Oxoniumcomplexen gevormd door dioxaan met zouten, minerale zuren, halogenen en zwaveltrioxide functioneren als katalysatoren en reagentia in watervrije zuurreacties, brominaties en sulfoneringen.
- Laboratoriumtoepassingen: In laboratoria wordt 1,4-dioxaan gebruikt als een cryoscopisch oplosmiddel voor het bepalen van moleculaire massa’s, en de stabiliteit ervan maakt het een geschikt reactiemedium voor verschillende chemische transformaties.
- Traditioneel werd dioxaan gebruikt bij de productie van polymeren en als oplosmiddel voor natuurlijke en synthetische harsen, waaronder cellulosederivaten, polyvinylacetaalharsen en acrylonitril-methylvinylpyridinecopolymeren.
5. Toxicologie van dioxaan
Dioxaan heeft een relatief lage acute toxiciteit. Orale en dermale LD50-waarden bij ratten en konijnen zijn respectievelijk 5170 mg/kg en 7600 mg/kg. Inademing gedurende 4 uur bij 14.260 ppm (51.880 mg/m³) is dodelijk voor 50% van de blootgestelde rattenpopulatie (LC50).
Beroepsmatige blootstellingslimieten:
- American Conference of Governmental Industrial Hygienists (ACGIH) Threshold Limit Value—Time-Weighted Average (TLV-TWA): 25 ppm (90 mg/m³) met een “skin”-notatie.
- US Occupational Safety and Health Administration (OSHA): 100 ppm (360 mg/m³)
- Deutsche Forschungsgemeinschaft (MAK): >50 ppm (180 mg/m³) met een IIIB-notatie (vermoedelijk carcinogeen)
Maatregelen ter beheersing van blootstelling
Vanwege de kans op huid- en oogirritatie en schade aan het ademhalingssysteem bij hoge concentraties, moeten werkplekken waar 1,4-dioxaan wordt gebruikt, maatregelen treffen om de blootstelling van werknemers te minimaliseren. Deze omvatten technische maatregelen om de hoeveelheid damp in de lucht te minimaliseren en het gebruik van persoonlijke beschermingsmiddelen zoals handschoenen, oogbescherming en ademhalingsmaskers, indien nodig.
Carcinogeniciteit
Vroege dierstudies met hoge orale doses dioxaan (7–18.000 mg/kg) resulteerden in neus- en levertumoren. Latere studies met lagere doses (1000 mg/kg en lager) lieten echter geen tumorvorming zien, wat suggereert dat er mogelijk sprake is van een drempeleffect. Bovendien lieten mutageniteitstesten geen directe interactie van dioxaan met DNA zien.
Deze bevindingen suggereren dat tumoren bij knaagdieren eerder ontstaan door herhaalde weefselschade dan door directe genotoxiciteit.
Metabolisme en eliminatie
Studies met radioactief gelabeld dioxaan geven aan dat lage doses snel worden omgezet in en geëlimineerd in de urine als 2-hydroxyethoxyazijnzuur. Dit conversieproces wordt minder efficiënt bij hoge doses, wat resulteert in een langzamere eliminatie.
Menselijke blootstelling en beoordeling van het risico op carcinogeniteit
Incidenten met menselijke blootstelling aan geschatte concentraties van 470 ppm dioxaan hebben geleid tot sterfgevallen. Epidemiologische studies van werknemers die werden blootgesteld aan niveaus tot 51 ppm hebben echter geen nadelige gezondheidseffecten aangetoond.
De potentiële carcinogeniciteit van 1,4-dioxaan heeft verschillende internationale regelgevende instanties ertoe aangezet richtlijnen op te stellen voor de aanwezigheid ervan in drinkwater en het milieu.
Het Internationaal Agentschap voor Kankeronderzoek (IARC) classificeert 1,4-dioxaan als een groep 2B-carcinogeen (waarschijnlijk carcinogeen voor mensen) op basis van dierstudies die een verhoogde incidentie van neusholte-, lever- en galblaascarcinomen bij respectievelijk ratten, muizen en cavia’s laten zien.
Richtlijnen voor dioxaan in drinkwater
De Wereldgezondheidsorganisatie (WHO) beveelt een richtlijnwaarde van 50 μg/l aan voor 1,4-dioxaan in drinkwater.
Het Amerikaanse Environmental Protection Agency (EPA) en het National Center for Environmental Assessment stelden een gezondheidsadviesniveau van 3 μg/l in drinkwater voor.
Het Integrated Risk Information System van de EPA suggereert een potentieel kankerrisico van 1 op 1.000.000 bij een levenslange blootstelling van 0,35 μg/l. Bijgevolg stelt de Unregulated Contaminant Monitoring Rule (UCMR3) een minimum rapportageniveau van 0,07 μg/L vast.
Het Duitse Federale Milieuagentschap beveelt een voorzorgsrichtlijnlimiet van 0,1 μg/L aan voor niet-genotoxische carcinogenen zoals 1,4-dioxaan in drinkwater.
Japan heeft een milieunorm van 50 μg/L voor 1,4-dioxaan vastgesteld.
In de Verenigde Staten hebben verschillende individuele staten hun eigen adviesniveaus voor 1,4-dioxaan in drinkwater vastgesteld, wat een lappendeken van regelgevingen in het hele land weerspiegelt.
Referenties
- Dioxane; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a08_545.pub2
- 1,4-Dioxane; https://onlinelibrary.wiley.com/doi/10.1002/9781119407621.ch4




