Applications des agents de blanchiment dans l’industrie
Introduction
Le processus d’obtention d’un effet de blanchiment implique l’élimination des chromophores. Ceci peut être accompli en adsorbant les composés colorés sur des surfaces actives telles que du charbon actif ou des argiles décolorantes.
Cette méthode est couramment utilisée à l’échelle industrielle pour blanchir et purifier des liquides comme l’huile végétale. Une autre approche couramment utilisée dans les milieux industriels est la destruction chimique des chromophores dans les composés organiques ou inorganiques, qui est souvent associée à des processus de purification ou de nettoyage.
Ceci est particulièrement important pour les produits naturels, qui contiennent souvent des impuretés. Par exemple, le coton est contaminé par des résidus de capsules de graines, de la cire, des constituants gras et des composés inorganiques.
En blanchissant le coton, sa luminosité est améliorée tout en éliminant simultanément les impuretés. Le blanchiment peut également servir de continuation ou de complément aux étapes de traitement précédentes.
Pour illustrer, dans le contexte de la réduction en pâte chimique, le blanchiment élimine la lignine des fibres de bois, ce qui entraîne une brillance accrue et une purification supplémentaire de la cellulose.
Obtenir un blanchiment presque incolore sans causer de dommages est un défi et nécessite une expertise. L’objectif du blanchiment dès le début peut également être de créer une teinte plus uniforme, comme le blanchiment du placage de bois.
En termes de volume et de valeur du produit, le blanchiment des matériaux fibreux pour la production de papier et de textile revêt une importance significative.
Table des matières
1. Mécanisme de blanchiment
Le blanchiment peut être classé en blanchiment oxydatif et réducteur. Le blanchiment oxydatif détruit de manière irréversible les chromophores, tandis que le blanchiment réducteur peut être réversible, par exemple par réoxydation par l’oxygène atmosphérique.
Dans le cas des produits naturels, la composition chimique complète des composés colorés n’est souvent pas connue. Généralement, ces composés contiennent des doubles liaisons carbone-carbone conjuguées, telles que des chaînes polyméthine, des systèmes aromatiques ou des systèmes quinoïdes. Le blanchiment oxydatif perturbe les doubles liaisons, élimine la conjugaison et génère des composés chimiques de poids moléculaire inférieur.
Un blanchiment efficace implique souvent un processus en plusieurs étapes. La répétition de l’oxydation acide et de l’extraction alcaline permet de maintenir des conditions modérées et de faibles concentrations chimiques.
L’effet de blanchiment est mesuré par l’augmentation de la luminosité. Les photomètres à rémission sont utilisés pour déterminer la luminosité par rapport à une norme à plusieurs longueurs d’onde, BaSO4 étant la norme la plus couramment utilisée. Cependant, il existe d’autres méthodes disponibles pour évaluer la luminosité. La stabilité de la brillance sert également d’indicateur de la qualité et de l’efficacité du processus de blanchiment.
Une oxydation excessive peut entraîner la formation de nouveaux chromophores ou un jaunissement potentiel à l’avenir. Le jaunissement se produit si les groupes auxochromes d’un chromophore peuvent être réoxydés. La lumière et la chaleur peuvent provoquer des changements de couleur dans les matériaux blanchis.
Le rayonnement UV rompt facilement les liaisons carbone-carbone, produisant des radicaux. La recombinaison de ces radicaux avec l’oxygène ou d’autres parties de la molécule peut générer de nouveaux chromophores.
Lors des processus de blanchiment, il est important de s’assurer que le degré de polymérisation des polymères traités n’est pas affecté négativement. Une diminution du poids moléculaire peut avoir un impact sur la résistance des fibres et réduire la valeur économique.
Par conséquent, le blanchiment doit cibler les chromophores tout en préservant la structure moléculaire. La complexité des matières premières a conduit au développement de diverses méthodes de blanchiment.
Par exemple, le blanchiment du coton diffère du blanchiment de la laine. Alors que des conditions alcalines fortes peuvent être appliquées pour blanchir la cellulose polymère glucidique (coton), la fibre de laine de kératine (protéine) est très sensible aux alcalis. Le blanchiment alcalin ne peut pas être utilisé car il entraînerait la destruction du polymère par extraction des acides aminés.
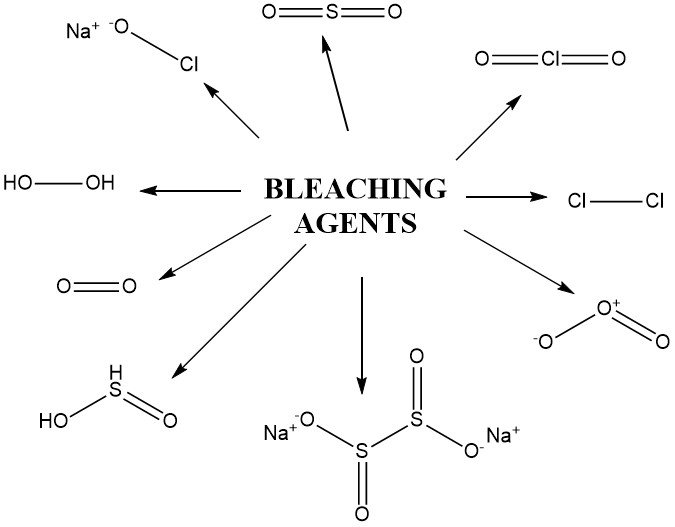
2. Agents de blanchiment
2.1. Prétraitement
La préparation d’un processus de blanchiment implique l’élimination des contaminants. Une méthode de prétraitement courante est le lavage. La laine tondue, par exemple, peut contenir une quantité importante de sable et de matières grasses (lanoline), jusqu’à 50 % en poids.
De même, les composés qui consomment ou décomposent l’agent de blanchiment doivent être éliminés avant le processus de blanchiment proprement dit. Le lavage avec des tensioactifs ou des composés chélateurs est une procédure standard pour y parvenir.
Il réduit la demande d’agents de blanchiment et minimise le potentiel de réactions secondaires négatives pendant le blanchiment. Dans le cas du blanchiment chimique de la pâte, il s’agit souvent d’une exigence cruciale.
Un lavage acide à un pH inférieur à 3 dissout les ions métalliques. La présence d’agents réducteurs comme le dioxyde de soufre, qui abaissent l’état d’oxydation des métaux, peut renforcer cet effet. Des agents chélatants tels que les sels de sodium de l’acide diéthylènetriaminepentaacétique (DTPA) ou de l’acide éthylènediaminetétraacétique (EDTA) sont utilisés dans des conditions légèrement acides (pH 5-6) pour accélérer l’élimination des métaux.
Cette gamme de pH permet l’élimination des métaux de transition tout en préservant les ions magnésium et calcium, qui servent de stabilisants dans le processus de blanchiment. Pour les pâtes chimiques produites par pâte alcaline, cette étape de démétallisation est nécessaire si un procédé de blanchiment totalement sans chlore (TCF) doit être mis en œuvre.
Dans le blanchiment conventionnel ou sans chlore élémentaire (ECF), les métaux sont éliminés au cours des étapes de dioxyde de chlore acide. Dans la réduction en pâte au sulfite acide, ils sont solubilisés au cours du processus de réduction en pâte et éliminés lors du lavage de la pâte brune.
Lors de la réduction en pâte alcaline du bois dur, des doubles liaisons polymères de xylane sont générées. Ces composés d’hémicellulose consomment des produits chimiques de blanchiment électrophiles. Un prétraitement acide à environ 90 ° C et à un pH inférieur à 3 est effectué pour hydrolyser ces composés, produisant de l’acide furancarboxylique. Cela aide à réduire la demande de produits chimiques de blanchiment.
Des enzymes telles que la xylanase peuvent être utilisées comme prétraitement. Au cours de la réduction en pâte alcaline, le xylane se dissout mais peut précipiter à nouveau dans les dernières étapes de la procédure de cuisson, ce qui pose des problèmes pour le blanchiment. L’enzyme xylanase élimine le précipité et facilite le processus de blanchiment. Les enzymes extraites de bactéries thermophiles avec une tolérance élevée à la température et au pH sont préférées à cette fin.
Dans le blanchiment des textiles, des traitements à l’amylase ou au peroxosulfate peuvent être nécessaires pour éliminer l’amidon.
2.2. Agents oxydants
Dans les temps anciens, le blanchiment oxydatif des textiles était pratiqué par les Égyptiens et les Phéniciens en utilisant la lumière du soleil combinée à un traitement alcalin doux impliquant du carbonate de potassium lixivié des cendres de bois.
Dans les années 1700, une méthode de blanchiment connue sous le nom de « blanchiment hollandais » est apparue, qui impliquait des traitements alternés avec du carbonate de potassium, une exposition au soleil sur les prairies herbeuses et du lait caillé. Cette technique a atteint son apogée près de Haarlem, aux Pays-Bas.
Les progrès des connaissances chimiques à la fin des années 1700 ont conduit à la découverte d’un nouvel agent de blanchiment, l’hypochlorite. L’hypochlorite de potassium (Eau de Javelle), l’hypochlorite de sodium (Eau de Labarraque) et l’hypochlorite de calcium sont devenus les agents de blanchiment industriels les plus importants pendant près de 150 ans.
Le chlore a été introduit dans le blanchiment chimique de la pâte à papier dans les années 1930, suivi du dioxyde de chlore et du peroxyde d’hydrogène une décennie plus tard.
L’utilisation industrielle de l’oxygène comme agent de blanchiment pour la pâte chimique a commencé à la fin des années 1960, et l’ozone a ensuite été incorporé dans les séquences de blanchiment de la pâte chimique.
D’autres composés oxydants utilisés pour le blanchiment comprennent des dérivés de peroxyde d’hydrogène comme l’acide peracétique, le perborate de sodium, les peroxodisulfates (persulfates) et les peroxomonosulfates (acide de Caro). Ces composés sont utilisés dans des conditions particulières, notamment le permanganate de potassium.
2.2.1. Oxygène
L’utilisation de l’oxygène comme agent de blanchiment a connu une augmentation significative depuis le début des années 1970. Il est utilisé dans le blanchiment de la pâte chimique pour soutenir et intensifier la dégradation de la lignine, qui s’amorce généralement lors de la réduction en pâte alcaline.
La délignification à l’oxygène nécessite des conditions alcalines, généralement avec de l’hydroxyde de sodium (NaOH), pour le processus d’oxydation. Il nécessite également des températures relativement élevées (75-100 °C) et une pression d’oxygène de 0,3-0,5 MPa. L’augmentation de la température, de la pression ou de la concentration de soude caustique améliore le taux d’oxydation.
Le processus de délignification à l’oxygène implique deux réactions simultanées : la délignification souhaitée et la dégradation indésirable des glucides. Par conséquent, des limites pratiques existent pour l’augmentation de la température et la quantité d’alcali. La réduction du degré de polymérisation est partiellement entravée par les sels de magnésium.
Bien que l’impact de l’oxygène sur la pâte chimique soit limité, son traitement réduit la demande d’autres produits chimiques de blanchiment de 40 à 50 %. La délignification à l’oxygène permet la récupération combinée des effluents de la réduction en pâte et des étapes de délignification ultérieures, réduisant efficacement le rejet total de matière organique de l’usine de blanchiment.
Dans les procédés de réduction en pâte à base de magnésium, tels que la réduction en pâte au sulfite de magnésium, l’étape d’oxygène peut être réalisée en utilisant de l’hydroxyde ou de l’oxyde de magnésium comme source d’alcali. En règle générale, le peroxyde d’hydrogène est ajouté simultanément (à environ 90 ° C) pour accélérer le taux de délignification.
2.2.2. Dioxyde de chlore et chlorite de sodium
Le dioxyde de chlore est un agent de blanchiment exceptionnellement sélectif qui a été utilisé pour la première fois dans le blanchiment de la pâte chimique en 1946.
Le dioxyde de chlore possède un électron non apparié, ce qui en fait un radical libre avec une stabilité limitée. Il existe sous forme de gaz dans des conditions standard et peut exploser spontanément à des pressions partielles supérieures à 40 kPa, se décomposant en chlore et en oxygène.
Lorsqu’elles sont exposées à la chaleur ou à la lumière, des concentrations encore plus faibles de dioxyde de chlore peuvent exploser, mais avec une violence réduite. Par conséquent, le dioxyde de chlore pur ne peut être ni transporté ni stocké. Au lieu de cela, il est généré sur place et généralement manipulé sous forme de solution aqueuse diluée.
La principale méthode industrielle de génération de dioxyde de chlore implique la réduction du chlorate. Historiquement, le procédé Mathieson, qui utilise du dioxyde de soufre pour la réduction, a joué un rôle important. L’acide sulfurique dilué et le sulfate de sodium ou l’hydrogénosulfate de sodium sont produits comme sous-produits.
Des procédés alternatifs avec moins de sous-produits utilisent de l’acide chlorhydrique, du méthanol ou du peroxyde d’hydrogène comme agent réducteur. L’acide chlorhydrique offre l’avantage d’un faible coût mais entraîne une quantité relativement élevée de chlore présent comme sous-produit dans le dioxyde de chlore, conduisant à une formation accrue de produits halogénés indésirables pendant le blanchiment.
Aujourd’hui, les procédés au méthanol et au peroxyde d’hydrogène sont les méthodes les plus répandues. Ces processus génèrent du dioxyde de chlore gazeux très pur, qui est dilué avec de l’air ou de la vapeur d’eau pour éviter les explosions.
Le gaz est ensuite absorbé dans de l’eau froide pour atteindre une concentration de 6-12 g/L. Pour les réactions du dioxyde de chlore avec la pâte, une valeur de pH comprise entre 2 et 5 est généralement maintenue. Dans cette plage de pH, le dioxyde de chlore n’a pas d’impact sur le degré de polymérisation de la cellulose.
La température de réaction recommandée pour le dioxyde de chlore se situe entre 50 et 75 °C. Dans le blanchiment de la pâte de feuillus, l’amorçage du blanchiment à des températures élevées (> 90 °C) est favorable car il permet simultanément l’oxydation de la lignine et l’hydrolyse des acides hexénuroniques.
Dans le blanchiment des textiles, le chlorite de sodium est utilisé comme source de dioxyde de chlore. L’acide chlorhydrique, l’acide formique ou l’acide acétique est utilisé pour libérer le dioxyde de chlore par la réaction suivante :
5 NaClO2 + 4 HCl → 4 ClO2 + 2 H2O + 5 NaCl
2.2.3. Peroxyde d’hydrogène et autres composés peroxo
Le peroxyde d’hydrogène a servi d’agent de blanchiment industriel depuis le début des années 1900, principalement dans le blanchiment des fibres textiles.
Le perborate de sodium, NaBO3·4 H2O, dérivé du peroxyde de sodium et du borax, a été utilisé comme agent de blanchiment dans les détergents à lessive comme Persil dès 1907.
À ce jour, les perborates et les percarbonates sont largement utilisés dans les détergents à lessive en raison de leur léger effet blanchissant à des températures élevées, ce qui est plus doux pour les fibres que les hypochlorites plus durs utilisés comme agents de blanchiment à froid. Des produits enrobés spéciaux sont appliqués pour améliorer la stabilité au stockage du percarbonate pur.
Des solutions aqueuses de peroxyde d’hydrogène sont disponibles dans le commerce à des concentrations allant jusqu’à 90 % en poids. Des solutions à 35-70% en poids sont couramment utilisées dans le blanchiment.
L’application la plus importante du peroxyde d’hydrogène est le blanchiment de la pâte pour la production de papier. La pâte mécanique et la pâte chimique sont blanchies à l’aide de solutions alcalines de peroxyde. Le peroxyde d’hydrogène est également utilisé pour blanchir les fibres textiles telles que le coton, le lin, la laine et les matières synthétiques.
Les procédés commerciaux de blanchiment au peroxyde d’hydrogène fonctionnent généralement dans des conditions légèrement à fortement alcalines. L’hydroxyde de sodium est couramment utilisé comme source alcaline. La réaction initiale implique l’addition nucléophile d’anions hydroperoxydes aux groupes carbonyle. Par conséquent, l’ajout d’alcali améliore le taux de blanchiment :
HOOH+ OH- ↔ HOO- + H2O
Cependant, les conditions alcalines favorisent également des réactions secondaires telles que la dismutation du peroxyde d’hydrogène en oxygène et en eau :
HOO- + H2O2 → H2O + OH- + O2
Le résultat du blanchiment dépend de l’activation et de la stabilisation. La vitesse de réaction augmente avec la température et la concentration en alcali.
Cependant, à des températures élevées, des réactions secondaires telles que la décomposition thermique du peroxyde d’hydrogène en radicaux deviennent plus probables, entraînant potentiellement des pertes de rendement et une solubilisation du matériau à blanchir. Par conséquent, la plage de température typique pour le blanchiment au peroxyde se situe entre 60 et 90 °C.
La stabilisation de la solution de blanchiment alcaline peut être nécessaire pour minimiser la décomposition du peroxyde. Les radicaux hydroxyle, générés par la décomposition du peroxyde, sont des agents oxydants hautement non sélectifs qui provoquent des réactions secondaires indésirables.
Dans le blanchiment chimique de la pâte, la chélation des métaux de transition n’est nécessaire que dans le blanchiment TCF (totalement sans chlore). Dans le blanchiment ECF (sans chlore élémentaire), le peroxyde d’hydrogène est généralement appliqué après une étape acide, qui élimine les métaux de transition pendant l’étape de lavage.
Pour le blanchiment mécanique de la pâte, les métaux nuisibles sont mieux éliminés par un prétraitement avec un agent chélatant. Les agents chélatants couramment utilisés sont les sels de sodium de l’acide diéthylènetriaminepentaacétique (DTPA), de l’acide éthylènediaminetétraacétique (EDTA) ou de phosphonates similaires ayant des capacités de chélation comparables ou supérieures.
Des stabilisants comme le silicate de sodium et les sels de magnésium (principalement du sulfate de magnésium) sont également utilisés. Ces stabilisants aident à précipiter ou à absorber les composés nocifs sur la silice colloïdale ou l’hydroxyde de magnésium.
Pendant le processus de blanchiment, le peroxyde d’hydrogène clive les chaînes latérales et détruit de manière irréversible les structures quinoïdes. L’oxydation et la destruction des quinones sont cruciales pour obtenir une bonne stabilité de la blancheur. Les produits blanchis au peroxyde présentent une réversion plus faible que les autres oxydants.
L’acide peracétique est utilisé en petites quantités comme étape d’activation avant le traitement au peroxyde d’hydrogène alcalin. Son application permet une plus grande augmentation de la luminosité ou une consommation globale plus faible de produits chimiques de blanchiment.
La réaction avec la pâte est effectuée dans des conditions légèrement acides, impliquant principalement la réaction d’hydroxylation de la lignine résiduelle. L’acide peracétique est produit en mélangeant de l’acide acétique et du peroxyde d’hydrogène.
En présence d’un acide fort (par exemple, l’acide sulfurique), un équilibre rapide s’établit entre l’acide acétique, l’acide peracétique, le peroxyde d’hydrogène et l’eau. Comme les autres composés du mélange ne contribuent pas à la réaction de blanchiment de l’acide peracétique, l’utilisation d’acide peracétique à l’équilibre est coûteuse.
L’acide peracétique distillé est une alternative, obtenue par distillation sous vide de l’acide peracétique à l’équilibre, résultant en une solution d’acide peracétique relativement pure dans l’eau. L’acide peracétique distillé avec une teneur d’environ 35% dans l’eau doit être stocké en dessous de 4 ° C pour éviter le rétablissement lent de l’équilibre avec le peroxyde d’hydrogène et l’acide acétique à des températures plus élevées.
Une autre option est le mélange sur site, qui donne un mélange acide peracétique/peroxyde qui peut être utilisé pour une réaction initiale d’acide peracétique suivie d’une étape ultérieure de blanchiment au peroxyde. Ceci est réalisé en ajoutant suffisamment d’alcali après l’étape acide.
L’acide peracétique peut également être généré in situ à partir de peroxyde d’hydrogène et de tétraacétyléthylènediamine (TAED) dans des conditions faiblement alcalines. Cette procédure est appliquée dans les agents de blanchiment utilisant du percarbonate ou du perborate comme source de peroxyde et est également applicable dans le blanchiment spécialisé.
Le peroxosulfate de potassium (KHSO5) est utilisé pour blanchir les fibres de polyamide et de cellulose, bien qu’il soit principalement utilisé pour nettoyer la laine et réduire son rétrécissement.
Le peroxodisulfate de sodium (Na2S2O8) et le peroxodisulfate d’ammonium ((NH4)2S2O8) sont utilisés dans le désencollage du coton et parfois comme additifs dans le blanchiment au peroxyde d’hydrogène.
2.2.4. Ozone
L’ozone est généré par une décharge électrique silencieuse de l’oxygène. Dans le blanchiment de la pâte à papier, l’ozone est généralement produit à l’aide d’oxygène pur. Cette méthode permet une concentration élevée d’ozone dans le gaz (jusqu’à 12% en poids) et facilite le processus de mélange.
Pour maintenir un blanchiment efficace, l’ozone est utilisé à un pH inférieur à 4. Il est important de maintenir la température en dessous d’environ 50 °C pour éviter les réactions secondaires avec la cellulose causées par son potentiel d’oxydation élevé. Des températures plus élevées peuvent entraîner une luminosité moins stable et un jaunissement facile.
2.2.5. Chlore et hypochlorites
Historiquement, le chlore était largement utilisé pour l’oxydation de la lignine (délignification) dans le blanchiment chimique de la pâte. La chloration implique la substitution et l’oxydation des cycles aromatiques de la lignine, entraînant la production d’acide dicarboxylique et de fragments de lignine chlorée.
Environ 10 % du chlore appliqué se retrouve sous forme de composés halogénés dans les effluents, notamment des phénols chlorés et des dibenzodioxines et dibenzofuranes polyhalogénés.
Ces composés sont analysés quantitativement par une méthode extractive au charbon actif, et la mesure est exprimée en composés organiques halogénés adsorbables (AOX).
Certains de ces composés sont mutagènes, entraînant une suppression progressive de l’application de chlore dans la plupart des régions après l’identification de ces substances dans les effluents.
Actuellement, l’hypochlorite est principalement utilisé comme détachant, appelé « agent de blanchiment à froid » dans le lavage. Dans le blanchiment chimique de la pâte, son application est limitée à de petites quantités pour une réduction contrôlée du degré de polymérisation de la pâte à dissoudre.
L’acide hypochlorique (HOCl) a un potentiel d’oxydation plus élevé (+1,50 V) que le chlore (+1,35 V) ou l’hypochlorite (OCl-) (+0,94 V). Pour éviter les réactions secondaires, en particulier la dépolymérisation causée par l’acide hypochlorique agressif, le blanchiment est effectué dans des solutions alcalines pour minimiser la concentration d’acide hypochlorique non dissocié.
Les conditions alcalines entraînent moins de réactions secondaires défavorables puisque l’anion hypochlorite est un nucléophile faible incapable d’attaquer les systèmes aromatiques riches en électrons. Cependant, le blanchiment à l’hypochlorite génère des composés halogénés comme sous-produits, avec une formation d’AOX significativement plus faible qu’avec le chlore. Le sous-produit principal est le chloroforme.
Des solutions d’hypochlorite de sodium avec des concentrations de chlore actif de 150-160 g/L sont disponibles dans le commerce. Le terme « chlore actif » fait référence à la quantité de chlore libérée lors de l’acidification de la solution d’hypochlorite.
2.3. Les agents réducteurs
Le principal agent de blanchiment réducteur est le dithionite de sodium, utilisé pour le blanchiment de la laine depuis l’Antiquité. Cependant, son importance a diminué. Les dérivés de l’acide sulfinique sont principalement utilisés pour éliminer les colorants des tissus textiles.
2.3.1. Dithionite de sodium
Le dithionite de sodium (Na2S2O4), également connu sous le nom d’hydrosulfite en Amérique du Nord (malgré la description initiale incorrecte), est actuellement produit à partir de formiate de sodium et de dioxyde de soufre. Auparavant, le dithionite de zinc obtenu à partir de dioxyde de soufre et de poussière de zinc était plus répandu que le sel de sodium.
Cependant, les préoccupations environnementales associées au zinc ont conduit à l’arrêt de la production sur site de dithionite de zinc à l’aide de poussière de zinc ou d’amalgame de sodium. Le dithionite de sodium peut être généré sur place dans certaines papeteries en utilisant une solution alcaline de borohydrure de sodium, du bisulfite de sodium et du dioxyde de soufre.
Le dithionite de sodium est disponible sous forme de poudre cristalline (90 % Na2S2O4) ou sous forme de solution réfrigérée à 150 g/L stabilisée avec un alcali. Les solutions doivent être conservées bien en dessous de 10 °C pour éviter que le dithionite ne se disproportionne en thiosulfate et bisulfite.
Le dithionite agit en réduisant les groupes carbonyle en alcools et les quinones en phénols, détruisant ainsi les chromophores. Il est utilisé pour blanchir la pâte mécanique, la laine, la soie, les poils, les cheveux, la paille, le savon, la colle, le kaolin et divers produits alimentaires tels que le sucre, la mélasse, la gélatine et les graisses alimentaires.
Le dithionite est sensible à l’oxydation par l’oxygène, le convertissant en sulfite et sulfate. À des températures élevées, la solution se décompose en thiosulfate, sulfite, sulfure d’hydrogène ou soufre, les produits spécifiques dépendant du pH. Le pH choisi pour le blanchiment au dithionite est un compromis entre un blanchiment efficace et une perte minimale de dithionite, généralement autour de pH 5-6 à des températures de 50 à 80 °C.
Dans le blanchiment mécanique de la pâte, le peroxyde d’hydrogène et le blanchiment au dithionite sont souvent combinés en deux étapes séquentielles.
2.3.2. Le dioxyde de soufre
Le dioxyde de soufre est principalement utilisé sous forme d’hydrogénosulfite de sodium (NaHSO3). Cependant, en raison de son effet de blanchiment relativement faible, le SO2 n’est plus largement utilisé. Il peut être utilisé comme prétraitement dans la production de pâte mécanique avant le blanchiment au dithionite et trouve également une application dans le traitement de la laine.
2.3.3. Dérivés d’acide sulfinique
Les dérivés importants de l’acide sulfinique comprennent l’hydroxyméthanesulfinate de sodium et l’acide formamidinesulfinique.
Les hydroxyméthanesulfinates sont produits en traitant les dithionites avec du formaldéhyde et sont plus stables que les dithionites. Ils nécessitent des températures plus élevées pour atteindre leur plein pouvoir réducteur.
Ces dérivés sont employés dans des procédés opérant au-dessus de 75 °C, où le dithionite se décomposerait rapidement. Ils trouvent une application dans le blanchiment du savon, de la colle, de la gélatine, des acides gras et principalement dans les procédés de teinture.
L’acide formamidinesulfinique, également connu sous le nom de dioxyde de thiourée, est obtenu à partir de thiourée et de peroxyde d’hydrogène. C’est un produit cristallin peu soluble dans l’eau qui devient plus soluble dans des conditions alcalines et présente son pouvoir réducteur le plus élevé au-dessus de 80 °C.
Cet acide est utilisé pour améliorer la brillance des textiles et éliminer les colorants des tissus, comme l’acide hydroxyméthanesulfinique. Son fort pouvoir réducteur à haute température le rend apte à blanchir les fibres secondaires lors de l’étape de dispersion et est particulièrement efficace pour détruire les colorants utilisés pour les papiers colorés.
3. Enzymes
L’utilisation technique des enzymes dans le blanchiment n’est pas encore largement adoptée et reste l’exception dans les procédés industriels. Alors que la découverte d’enzymes dégradant la lignine dans les champignons de la pourriture blanche offrait un potentiel de délignification et de blanchiment à l’échelle industrielle, des défis limitaient leur application pratique.
La réaction catalysée par ces enzymes était lente et pas assez sélective, et les enzymes nécessitaient des coenzymes qui dégradaient la cellulose, ce qui n’était pas souhaitable.
L’un des problèmes généraux avec l’application d’enzymes est le besoin de souches d’enzymes très pures pour éviter les réactions secondaires négatives provoquées par d’autres enzymes. De plus, de nombreux procédés industriels opèrent à des températures élevées ou à des pH extrêmes, ce qui nécessite l’utilisation d’enzymes adaptées à ces conditions.
Les organismes thermophiles, qui se développent dans des environnements à haute température, sont souvent préférés comme source pour sélectionner des enzymes aux propriétés appropriées.
Des enzymes spécifiques ont été étudiées pour leur potentiel dans les processus de blanchiment. Les xylanases, par exemple, sont utilisées pour éliminer une partie du xylane précipité des pâtes kraft non blanchies. Ce traitement réduit la demande de dioxyde de chlore dans le blanchiment sans chlore élémentaire (ECF) d’environ 10 %.
On pense que la lignine sur les fibres est partiellement recouverte de xylane précipité et que l’élimination du xylane facilite le lavage de la lignine. Cependant, l’effet global de l’application de xylanase est modéré et cela reste une option de niche pour les usines de pâte à papier ayant un accès limité au dioxyde de chlore.
La laccase est une enzyme impliquée dans la polymérisation des unités phénylpropane chez les plantes, contribuant à la formation du polymère de lignine. La laccase peut être utilisée pour la délignification de la pâte à l’aide d’un médiateur.
Les médiateurs peuvent être facilement convertis en cations radicalaires par la laccase et l’oxygène, et ces produits intermédiaires oxydent la lignine. Théoriquement, le médiateur peut être réoxydé plusieurs fois par l’enzyme, mais en pratique, les réactions répétées sont rares. En conséquence, la demande pour le médiateur, tel que le N-hydroxybenzotriazole, est élevée, rendant l’application industrielle économiquement non viable.
Les cellulases, un groupe d’enzymes qui décomposent la cellulose, ont été utilisées pour adoucir les tissus de coton. Ils sont appliqués dans le lavage à la pierre des jeans en remplacement de l’effet mécanique des pierres ponces. L’action des cellulases sur la surface du tissu provoque une décoloration de la couleur car le colorant est principalement situé sur la couche externe des fibres.
Des cellulases ont également été suggérées pour améliorer la résistance des fibres de la pâte à papier. En dissolvant les fines et les fibrilles, les cellulases peuvent augmenter la longueur moyenne des fibres et améliorer le potentiel de résistance. Cependant, ce processus de solubilisation réduit le rendement et augmente la charge sur l’effluent, rendant l’application à grande échelle peu probable d’un point de vue économique et environnemental.
Référence
- Bleaching; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a04_191.pub2
