Le dioxyde de chlore est un composé chimique inorganique de formule ClO2. Il existe sous forme de gaz vert jaunâtre à température ambiante,un liquide brun rougeâtre entre 11 °C et −59 °C, et sous forme de cristaux orange vif en dessous de −59 °C. Il est généralement manipulé sous forme de solution aqueuse et est produit sur site pour des applications industrielles.
Le dioxyde de chlore est principalement utilisé dans le blanchiment de la pâte de bois chimique. Historiquement, le chlore élémentaire était l’agent de blanchiment dominant. Cependant, en raison de préoccupations environnementales liées à son utilisation, le dioxyde de chlore est devenu l’alternative privilégiée depuis la fin des années 1980.
Table des matières
1. Propriétés du dioxyde de chlore
Le dioxyde de chlore (ClO2) est un composé chlore-oxygène avec un atome de chlore qui a une valence de quatre. Il possède un poids moléculaire de 67,45 g/mol, un point de fusion de -59 °C et un point d’ébullition de 11 °C.
Cette propriété fait du dioxyde de chlore un gaz à température ambiante. Ce gaz a une odeur distincte, semblable à celle du chlore mais avec un caractère âcre. Il est facilement détecté à de faibles concentrations. Cependant, l’inhalation de concentrations modérées peut être dangereuse et provoquer des lésions respiratoires.
Pour des raisons de sécurité et d’économie, le dioxyde de chlore disponible dans le commerce n’existe pas sous forme gazeuse pure, liquide ou solide. Pour les petites quantités, des formes stabilisées sont disponibles.
Le dioxyde de chlore se dissout facilement dans l’eau, présentant une couleur allant du jaune pâle au jaune verdâtre foncé selon la concentration (à la fois en phase gazeuse et en solution). Il est très soluble dans l’eau pure, atteignant environ 60 g/L. La solubilité est inversement proportionnelle à la température ; elle diminue à mesure que la température augmente. Le processus de dissolution n’implique ni hydrolyse ni dimérisation.
Le dioxyde de chlore a un maximum d’absorption à 360 nm. Bien qu’il ne soit pas particulièrement distinct, ce pic peut être utilisé pour mesurer la concentration de dioxyde de chlore dans des solutions gazeuses, aqueuses et même organiques.
La molécule de dioxyde de chlore est intrinsèquement instable d’un point de vue thermodynamique. Des limitations cinétiques permettent une manipulation en phase gazeuse, mais des limitations strictes existent. La pression de vapeur ne doit pas dépasser 10 à 12 kPa pour éviter une décomposition rapide avec des risques potentiellement explosifs.
Le dioxyde de chlore est relativement stable lorsqu’il est absorbé dans des solutions aqueuses (en raison de la chaleur de la solution), notamment dans des conditions fraîches et sombres. Cependant, la pression de vapeur sur de telles solutions nécessite des limitations de concentration (environ 1 % en poids) pour éviter une accumulation dangereuse de pression de vapeur. De plus, la formation de ClO2·8 H2O cristallin peut se produire.
Le dioxyde de chlore peut également être dissous dans divers autres solvants.
Les deux liaisons chlore-oxygène possèdent un caractère de double liaison avec un angle de liaison de 117,5°. Avec 19 électrons de valence, dont un électron non apparié, le dioxyde de chlore a un comportement semblable à celui d’un radical, permettant diverses voies de réaction.
Comme tous les oxydes de chlore, il présente un risque d’explosion élevé en cas de choc thermique ou physique. La compression de la phase gazeuse doit être strictement évitée.
Le dioxyde de chlore agit comme un puissant agent oxydant, provoquant l’inflammation spontanée et parfois explosive des matières organiques. Dans les solutions aqueuses, il oxyde les hydrocarbures en cétones et alcools.
2. Production industrielle de dioxyde de chlore
Le dioxyde de chlore (ClO2) est produit à partir de chlorite de sodium (NaClO2) ou de chlorate de sodium (NaClO3). Ces deux matières premières sont relativement stables, malgré leur potentiel oxydant.
Les méthodes de production impliquent soit la réduction du chlorate, soit l’oxydation du chlorite. Cependant, la réduction des chlorates reste la méthode dominante en raison de sa rentabilité, en particulier pour les applications à grande échelle dépassant 2 000 kg/jour de ClO2. Les opérations à plus petite échelle peuvent utiliser soit du chlorite, soit du chlorate.
La principale réaction de réduction des chlorates est la suivante :
ClO3– + reducing agent + acid → ClO2 + byproducts
Ce processus se produit dans un milieu électrolytique fort contenant un acide puissant (acide sulfurique ou acide chlorhydrique) et un agent réducteur (généralement du méthanol). L’agent réducteur réduit sélectivement la valence de l’atome de chlore d’une unité. Le maintien d’un excès stoechiométrique d’acide et d’agent réducteur optimise la rentabilité car le chlorate est la matière première la plus chère.
La rentabilité est un facteur crucial dans le choix du processus. Cependant, l’accessibilité et la sécurité de l’approvisionnement en ClO2 sont tout aussi importantes. Les processus efficaces de production de dioxyde de chlore minimisent l’impact sur l’environnement et respectent les règles de sécurité.
Aujourd’hui, il existe deux principaux procédés de réduction des chlorates :
- Les procédés sous vide offrent une approche plus complexe, mais génèrent une rentabilité globale de production supérieure pour les opérations à grande échelle. Ces processus retiennent les matières premières dans le réacteur tout en cristallisant et en séparant les sels des sous-produits.
- Les processus atmosphériques utilisent une série de réacteurs pour réaliser une réaction complète. Les effluents acides usés de ces systèmes contiennent des sous-produits, du chlorate résiduel et des quantités importantes d’acide.
Le processus de production n’est pas aussi simple qu’il y paraît ; plusieurs réactions concurrentes et parallèles peuvent exister, impliquant souvent 10 à 20 étapes individuelles.
Un contrôle minutieux des concentrations et de la pureté des réactifs est essentiel pour obtenir des rendements et des efficacités optimaux du générateur. Des ajustements de processus peuvent être effectués pour répondre à une capacité de production spécifique et aux exigences minimales de formation de sous-produits sans investissement important.
2.1. Production de dioxyde de chlore à partir de chlorate en utilisant du méthanol comme agent réducteur
La réaction entre le chlorate de sodium, le méthanol et l’acide sulfurique représente la principale voie industrielle de production de dioxyde de chlore :
9 NaClO3 + 2 CH3OH + 6 H2SO4 → 9 ClO2 + 3 Na3H(SO4)2 + 0,5 CO2 + 1,5 HCOOH + 7 H2O
Cette équation semble simple, mais elle implique de nombreuses étapes de réaction concurrentes. Néanmoins, ce procédé reste la méthode la plus rentable et la plus fiable, représentant environ 75 % de la production mondiale de ClO2. Il offre plusieurs avantages :
- Efficacité économique : le processus a de faibles coûts opérationnels.
- Fiabilité : Une production cohérente et fiable est réalisable.
- Formation minimale de chlore : la formation de chlore élémentaire est minime, généralement inférieure à 0,1 g/L dans une solution de ClO2 à 10 g/L.
- Compatibilité des sous-produits : L’acide formique généré (HCOOH) n’inhibe pas les processus de blanchiment en aval.
Les processus les plus importants utilisant cette méthodologie sont SVP-LITE (Eka Chemicals) et le R8 associé (ERCO Worldwide).
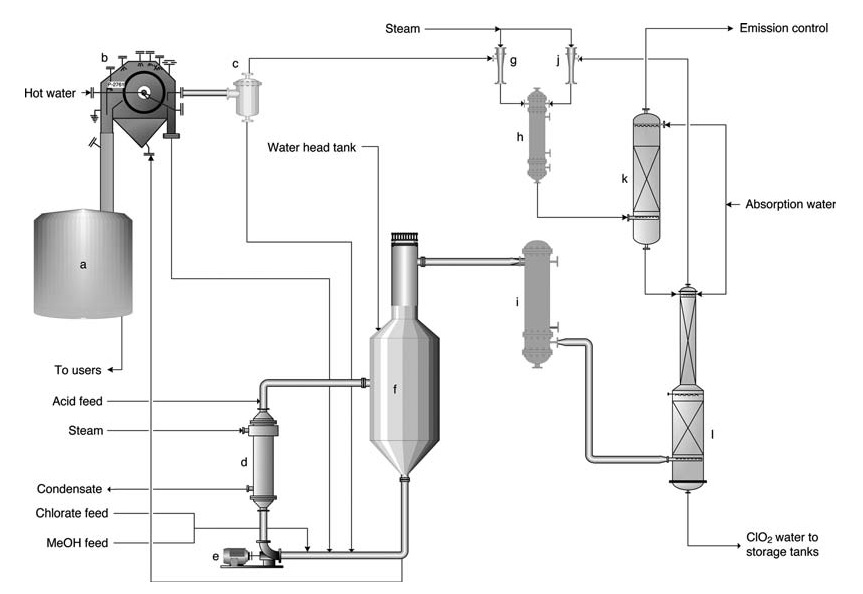
a) Cuve de dissolution des pâte de sel ; b) Filtre à pâte de sel ; c) Réservoir de réception du filtrat ; d) Rebouilleur ; e) Pompe de circulation du générateur ; f) Générateur SVP ; g) Éjecteur pour filtre à vide ; h) Condenseur de vapeur à éjecteur ; i) Injecteur principal pour le vide de procédé ; j) Refroidisseur de gaz ; k) Épurateur de ventilation ; l) Tour d'absorption
Le procédé SVP-LITE (Figure 1) utilise un système de circulation dans une cuve de réacteur principale maintenue sous vide. Les réactifs (chlorate, méthanol et acide sulfurique) sont introduits dans le réacteur, où ils réagissent pour former du ClO2 et précipiter les sels des sous-produits.
La chaleur est fournie par un rebouilleur et par la chaleur de dilution de l’acide sulfurique. Le dioxyde de chlore sort du réacteur avec l’eau évaporée et est ensuite absorbé dans l’eau dans une tour d’absorption.
La solution de ClO2 résultante est ensuite pompée vers le stockage. Les gaz résiduaires provenant de l’absorbeur subissent un épuration supplémentaire pour minimiser les émissions. Une partie de la solution du réacteur est détournée vers un filtre pour éliminer le sel sous-produit avant d’être remise en circulation dans le réacteur.
Pour simplifier les opérations, le sel solide est généralement redissous et dirigé vers le système chimique de l’usine.
Les taux de production varient généralement de 5 à 60 tonnes par jour. Le produit final contient 9 à 10 g/L de ClO2 et est pratiquement exempt de chlore élémentaire (teneur en Cl2 généralement inférieure à 0,1 g/L mais garantie inférieure à 0,2 g/L).
Le sel sous-produit non traité du générateur est généralement un sel de sulfate acide appelé sesquisulfate de sodium (Na3H(SO4)2). Cependant, le processus peut être modifié pour produire du sulfate de sodium neutre (Na2SO4).
Cette conversion est obtenue en transformant le sesquisulfate de sodium au sein d’une unité industrielle dédiée (conduisant aux noms de processus SVP-SCW et R10, respectivement).
Le flux de sesquisulfate provenant du système de réacteur est dirigé vers une cuve de mélange/métathèse, où il subit une conversion partielle en sulfate de sodium, qui est ensuite séparé par recristallisation et filtration. La solution acide est ensuite renvoyée dans le réacteur de ClO2.
La conversion du sel acide en une forme neutre offre des avantages significatifs, tels qu’une consommation d’acide réduite et une diminution du volume du pâte de sel.
2.2. Production de dioxyde de chlore à partir de chlorate en utilisant du peroxyde d’hydrogène comme agent réducteur
Le peroxyde d’hydrogène peut également être utilisé comme agent réducteur dans la production de dioxyde de chlore à base de chlorate. Ce processus génère de l’oxygène comme sous-produit, qui est libéré dans l’atmosphère:
NaClO3 + 0,5 H2O2 + 0,5 H2SO4 → ClO2 + 0,5 Na2SO4 + 0,5 O2 + H2O
Malgré son apparente simplicité, la réaction réelle est plus complexe. Le sous-produit peut être soit du sulfate de sodium, soit du sesquisulfate de sodium en fonction de l’acidité du réacteur. Bien que le fonctionnement à une acidité plus élevée permette la production de sesquisulfate de sodium, cela se fait au prix d’une consommation accrue d’acide et d’une génération de pâte de sel.
Les avantages du peroxyde d’hydrogène sont les suivants :
- Capacité accrue : la cinétique de réaction plus rapide du peroxyde d’hydrogène permet une capacité de production plus élevée dans les usines de ClO2 existantes avec un capital minimal.
- Agent réducteur plus sûr : Le peroxyde d’hydrogène offre une alternative plus sûre par rapport à d’autres agents réducteurs comme le méthanol, le dioxyde de soufre ou le chlorure.
- Potentiel du pâte de sel neutre : les modifications du processus peuvent produire une pate de sel neutre, réduisant ainsi l’impact sur l’environnement.
- Dioxyde de chlore plus pur : L’utilisation de peroxyde d’hydrogène peut contribuer à un produit ClO2 plus pur.
Semblables aux procédés sous vide à base de méthanol (Figure 1), les procédés sous vide utilisent les noms commerciaux SVP-HP ou R11 (ce dernier employant un catalyseur).
Le procédé le plus courant dans des conditions atmosphériques est le procédé HP-A d’Eka Chemicals (Figure 2), également applicable aux procédés Solvay, Mathieson et R2. Ce processus est généralement mis en œuvre comme mise à niveau pour les installations plus anciennes en raison de sa conception similaire.
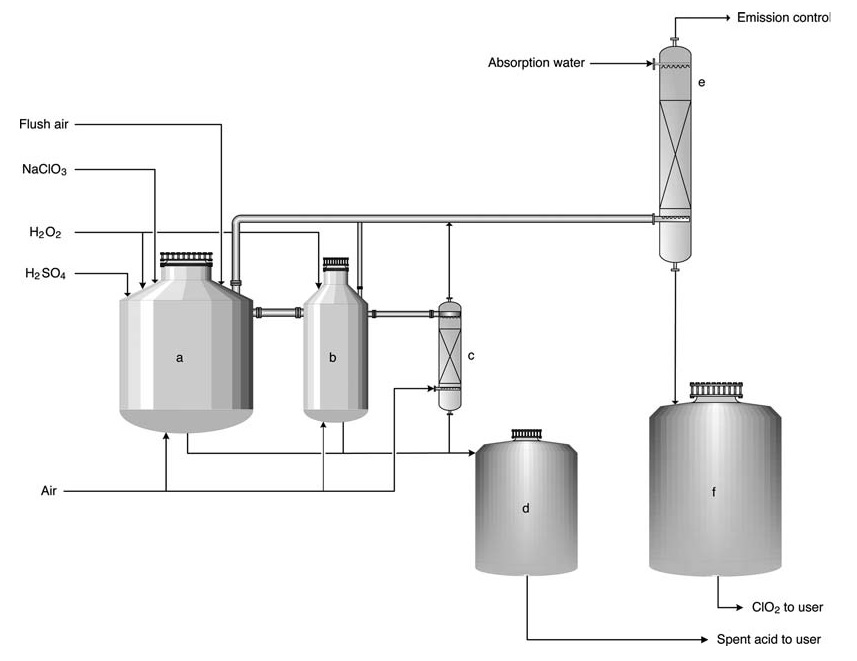
a) Réacteur primaire ; b) Réacteur secondaire ; c) Décapant ; d) Réservoir d'acide usé ; e) Tour d'absorption ; f) Réservoir de stockage de solution ClO2
Dans le procédé HP-A, les réactifs sont introduits dans une série (généralement 2-3) de réacteurs ouverts. Le processus est essentiellement adiabatique, reposant sur la chaleur de dilution de l’acide sulfurique pour maintenir la température de réaction (généralement 58 °C) et une légère pression subambiante. La majeure partie de la conversion du chlorate en dioxyde de chlore se produit dans le premier réacteur.
Le sel sous-produit reste en solution, tandis que de grands volumes d’air sont introduits pour désorber le ClO2 et maintenir les concentrations de gaz en dessous de la limite d’explosion (10 –12% vol. Le gaz est ensuite dirigé vers une tour d’absorption pour la production d’une solution de ClO2.
L’acide usé peut être utilisé pour l’acidification ou l’appoint de l’usine dans le système de chaudière de récupération. Le produit contient 8 g/L de dioxyde de chlore et est pratiquement exempt de chlore élémentaire (concentration Cl2 < 0,2 g/L).
Pour les applications à plus petite échelle comme le traitement de l’eau ou la production de biocides, le procédé SVP-Pure d’Eka Chemicals (Figure 3) offre une solution simple et à faible investissement. Ce processus utilise une solution pré-mélangée de chlorate et de peroxyde d’hydrogène ainsi que de l’acide sulfurique.
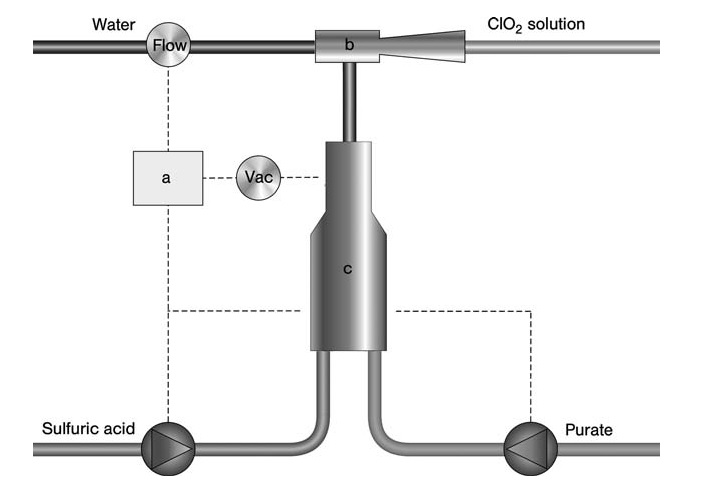
a) Contrôleur ; b) Éducteur; c) Réacteur
Tous les réactifs sont introduits simultanément dans un réacteur subatmosphérique à l’aide d’un éjecteur entraîné par un courant d’eau. Ce flux d’eau absorbe le ClO2 généré et les sous-produits pour former le produit final (dioxyde de chlore dans l’eau).
L’ensemble du système est compact et contrôlé par un microprocesseur, permettant une production à la demande avec application directe du produit. La teneur en ClO2 dans ce processus varie généralement de 1 à 1,5 g/L, avec des variantes atteignant jusqu’à 7 g/L pour les applications de blanchiment.
2.3. Production de dioxyde de chlore à partir de chlorate en utilisant du dioxyde de soufre comme agent réducteur
Le dioxyde de soufre (SO2) peut être utilisé comme agent réducteur dans les procédés à base de chlorate. Cette intégration offrait des avantages économiques et opérationnels, contribuant à la popularité du procédé Mathieson dans les années 1950.
Le procédé Mathieson, ainsi que les procédés Solvay et R2, ont joué un rôle important dans la production de dioxyde de chlore pour les applications de blanchiment de la pâte à papier. Cependant, son importance a diminué ces derniers temps.
Le processus Mathieson suit une réaction légèrement exothermique, représentée par l’équation :
2 NaClO3 + H2SO4 + SO2 → 2 ClO2 + 2 NaHSO4
Bien qu’une réaction concurrente puisse conduire à la formation de chlore, elle peut être supprimée et la majeure partie du chlore généré réagit davantage. Cependant, la cinétique de la réaction est relativement lente, ce qui entraîne une conversion incomplète du chlorate.
L’ajout de 1 à 10 % en poids de chlorure de sodium par rapport au chlorate est une pratique courante pour augmenter la vitesse de réaction. Cependant, cet ajout augmente également la formation de chlore sous-produit, ce qui peut être indésirable dans certaines applications.
La configuration du processus Mathieson ressemble beaucoup au processus HP-A (Figure 2). La principale différence réside dans l’absence d’arrivées de peroxyde d’hydrogène. Au lieu de cela, le dioxyde de soufre est introduit par l’air de pulvérisation.
2.4. Production de dioxyde de chlore à partir de chlorite de sodium
Le chlorite de sodium (NaClO2) peut également être utilisé comme matière première pour la génération de dioxyde de chlore, principalement pour des applications à petite échelle. Toutefois, certaines installations de traitement d’eau potable peuvent utiliser cette méthode pour une production à plus grande échelle (jusqu’à plusieurs tonnes par jour). Il existe deux méthodes principales :
- Par activation avec un acide
Dans ce processus, le chlorite réagit avec un acide (acide chlorhydrique, HCl), comme le montre l’équation suivante :
5 NaClO2 + 4 HCl → 4 ClO2 + 5 NaCl + H2O
L’acide sulfurique peut être un substitut, mais il entraîne des taux de production plus faibles en raison de l’absence de catalyse chlorure. Bien que plus coûteuse, avec un coût de production 25 % plus élevé, cette méthode offre un produit ClO2 sans chlore.
- Par activation au chlore
Cette méthode utilise le chlore élémentaire soit en phase gazeuse, soit dissous dans l’eau (où il s’hydrolyse en acide hypochloreux et en acide chlorhydrique). La réaction globale est illustrée dans l’équation :
2 NaClO2 + Cl2 → 2 ClO2 + 2 NaCl
Le procédé activé au chlore gazeux est depuis longtemps la norme de l’industrie. Ce système à deux alimentations exploite la réaction rapide entre le chlore moléculaire et les ions chlorite.
La méthode Rio Linda utilise des alimentations séparées de solution de chlorite de sodium et de chlore gazeux, leur permettant de réagir avant d’être aspirées dans l’application par un jet d’eau via un éjecteur qui crée la basse pression nécessaire.
2.5. Production de dioxyde de chlore par procédés électrochimiques
Le dioxyde de chlore peut être produit par des méthodes électrochimiques à partir de chlorite de sodium, généralement accompagné par une production d’hydroxyde de sodium. L’électrochimie permet un contrôle précis de la production de ClO2 ; cependant, les électrodes et les membranes sont sensibles aux impuretés, ce qui nécessite de l’eau déminéralisée pour un fonctionnement optimal.
L’oxydation du chlorite en dioxyde de chlore se produit au niveau de l’anode, et les ions sodium migrent à travers une membrane vers le côté cathode, où l’électrolyse de l’eau produit de l’hydrogène gazeux et des ions hydroxyde.
L’électrolyse peut également être utilisée pour générer l’acide nécessaire à l’activation du chlorite dans le procédé au chlorite de sodium.
Le dioxyde de chlore produit est séparé de la solution de chlorite par stripping à l’air avant d’être utilisé.
L’électrochimie peut également être utilisée pour minimiser la production de pâte de sel dans les procédés à grande échelle à base de chlorate. Cette méthode réduit la consommation d’acide sulfurique en utilisant des protons générés électrochimiquement et en éliminant les ions sodium grâce à la soude caustique coproduite.
Bien que bénéfiques pour l’environnement, ces processus électrochimiques nécessitent un investissement en capital élevé et une consommation d’énergie électrique importante.
2.6. Produits à base de dioxyde de chlore stabilisés
Divers fournisseurs commerciaux proposent des produits à base de dioxyde de chlore stabilisé. Ces produits sont tous des solutions tamponnées contenant des ions chlorite (ou chlorate) qui nécessitent une activation pour libérer du dioxyde de chlore.
Ces produits se présentent sous deux formes :
- Les solutions aqueuses sont des solutions tamponnées avec du chlorite ou du chlorate, nécessitant l’ajout d’acide pour libérer du dioxyde de chlore.
- Solides contiennent du chlorite ou du chlorate incorporé dans des matrices solides (gels ou absorbants) où le dioxyde de chlore est lié. L’activation est obtenue en chauffant ou en éliminant le dioxyde de chlore.
Les produits à base de dioxyde de chlore stabilisé sont utilisés dans diverses applications à petite échelle (moins de 5 kg/jour), telles que le contrôle des odeurs, le traitement de l’air, les applications biocides, la désinfection, et purification de l’eau.
3. Utilisations du dioxyde de chlore
Le dioxyde de chlore est utilisé dans divers secteurs, le blanchiment de la pâte à papier étant l’application dominante. Cependant, sa viabilité économique passe souvent inaperçue en raison de la nature des statistiques de marketing et de la presse spécialisée.
En raison de sa nature instable, ClO2 ne peut pas être stocké et doit être généré au point d’utilisation. Malgré cette limitation, il reste l’oxyde de chlore ou l’acide chlore-oxygène le plus précieux commercialement.
3.1. Utilisations dans le blanchiment de la pâte
Plus de 90 % de la production mondiale de pâte Kraft (bois dur et résineux) utilise du dioxyde de chlore dans les séquences de blanchiment sans chlore élémentaire (ECF). En effet, le ClO2 oxyde sélectivement la lignine, ce qui améliore le rendement de la pâte et maintient les propriétés mécaniques.
Bien que le potentiel de blanchiment du dioxyde de chlore soit connu depuis plus de 150 ans, son adoption généralisée n’a eu lieu que dans les années 1980. Les processus de production à grande échelle sûrs et fiables apparus dans les années 1940 ont contribué aux processus continus modernes utilisés aujourd’hui.
Le principal motif d’adoption du ClO2 dans le blanchiment de la pâte à papier était d’atténuer l’impact environnemental des composés organiques chlorés formés lors du blanchiment au chlore élémentaire. Depuis la fin des années 1980, le ClO2 a largement remplacé le chlore élémentaire.
Contrairement au chlore élémentaire (un puissant chlorateur universel), le dioxyde de chlore n’introduit pas d’atomes de chlore dans les cycles aromatiques lors du blanchiment. Cela élimine la formation de matières organiques toxiques et hautement chlorées comme les dioxines et les phénols polychlorés.
Bien que certains halogénures organiques adsorbables (AOX) soient toujours générés même avec du ClO2 pur, ils sont plus facilement biodégradables, ce qui entraîne une réduction impact environnemental des effluents des usines de pâte à papier.
Le blanchiment ECF et le blanchiment sans chlore total (TCF), lorsqu’ils sont opérés selon les meilleures pratiques, sont considérés comme acceptables pour l’environnement. Le blanchiment moderne implique une combinaison de produits chimiques et de processus pour obtenir une rentabilité, une qualité de pâte élevée et un faible impact sur l’environnement.
Les usines très performantes peuvent réaliser un blanchiment avec 8 à 16 kg de dioxyde de chlore par tonne de pâte.
3.2. Autres applications
Au-delà du blanchiment de la pâte à papier, le dioxyde de chlore est utilisé dans d’autres secteurs, souvent à plus petite échelle.
- Blanchiment des fibres textiles : Semblable au blanchiment de la pâte à papier, le dioxyde de chlore permet de blanchir des fibres naturelles (laine, coton) aux propriétés spécifiques.
- Traitement de l’eau : le dioxyde de chlore est utilisé dans des milliers d’usines de traitement de l’eau potable en raison de son efficacité et de sa sélectivité par rapport à des alternatives comme le chlore élémentaire, l’hypochlorite, l’ozone et la lumière UV. Il offre un contrôle supérieur des bactéries, des odeurs et du goût et ne génère pas de trihalométhanes comme le chlore et l’hypochlorite.
- Industrie alimentaire : ClO2 trouve une application dans le contrôle microbien dans l’industrie alimentaire.
- Le dioxyde de chlore est utilisé pour la désinfection des eaux usées et le contrôle des dépôts visqueux dans les machines à papier.
- Le dioxyde de chlore est utilisé dans les champs pétrolifères pour éliminer les biofilms et neutraliser le sulfure d’hydrogène et le sulfure ferreux, qui peuvent provoquer une contre-pression dans les puits. De plus, il est utilisé pour contrôler les odeurs dans l’industrie pétrolière.
- Une application émergente du ClO2 consiste à réduire les gaz nitreux issus des processus d’incinération (chaudières à charbon, incinérateurs de déchets et chaudières de récupération). Cette application offre des efficacités d’élimination élevées (plus de 90 %) pour les NOx et le mercure avec une bonne économie.
4. Toxicologie du dioxyde de chlore

Le dioxyde de chlore présente des dangers spécifiques pour la santé humaine et des explosions potentielles. Cette section décrit les principales considérations de sécurité pour la manipulation du ClO2.
Effets et limites de l’exposition
- Le rejet de dioxyde de chlore gazeux ou liquide est facilement détectable en raison de son odeur âcre, semblable à celle du chlore.
- De faibles concentrations irritent le système respiratoire et les yeux.
- Des concentrations plus élevées peuvent provoquer une toux sévère, un œdème pulmonaire (accumulation de liquide dans les poumons) et même la mort.
- Aucune donnée humaine n’existe sur la cancérogénicité ou la génotoxicité du dioxyde de chlore.
- Les limites d’exposition professionnelle sont :
- Moyenne pondérée dans le temps (TWA) sur 8 heures : 0,1 ppm
- Limite d’exposition à court terme (STEL) : 0,3 ppm
Pratiques de manipulation sûres
- Effectuer la manipulation et le stockage dans des zones bien ventilées.
- Maintenez des températures de stockage fraîches et utilisez des quantités minimales de solution.
- Mettre en œuvre des pratiques de gestion de la sécurité des processus.
- Fournir une formation et un équipement de sécurité approprié (protection respiratoire, lunettes anti-éclaboussures de produits chimiques, gants et bottes).
- Équiper les usines et les points d’application de ClO2 avec des alarmes de détection de fuite de gaz réglées à 0,1 ppm (limite TWA).
Risques d’explosion
- Le dioxyde de chlore gazeux est explosif à des concentrations supérieures à 10 % dans l’air (pression partielle de 10 kPa).
- La décomposition en chlore et en oxygène est exothermique et augmente le volume de gaz, entraînant une augmentation de la pression et une onde de choc potentielle.
- La décomposition peut être initiée par des impuretés d’oxyde métallique, des surfaces chaudes, une dilution rapide de l’acide, des chocs de pression, la chaleur ou la lumière du soleil.
Références
- Chlorine Oxides and Chlorine Oxygen Acids; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a06_483.pub2
- Halogens; Descriptive Inorganic Chemistry. – https://www.sciencedirect.com/science/article/abs/pii/B9780128046975000178
- The Chemistry of Chlorine Dioxide. – https://onlinelibrary.wiley.com/doi/10.1002/9780470166161.ch3


