Acide trichloroacétique : propriétés, production et utilisations

L’acide trichloroacétique (TCA), également connu sous le nom d’acide trichloroéthanoïque, est un solide cristallin hygroscopique incolore de formule chimique Cl3CCOOH. C’est un acide fort et une substance corrosive qui peut endommager la peau, les yeux et d’autres tissus au contact.
Table des matières
1. Propriétés physiques de l’acide trichloroacétique
L’acide trichloroacétique [76-03-9] existe sous forme de cristaux hygroscopiques rhomboédriques à température et pression standard avec une odeur âcre. Il est hautement soluble dans l’eau et dans divers solvants organiques. Les principales propriétés physiques incluent :
- Masse molaire : 163,4 g/mol
- Point de fusion : 59,2 °C
- Point d’ébullition : 197,6 °C à 101,3 kPa ; ~107 °C sous pression réduite (2,8 kPa)
- Densité à 60 °C : 1,63 g/cm³
- Indice de réfraction à 65 °C : 1,459
- pKa : 0,70
- Moment dipolaire : 3,23 D
2. Propriétés chimiques de l’acide trichloroacétique
L’acide trichloroacétique présente une forte acidité (pKa = 0,7) en raison de la substitution complète des hydrogènes méthyliques par des atomes de chlore, ce qui le rend plus stable que l’acide chloroacétique et l’acide dichloroacétique et moins sensibles aux réactions de substitution des atomes de chlore.
Dans des conditions aqueuses, des températures élevées induisent la décomposition de l’acide trichloroacétique en chloroforme et du dioxyde de carbone. Ce processus est accéléré en présence de bases organiques ou inorganiques, tandis que l’aniline, le résorcinol et le charbon actif servent de catalyseurs dans des conditions anhydres.
La décomposition purement thermique ne se produit qu’au-dessus du point d’ébullition et produit des hydrocarbures chlorés, du monoxyde de carbone, du dioxyde de carbone et du phosgène.
L’acide trichloroacétique forme des sels avec diverses bases inorganiques et organiques. Ces sels se décomposent lorsqu’ils sont chauffés dans des environnements aqueux, libérant du chloroforme.
3. Production d’acide trichloroacétique
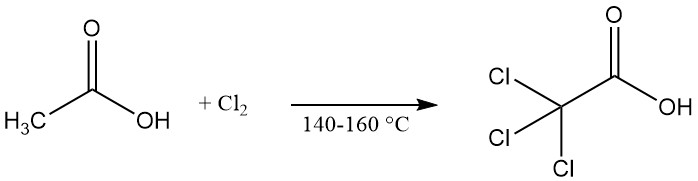
L’acide trichloroacétique est produit commercialement par la chloration de l’acide acétique, de l’acide chloroacétique ou de ses liqueurs mères à des températures élevées (140-160 °C). L’hypochlorite de calcium peut être utilisé comme catalyseur pour accélérer la réaction.
L’utilisation de sels de métaux lourds comme catalyseurs reste controversée. Bien que des exemples tels que des composés de fer et de cuivre aient été utilisés, des préoccupations concernant leur élimination par précipitation avec de l’acide sulfurique ou phosphorique persistent.
Les approches alternatives explorées incluent l’utilisation d’acide phosphorique à 2 % ou la combinaison de catalyseurs avec de la lumière UV. Des méthodes sans catalyseur ont également été développées.
Le produit brut résultant, contenant généralement environ 95 % d’acide trichloroacétique, subit une purification par cristallisation à l’état fondu. Cela élimine efficacement les impuretés présentes dans la liqueur mère. Une amélioration supplémentaire de la pureté peut être obtenue via une centrifugation ou des étapes supplémentaires de recristallisation.
Lorsque l’acide sulfurique est utilisé comme catalyseur à des températures de réaction plus élevées (jusqu’à 180 °C), une purification post-production n’est pas nécessaire.
4. Utilisations de l’acide trichloroacétique
Avant les années 1990, la principale application de l’acide trichloroacétique était la production de son sel de sodium, utilisé comme herbicide sélectif et en combinaison avec le 2,4-D et Formulations 2,4,5-T pour un contrôle total des mauvaises herbes. Cependant, en raison de préoccupations écotoxicologiques, cette application a considérablement diminué.
Au-delà des herbicides, l’acide trichloroacétique trouve diverses utilisations dans divers domaines :
- Dans le traitement des surfaces métalliques, l’acide trichloroacétique est utilisé comme agent de gravure et de décapage
- Il est utilisé comme agent gonflant et solvant dans l’industrie du plastique.
- En biochimie, pour la précipitation des protéines, de l’albumine, de l’ADN et de l’ARN
- Agent auxiliaire en finissage textile
- Il est ajouté comme additif pour améliorer les propriétés haute pression des huiles lubrifiantes.
- En raison de sa nature corrosive, l’acide trichloroacétique est utilisé dans des environnements contrôlés pour éliminer les verrues, la peau dure et traiter des affections cutanées spécifiques.
- L’acide trichloroacétique et ses esters servent de matières premières précieuses pour diverses synthèses organiques.
- L’acide présente des réactions colorées distinctives, permettant l’identification de divers composés organiques en chimie analytique.
5. Dérivés de l’acide trichloroacétique
5.1. Chlorure de trichloroacétyle
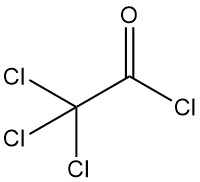
Le chlorure de trichloroacétyle [76-02-8] a la formule chimique Cl3CCOCl et une masse molaire de 197,9 g/mol, possède des propriétés physiques similaires au chlorure de dichloroacétyle :
- Point d’ébullition : 118°C à 101,3 kPa
- Densité à 20°C : 1,620 g/cm³
- Indice de réfraction à 20°C : 1,4695
Le chlorure de trichloroacétyle s’hydrolyse facilement en acide trichloroacétique et acide chlorhydrique à 75–85 °C dans l’eau. Il réagit avec des solutions d’hydroxyde d’ammonium ou de carbonate de sodium concentrées pour former les sels correspondants.
Le chlorure de trichloroacétyle est produit par diverses méthodes :
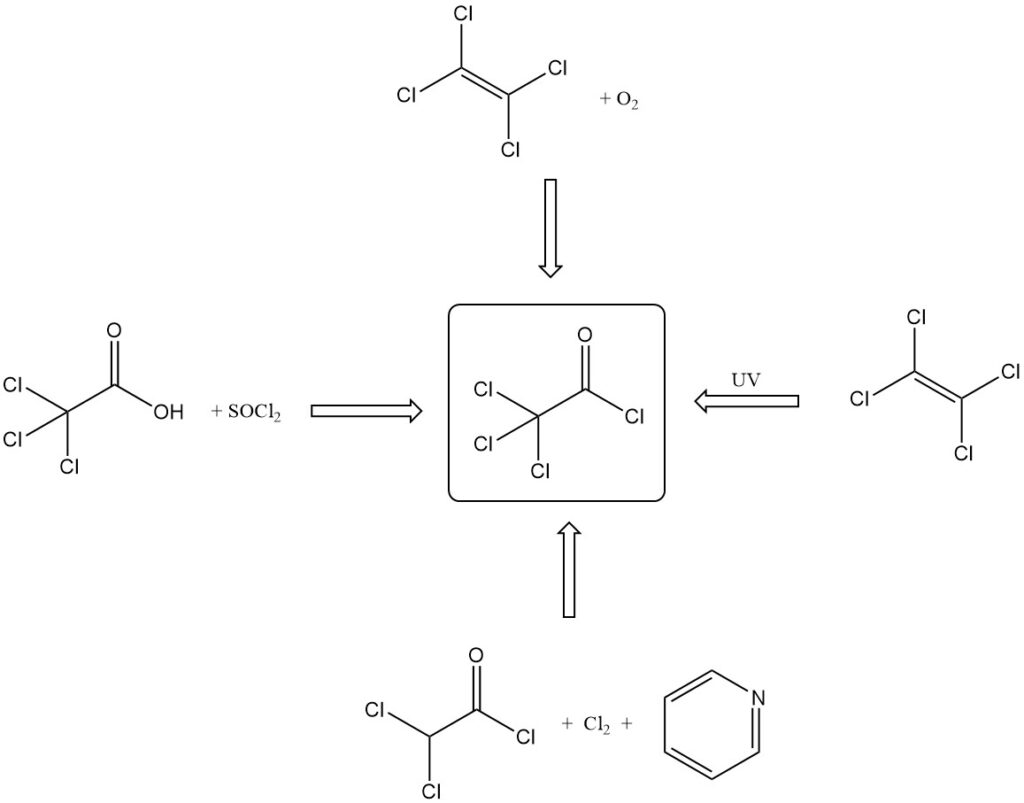
- Par réaction de l’acide trichloroacétique avec des chlorures d’acide inorganique (SOCl2, PCl3 ) ou P2O5 et HCl.
- Par oxydation du tétrachloroéthylène avec de l’acide sulfurique fumant, de l’oxygène ou de l’acide nitrique fumant et de l’acide sulfurique.
- Par oxydation photochimique du tétrachloroéthylène avec de la lumière UV, une irradiation radioactive ou une sensibilisation au chlore/iode.
- Par la réaction du chlorure de dichloroacétyle avec la pyridine et le chlore.
Le chlorure de trichloroacétyle est utilisé pour produire des esters, des anhydrides et des pesticides de l’acide trichloroacétique (par exemple, le chlorpyrifos) et comme matière première pour la synthèse de l’acide trifluoroacétique.
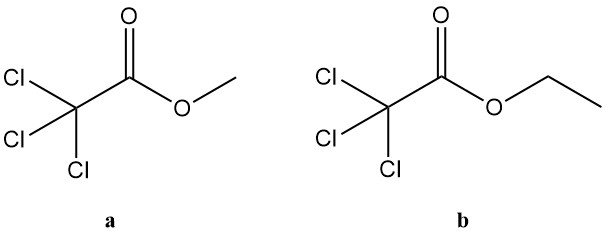
5.2. Esters d’acide trichloroacétique
Les esters de l’acide trichloroacétique englobent un large groupe de composés, mais seuls les dérivés méthyliques et éthyliques présentent un intérêt industriel significatif. Ces deux esters trouvent des applications dans divers domaines :
- Solvants : bien qu’il ne s’agisse pas de leur utilisation principale, les trichloroacétates de méthyle et d’éthyle peuvent fonctionner comme des solvants de niche lorsque cela est nécessaire.
- Ces esters servent de matières premières précieuses pour la synthèse d’autres composés, en particulier d’amides et d’esters de polyalcool. Ces dérivés ont été explorés pour leur utilisation potentielle en tant que plastifiants, offrant des fonctionnalités ou des propriétés spécifiques qui ne sont pas facilement disponibles dans les plastifiants conventionnels.
- Le trichloroacétate d’éthyle trouve une application plus large en tant que co-catalyseur dans les polymérisations de type Ziegler.
À titre de référence, voici quelques propriétés physiques clés des deux esters industriellement pertinents :
a. Trichloroacétate de méthyle :
- Numéro CAS : 598-99-2
- Formule : Cl3CCOOCH3
- Masse molaire : 177,43 g/mol
- Point d’ébullition : 153 °C (à 101,3 kPa)
- Densité : 1,4864 g/cm³ (à 20 °C)
- Indice de réfraction : 1,4572 (à 20 °C)
b. Trichloroacétate d’éthyle :
- Numéro CAS : 515-84-4
- Formule : Cl3CCOOCH2CH3
- Masse molaire : 191,45 g/mol
- Point d’ébullition : 167,5 °C (à 101,3 kPa)
- Densité : 1,3823 g/cm³ (à 20 °C)
- Indice de réfraction : 1,4505 (à 20 °C)
5.3. Trichloroacétate de sodium
Le trichloroacétate de sodium (Cl3CCOONa), le seul sel d’acide trichloroacétique d’importance industrielle, présente plusieurs propriétés clés :
Propriétés physiques :
- Un solide incolore se décompose en dessous de son point de fusion.
- Très soluble dans l’eau et le méthanol, modérément soluble dans d’autres solvants polaires .
- La solubilité dans l’eau augmente avec la température (50 % à 5 °C, 60 % à 20 °C, 70 % à 40 °C).
Propriétés chimiques :
- Stable à l’état sec mais subit une hydrolyse dans une solution aqueuse, générant du bicarbonate de sodium et de l’acide dichloroacétique.
- La décomposition thermique à des températures élevées (125 – 170 °C) produit du chlorure de sodium, du chlorure de trichloroacétyle, du monoxyde de carbone et du dioxyde de carbone.
- Il réagit avec les oléfines si des catalyseurs de transfert de phase sont utilisés
Production :
Le trichloroacétate de sodium est produit industriellement en neutralisant l’acide trichloroacétique avec de l’hydroxyde de sodium ou du carbonate.
Applications :
- Le trichloroacétate de sodium, associé à des agents réducteurs et à des sels métalliques, favorise la polymérisation vinylique.
- Il facilite l’absorption et la dispersion des colorants dans les fibres de polyester et de cellulose.
- Dans le papier diazo développé par la chaleur, il est utilisé pour libérer la base à des températures élevées (100-200 °C)
- Il était auparavant utilisé comme herbicide pour lutter contre les mauvaises herbes monocotylédones, avec une demi-vie dans le sol de 1 à 2 mois ; cependant, les préoccupations concernant l’écotoxicité ont conduit à son interdiction généralisée aux États-Unis, au Canada, dans l’Union européenne et en Amérique du Sud.
6. Toxicologie de l’acide trichloroacétique et du trichloroacétate
L’acide trichloroacétique présente plusieurs risques pour la santé en raison de sa nature corrosive et de sa capacité à précipiter les protéines. Bien qu’il ne soit pas facilement absorbé par la peau, il peut provoquer une irritation importante des yeux et de la peau au contact.
Données clés sur la toxicité :
- DL50 orale : 3 320–5 060 mg/kg (rats)
- Dose mortelle la plus faible (chiennes) : 1 590 mg/kg
- Inhalation (4 heures, dose élevée) : Aucun effet significatif observé chez les animaux
- Exposition humaine aiguë : brûlures cutanées et oculaires, irritation, effets gastro-intestinaux
- Données chroniques : Limées, affectent potentiellement les voies respiratoires supérieures
- TLV-TWA proposée : 1 ppm (7 mg/m³)
Les préoccupations concernant la sécurité de l’acide trichloroacétique incluent :
- Dommages cutanés et oculaires : Ses propriétés corrosives peuvent provoquer des brûlures et des irritations.
- Liaison aux protéines : déplace les médicaments des sites de liaison aux protéines, altérant potentiellement leur efficacité.
- Données chroniques limitées : Les effets potentiels à long terme nécessitent une enquête plus approfondie.
Le trichloroacétate a une dose journalière provisoirement tolérée (DPT) de 0,075 mg/kg de masse corporelle. Cette valeur est basée sur une étude d’alimentation subchronique de chiens, dans laquelle divers effets indésirables ont été observés à des doses ≥ 2 000 mg/kg dans la nourriture.
Des effets indésirables ont été observés, tels qu’une perte de masse corporelle, des malaises, des lésions tissulaires (gencives, muqueuse buccale), des modifications des globules blancs, des résultats urinaires anormaux, du foie. et des lésions cardiaques, une atrophie musculaire et une production altérée de spermatozoïdes.
Le niveau d’effet non toxique était de 500 mg/kg dans l’alimentation. Les données in vitro ne suggèrent aucun potentiel mutagène.
Référence
- Chloroacetic Acids; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a06_537.pub3
