Qu’est-ce que l’acide L-ascorbique ?
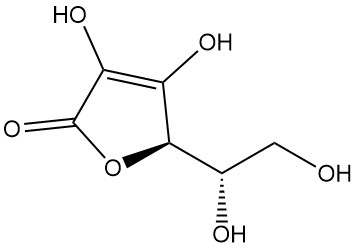
L’acide L-ascorbique, également connu sous le nom de (2R)-2-[(1S)-1,2-dihydroxyéthyl]-3,4-dihydroxy-2H-furan-5-one, est la désignation IUPAC de la vitamine C. Il s’agit d’une poudre ou d’un cristal blanc ou inodore au goût acide que l’on trouve dans la nature et qui a une activité antiscorbutique, ce qui signifie qu’il prévient le scorbut, une maladie causée par une carence en vitamine C.
L’acide L-ascorbique a été isolé pour la première fois en 1928 et sa structure a été déterminée cinq ans plus tard. Aujourd’hui, l’acide L-ascorbique est la vitamine la plus produite au monde, avec une production annuelle estimée à environ 150 000 tonnes.
Une caractéristique clé de l’acide L-ascorbique est son oxydation réversible en acide déhydro-L-ascorbique. Ce système redox permet à l’acide L-ascorbique d’agir comme agent réducteur.
Parmi les quatre diastéréomères de l’acide ascorbique, seul l’acide D-araboascorbique (également connu sous le nom d’acide isoascorbique, d’acide érythorbique et d’acide D-érythro-hex-2-énoïque γ-lactone) présente une faible activité antiscorbutique (environ 5 % de celle de l’acide L-ascorbique).
Table des matières
1. Propriétés physiques de l’acide L-ascorbique
L’acide L-ascorbique est une poudre cristalline blanche à jaune très pâle qui est très soluble dans l’eau (1 g dans 3 ml), modérément soluble dans l’éthanol, le propylène glycol et le glycérol, et insoluble dans l’éther, le chloroforme, le benzène, l’éther de pétrole, les huiles, les graisses et les solvants gras.
Un résumé des propriétés physiques de l’acide L-ascorbique est donné dans le tableau suivant.
| Propriété | Valeur |
|---|---|
| Numéro CAS | [50-81-7] |
| Formule | C6H8O6 |
| Poids moléculaire | 176,13 g/mol |
| Point de fusion | 190–192 °C (décomposition) |
| Densité | 1,65 g/cm3 |
| Rotation optique | [α]20H2O : +20,5° à +21° (c = 1) |
| [α]20EtOH : +52° (c = 0,5) | |
| [α]20MeOH : +49,5° (c = 0,5) | |
| pH | 3 (5 g/L) 2 (50 g/L) |
| pK1 | 4,17 (3-OH) |
| pK2 | 11,57 (2-OH) |
| Potentiel redox | E = +0,127 V (pH=5) |
2. Propriétés chimiques de l’acide L-ascorbique
L’acide L-ascorbique existe sous au moins cinq formes tautomères. La forme la plus répandue, le tautomère (1), représente la structure cristalline et domine dans les solutions aqueuses acides (pH = 2). Les groupes 2-OH et 3-OH sont tous deux acides, formant des sels monobasiques avec les bases ; cependant, les sels dibasiques sont instables.
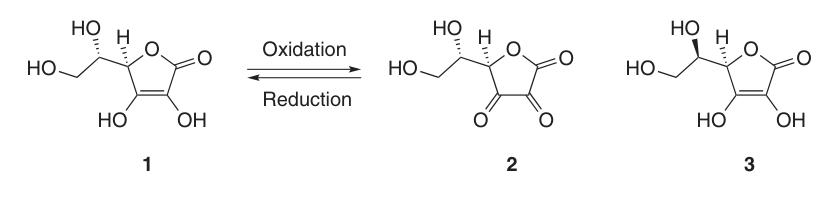
Dans l’ascorbate de sodium et de calcium, l’ion métallique interagit avec l’atome d’oxygène en position 3 (4a). La charge négative du monoanion ascorbate est délocalisée dans le système d’électrons π, ce qui contribue à la stabilité de son cycle lactone dans les milieux alcalins.
L’acide L-ascorbique subit facilement une isomérisation en acide L-isoascorbique lors de son ébullition dans l’hydroxyde de potassium méthanolique.
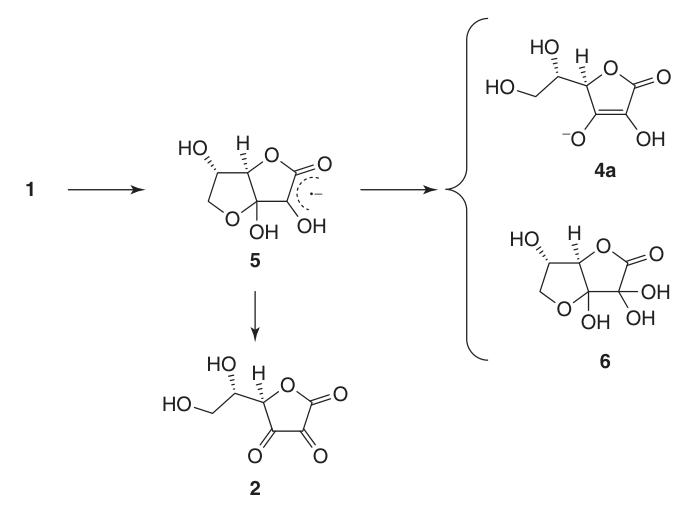
En raison de sa structure énédiol, l’acide L-ascorbique agit comme un puissant agent réducteur. L’oxydation de l’acide ascorbique (1) produit de l’acide déhydroascorbique (2), en passant par l’intermédiaire anion radical, l’acide semi-déhydroascorbique (5).
L’acide semi-déhydroascorbique est un acide fort (pKa = 0,45) et un capteur de radicaux qui peut réagir avec lui-même pour régénérer l’acide ascorbique et le composé (6) ou réagir avec d’autres radicaux libres.
Les métaux de transition comme le Cu et le Fe catalysent l’autoxydation de l’acide ascorbique en acide déhydroascorbique (2). Ces métaux forment un complexe intermédiaire ternaire avec l’oxygène, qui se dissocie pour donner de l’acide déhydroascorbique (2), du peroxyde d’hydrogène et l’ion métallique.
Le processus d’autoxydation est accéléré au-dessus de pH 7 et peut être inhibé en complexant les ions métalliques avec des agents chélateurs comme l’EDTA, l’acide métaphosphorique, l’acide citrique ou l’acide oxalique.
Le traitement de l’acide ascorbique avec de l’oxygène dans du méthanol contenant du charbon actif forme un adduit de méthanol sirupeux qui, après un traitement ultérieur, fournit de l’acide déhydroascorbique (2) sous forme de dimère cristallin avec un rendement de 64 %.
À pH 2,5–5,5 dans une solution aqueuse et à 4 °C, le composé (2) est stable pendant plusieurs jours ; cependant, des agents réducteurs comme le sulfure d’hydrogène, le dithiothréitol ou la cystéine peuvent le reconvertir quantitativement en acide ascorbique.
Alors que l’acide déhydroascorbique (2) conserve l’activité de la vitamine C, l’ouverture irréversible du cycle lactone pour former l’acide 2,3-dicétogulonique (8) conduit à la perte complète de cette activité.
L’acide L-ascorbique subit une dégradation dans des solutions aqueuses dans des conditions aérobies et anaérobies. La vitesse de décomposition dépend de facteurs tels que le pH, la température, la lumière, la concentration et la présence de catalyseurs à base de métaux lourds.
La présence d’oxygène accélère considérablement le processus de dégradation par rapport aux conditions anaérobies. Les produits d’oxydation finaux comprennent l’acide L-thréonique (9) et l’acide oxalique. Dans des conditions anaérobies, la dégradation conduit au furfural (10) et au CO2.
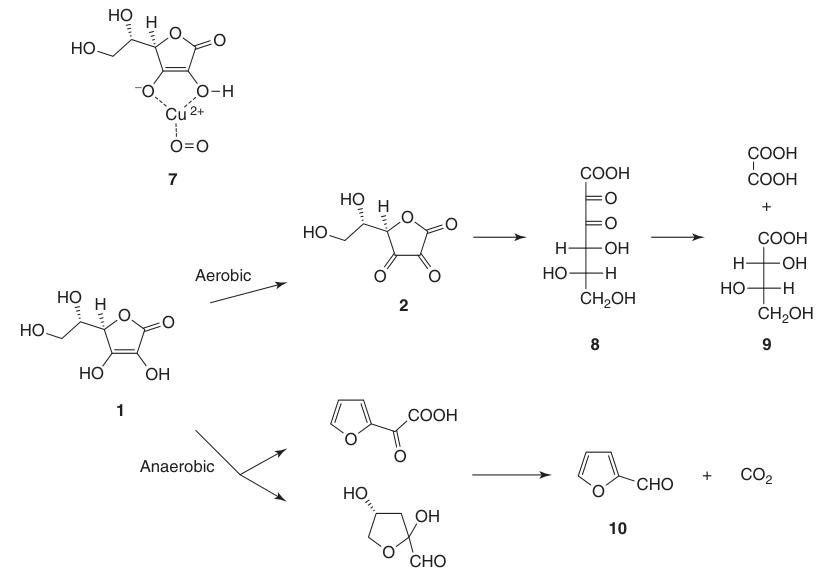
L’acide L-ascorbique solide est très stable pendant une longue période en l’absence d’humidité et de lumière.
La protection contre la dégradation oxydative dans les applications aqueuses peut être obtenue par enrobage avec des graisses et des polymères ou par substitution chimique des groupes hydroxyles ènediol (L-ascorbate 2-sulfate, L-ascorbate 2-phosphate et acide 2-O-méthyl ascorbique).
3. Sources naturelles de vitamine C
L’acide ascorbique (vitamine C) est un composé largement répandu dans les plantes et certains animaux. Il est particulièrement abondant dans les plantes vertes, les concentrations les plus élevées étant observées dans les fruits tropicaux et les feuilles de glaïeul. Sa présence dans les levures et les procaryotes non cyanobactériens reste incertaine.
Historiquement, pendant les mois d’hiver, l’apport en vitamine C dépendait fortement des légumes-racines comme les pommes de terre et le chou. Aujourd’hui, avec un accès toute l’année aux fruits et légumes frais, les sources alimentaires de vitamine C sont plus diversifiées. Cependant, les processus de stockage et de cuisson peuvent contribuer à la dégradation de la vitamine C.
La distribution de la vitamine C dans les tissus végétaux varie. En particulier, certaines plantes, comme les espèces de Brassica et les espèces d’Elaeocarpus, stockent la vitamine C sous des formes liées, connues respectivement sous le nom d’ascorbigène et d’élaeocarpusine.
La vitamine C est également présente chez les animaux, mais à des concentrations plus faibles que dans les plantes. Les niveaux les plus élevés se trouvent dans les organes endocriniens des mammifères comme les vaches (hypophyse et glandes surrénales).
Certaines espèces animales, dont les humains, les primates, les cobayes, les mammifères volants, certains oiseaux, les poissons et les insectes, n’ont pas la capacité de synthétiser la vitamine C et dépendent de l’apport alimentaire.
| Groupe alimentaire | Vitamine C (mg/100 g) |
|---|---|
| Poisson | 0–4 |
| Asperges | 7–25 |
| Viande (bœuf, porc) | 0–10 |
| Haricots | 5–30 |
| Lait (vache) | 1–2 |
| Brocoli | 20–100 |
| Fruits (pommes, cerises, kiwis, oranges) | 4–180 |
| Légumes (brocoli, choux de Bruxelles, chou-fleur, épinards, navets) | 20–90 |
| Légumes-racines (carottes, pommes de terre) | 2–20 |
| Céréales (avoine, seigle, blé) | <1 |
| Riz | 0 |
4. Production industrielle d’acide L-ascorbique
La première synthèse réussie d’acide L-ascorbique a eu lieu avant même que sa structure chimique complète ne soit déterminée. Dans ce procédé, la L-xylosone (11) a réagi avec du cyanure de potassium pour former du l-xylonitrile (12), qui, après lactonisation et énolisation, a donné de l’acide L-ascorbique à environ 40 %.
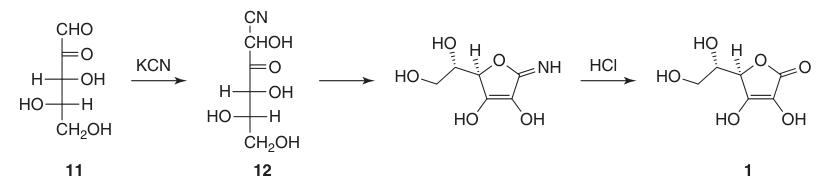
Cependant, un inconvénient majeur de cette synthèse initiale était la difficulté et le coût associés à l’obtention de la L-xylosone (11).
Heureusement, environ un an plus tard, Reichstein et Grüssner ont publié une méthode plus pratique de synthèse de l’acide L-ascorbique qui utilise le D-glucose (13) (un sucre C6) facilement disponible comme matière première, et elle est devenue la voie de production commerciale dominante pendant plus de 60 ans, avec des améliorations mineures en cours de route.
Depuis les années 1980, le processus de fabrication a subi un changement important. Le sorbitol est devenu la matière première préférée, avec une oxydation fermentative en deux étapes utilisée pour produire de l’acide 2-cétogulonique.
Si l’hydrogénation du glucose reste une méthode de production de sorbitol, elle n’est pas toujours effectuée par le fabricant final d’acide ascorbique.
Malgré l’évolution vers la fermentation, le concept global derrière le processus moderne conserve son lien avec la synthèse Reichstein originale. La différence clé réside dans l’utilisation de l’oxydation microbienne au lieu de méthodes chimiques.
4.1. Production d’acide L-ascorbique par synthèse Reichstein
La synthèse Reichstein de l’acide L-ascorbique est une série de réactions chimiques simples et à haut rendement qui évitent le clivage ou la formation de liaisons carbone-carbone.
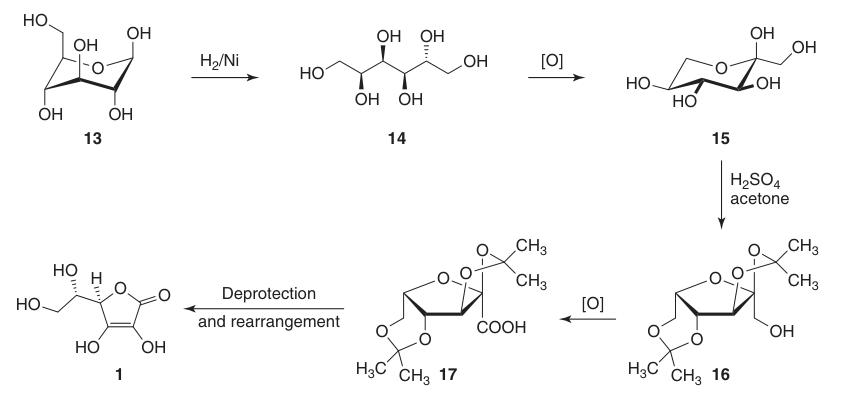
Elle réduit la position C-1 du D-glucose (13) et oxyde les positions 5 et 6, tout en maintenant la chiralité en C-2 et C-3. Cela conduit finalement à la configuration L-thréo souhaitée en C-4 et C-5 dans le produit final.
La synthèse classique de Reichstein-Grussner commence par réduire le D-glucose (13) en D-sorbitol (14) en utilisant l’hydrogénation sur un catalyseur au nickel. Le D-sorbitol est oxydé microbiologiquement en L-sorbose (15) par la bactérie Acetobacter xylinum.
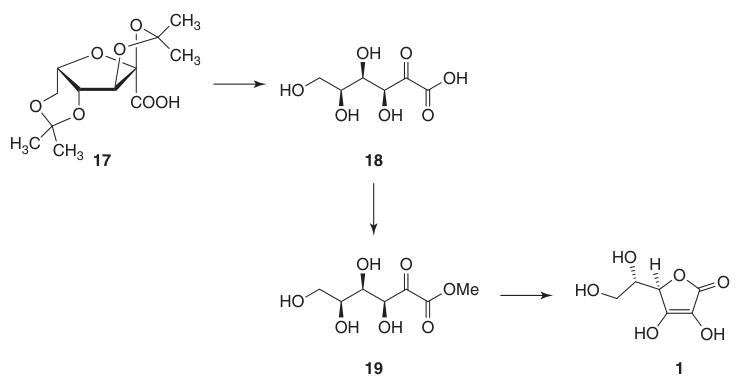
Le L-sorbose (15) est traité avec de l’acétone et de l’acide sulfurique à basse température pour former l’intermédiaire protégé 2,3:4,6-di-O-isopropylidène-α-L-sorbofuranose (16).
Cette protection des groupes hydroxyles en C-2, C-3, C-4 et C-6 permet une oxydation à haut rendement en acide di-O-isopropylidène-2-cétogulonique en utilisant du permanganate de potassium dans une solution alcaline. La déprotection avec de l’eau chaude donne l’acide 2-céto-L-gulonique (18).
L’acide L-ascorbique est produit en chauffant l’acide 2-céto-L-gulonique (18) dans de l’eau à 100 °C pour obtenir un rendement de 20 % ou par estérification suivie d’une acidification pour obtenir un rendement de 70 %.
Le rendement global d’acide L-ascorbique à partir de D-glucose (13) en utilisant cette méthode est d’environ 15 à 18 %.
4.2. Fabrication industrielle par la voie de Reichstein
La transformation du procédé classique de Reichstein en une méthode commercialement viable a nécessité une optimisation significative de chaque étape de réaction. Ces avancées ont englobé des modifications à la fois techniques et chimiques et ont abouti à des rendements d’étapes individuelles dépassant 90 %, ce qui conduit à un rendement global d’acide L-ascorbique à partir de D-glucose (13) d’environ 60 %.
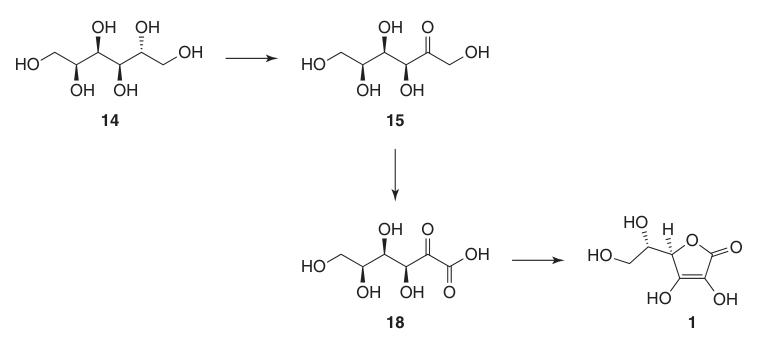
Les principales étapes et optimisations sont les suivantes :
1. D-sorbitol (14)
L’hydrogénation à haute pression du D-glucose (13) avec un catalyseur au nickel de Raney à des températures élevées permet d’obtenir des rendements quasi quantitatifs de D-sorbitol (14) avec une formation minimale de sous-produits tels que le D-mannitol et le L-iditol.
La solution de sorbitol est directement utilisée dans la fermentation sans purification supplémentaire, il faut donc du glucose de départ de haute qualité.
2. L-sorbose (15)
L’oxydation microbienne de solutions stériles de D-sorbitol (14) à l’aide de souches telles que Gluconobacter oxydans produit efficacement du L-sorbose (15) avec une conversion supérieure à 90 %.
Les fermentations à grande échelle nécessitent un contrôle strict du pH (4-6), de la température (30-35 °C) et des conditions stériles pour minimiser la perte de produit pendant l’oxydation et le traitement par filtration et cristallisation.
3. 2,3:4,6-Di-O-isopropylidène-α-L-sorbofuranose (16)
La protection des groupes 2,3- et 4,6-hydroxyles dans le L-sorbose (15) est obtenue par formation de cétals cycliques avec de l’acétone et de l’acide sulfurique en excès comme catalyseurs ou agents déshydratants à basse température (par exemple, 4 °C).
Le produit principal est le 2,3:4,6-di-O-isopropylidène-α-L-sorbofuranose (16), avec des dérivés monoisopropylidène comme sous-produits récupérables.
4. Acide 2,3:4,6-di-O-isopropylidène-2-céto-L-gulonique (17)
A l’origine, l’oxydation du 2,3:4,6-di-O-isopropylidène-α-L-sorbofuranose (16) en acide 2,3:4,6-di-O-isopropylidène-2-céto-L-gulonique (17) utilisait du KMnO4 à des températures élevées dans de l’hydroxyde de sodium dilué pour obtenir environ 90 % de produit.
Des alternatives plus rentables ont été développées pour les procédés continus tels que l’oxydation de l’hypochlorite avec du chlorure/sulfate de nickel catalytique à 60 °C, qui fournit un rendement supérieur à 93 %, et l’oxydation électrochimique utilisant des électrodes en nickel/oxyde de nickel en solution alcaline.
L’oxydation d’un catalyseur métallique (palladium ou platine sur carbone) avec de l’air ou de l’oxygène dans une solution alcaline est une autre méthode qui offre de bons rendements.
5. Acide L-ascorbique (1)
La conversion de l’acide 2,3:4,6-di-O-isopropylidène-2-céto-L-gulonique (17) en acide L-ascorbique peut être réalisée par deux méthodes :
- Déprotection en acide 2-céto-L-gulonique (18), suivie d’une estérification avec du méthanol et d’une cyclisation catalysée par une base.
- Cyclisation catalysée par un acide direct de l’acide ascorbique à partir de l’acide 2-céto-L-gulonique protégé ou déprotégé (18).
La méthode catalysée par une base utilise le méthyl 2-céto-L-gulonate (19), préparé à partir de l’acide 2-céto-L-gulonique (18) par réaction avec du méthanol en présence d’un acide. Les réactions ultérieures avec des bases comme le carbonate acide de sodium produisent de l’ascorbate de sodium avec un rendement élevé.
La première voie acide-catalysée pour l’acide ascorbique est apparue peu après la découverte du procédé Reichstein.
4.3. Production moderne d’acide ascorbique : remplacement de l’oxydation chimique par la fermentation
La conversion directe du L-sorbose (15) en acide 2-céto-L-gulonique (18) (2-KGA), un intermédiaire crucial dans la synthèse de la vitamine C, a été une cible majeure d’amélioration. Alors que l’oxydation chimique utilisant des catalyseurs au platine ou à l’or-platine a obtenu un certain succès, la fermentation s’est avérée être une approche plus évolutive et plus efficace.
Les premières tentatives ont été menées en utilisant Gluconobacter pour l’oxydation fermentaire. Cependant, une percée a eu lieu dans les années 1980 avec la découverte de Ketogulonicigenium vulgare par l’Académie chinoise des sciences.
Ce micro-organisme offrait le potentiel de remplacer complètement les étapes d’oxydation chimique du procédé Reichstein. Aujourd’hui, la quasi-totalité de la production mondiale de vitamine C repose sur la fermentation 2-KGA (18) à partir du L-sorbose (15) par Ketogulonicigenium vulgare.
Les étapes initiales de conversion du D-glucose en L-sorbose (15) restent largement inchangées par rapport à la méthode Reichstein développée dans les années 1930. La conversion ultérieure du L-sorbose en acide L-ascorbique utilise désormais un processus de fermentation en deux étapes qui domine dans le monde entier :
- Le D-sorbitol (14) obtenu commercialement est fermenté avec Gluconobacter oxydans pour produire du L-sorbose (15).
- Le bouillon de L-sorbose (15) stérilisé subit une oxydation supplémentaire en 2-KGA (18) par une fermentation mixte impliquant Ketogulonicigenium vulgare et Bacillus megaterium. Bacillus megaterium joue un rôle de soutien, permettant à Ketogulonicigenium, qui a des besoins nutritionnels limités, de prospérer sur un milieu simple et peu coûteux.
Ce processus de fermentation en deux étapes permet une oxydation rapide et efficace du L-sorbose (15) en 2-KGA (18), avec des titres rapportés dépassant 100 g/L et des rendements d’environ 90 % à partir du L-sorbose en 40 heures.
Des progrès récents ont éliminé le besoin de stérilisation intermédiaire du L-sorbose dans certains processus.
La combinaison des deux étapes de fermentation dans une seule cuve a été explorée. Gluconobacter oxyde d’abord le D-sorbitol (14) en L-sorbose (15), suivi de la croissance du Ketogulonicigenium et de l’oxydation du L-sorbose en 2-KGA (18).
Cette approche nécessite un timing minutieux pour empêcher l’oxydation indésirable du C-1 du D-sorbitol par l’enzyme de Ketogulonicigenium. Malgré des résultats prometteurs avec des titres de 2-KGA (18) de 140 g/L et des rendements de conversion élevés, la viabilité commerciale de ce procédé à cuve unique reste incertaine.
Le passage de l’oxydation chimique à la fermentation a révolutionné la production de vitamine C, offrant un procédé plus efficace, évolutif et potentiellement plus simple.
4.4. Autres méthodes de production d’acide ascorbique
Tous les procédés de production d’acide L-ascorbique sont des synthèses partielles dans lesquelles la chiralité en C-4 et C-5 est dérivée de sucres naturels, principalement du D-glucose. La conversion du D-glucose en acide L-ascorbique est obtenue en manipulant la stéréochimie en C-4 et C-5 à l’aide de l’inversion de la chaîne carbonée ou de l’inversion de configuration en C-5.
Historiquement, le procédé Reichstein dominait la production industrielle d’acide L-ascorbique. Cette approche chimique et fermentaire en plusieurs étapes a depuis été largement remplacée par le procédé de fermentation 2-KGA (18) plus efficace.
Bien que de nombreuses approches alternatives aient été explorées, aucune n’a surpassé l’importance économique du procédé de fermentation 2-KGA (18). Ces alternatives comprennent :
- Fermentation alternative 2-KGA (18) utilisant des micro-organismes comme Pseudomonas et des souches de Gluconobacter modifiées.
- Production d’acide L-ascorbique par des étapes d’oxydation et de réduction sur l’acide D-gluconique.
- Fermentation directe d’acide L-ascorbique utilisant la l-sorbosone déshydrogénase ou des levures/microalgues modifiées.
- Exploration d’options moins coûteuses comme la pectine issue des flux de déchets de transformation des fruits ou de l’amidon.
- Conversions chimiques en intermédiaires d’acide L-ascorbique, comme l’amidon en L-gulono-1,4-lactone, pour une combinaison potentielle avec la biocatalyse.
Les avancées futures se concentrent sur les processus fermentatifs et biocatalytiques pour une production d’acide L-ascorbique plus simple et plus efficace. Les domaines prometteurs comprennent :
- Conversion biocatalytique directe avec des enzymes convertissant le 2-KGA (18) ou la L-sorbosone directement en acide L-ascorbique.
- Micro-organismes génétiquement modifiés tels que la levure ou les microalgues.
- Les matières premières alternatives utilisent des matières premières moins chères et plus abondantes comme les flux de déchets d’amidon ou de pectine.
Malgré la prédominance du processus de fermentation du 2-KGA (18), des recherches continues s’efforcent de développer des méthodes plus durables, rentables et rationalisées pour la production industrielle d’acide L-ascorbique.
4.5. Vitamine C d’origine naturelle
Alors que la vitamine C synthétique domine le marché en raison de son prix abordable et de sa production à grande échelle, depuis 2010, la vitamine C naturelle issue des fruits d’acérola et de rosa roxburghii est disponible, bien qu’à un prix plus élevé et avec une capacité de production plus faible.
Ces fruits contiennent naturellement des niveaux exceptionnellement élevés de vitamine C, environ 2 à 3 g pour 100 g de pulpe.
Les processus d’extraction donnent des produits dont la teneur en vitamine C varie de 10 à 25 %, selon les excipients ajoutés. La vitamine C naturelle est principalement commercialisée pour des applications de nutrition humaine et de soins personnels.
5. Applications industrielles de l’acide L-ascorbique
5.1. Utilisations de l’acide L-ascorbique dans les produits pharmaceutiques et alimentaires
Environ un tiers de la production totale est utilisé pour les compléments vitaminiques dans l’industrie pharmaceutique. La partie restante sert principalement d’additif alimentaire et d’alimentation animale pour améliorer la qualité et la stabilité des produits.
L’acide L-ascorbique est un composant courant de diverses préparations pharmaceutiques, notamment des multivitamines, des comprimés, des sirops, des élixirs et des comprimés effervescents. Les formes posologiques solides sont très stables, tandis que les préparations liquides sont susceptibles de se dégrader et d’interagir avec d’autres ingrédients.
L’industrie alimentaire représente le plus grand secteur d’application, notamment dans la transformation de la viande, des fruits et de la farine. L’acide L-ascorbique agit comme un antioxydant et une vitamine essentielle, contribuant à :
- L’inhibition de la formation de nitrosamines dans les charcuteries.
- La prévention du brunissement enzymatique dans les fruits et légumes transformés.
- La restauration et l’enrichissement de la valeur nutritionnelle des aliments et des boissons.
- L’amélioration de la qualité de la farine et de la pâte.
- Le retardement du rancissement oxydatif dans les graisses et les huiles.
- L’amélioration de la clarté du vin et de la bière.
- Des effets synergétiques lorsqu’ils sont combinés avec d’autres antioxydants (par exemple, les tocophérols).
L’acide L-ascorbique, ses sels et le palmitate ou le stéarate d’ascorbyle sont des additifs alimentaires approuvés dans la Communauté européenne (E300 ff–304b) et classés GRAS (Generally Recognized As Safe) par la FDA.
5.2. Utilisations de l’acide L-ascorbique en nutrition animale
Bien qu’elle ne soit pas essentielle pour les poulets de chair, les dindes et les pondeuses en raison de leur production endogène, la supplémentation en vitamine C peut avoir un impact positif sur les performances des volailles en améliorant le gain de poids, la conversion alimentaire, la production d’œufs et la résistance de la coquille d’œuf.
L’acide L-ascorbique contribue également à améliorer la santé et la compétence immunitaire, en particulier dans des conditions stressantes (par exemple, le stress thermique), et il a des effets synergétiques lorsqu’il est associé à la vitamine E.
La vitamine C améliore la morphologie de la muqueuse intestinale et protège les spermatozoïdes des dommages oxydatifs chez les mâles reproducteurs, ce qui entraîne une fertilité accrue.
Les porcs peuvent synthétiser la vitamine C, mais l’efficacité dépend de l’âge. Les porcelets ont une production limitée jusqu’à 4 à 6 semaines, bénéficiant potentiellement d’une supplémentation pour les performances et la réponse immunitaire.
Les poissons ne peuvent pas synthétiser la vitamine C et nécessitent un apport alimentaire. L’acide ascorbique, ou sa forme plus stable, l’acide ascorbique 2-phosphate, est utilisé en pisciculture pour prévenir le scorbut et renforcer la fonction immunitaire.
La supplémentation alimentaire en vitamine C peut être réalisée avec de l’acide ascorbique cristallin, qui peut également être utilisé dans l’eau de boisson.
Des formes spéciales comme l’acide ascorbique enrobé d’éthylcellulose ou les sels de Na/Ca sont utilisées pour les aliments traités à la chaleur et à l’humidité (granulés ou extrusion).
Référez-vous au Tableau 3 pour connaître les besoins détaillés en vitamine C chez divers animaux.
| Animal | Supplémentation recommandée |
|---|---|
| Poules pondeuses | 100-200 |
| Poulets de chair à l'engraissement (du début à la finition) | 100-200 |
| Poulets de chair reproducteurs | 100-150 |
| Dindes à l'engraissement (du début à la finition) | 100-200 |
| Éleveurs de dindes | 100-200 |
| Porcelets (pré-démarrage et démarrage) | 100-200 |
| Éleveurs de porcs | |
| Cochettes et truies | 200-300 |
| Verrats | 200-500 |
| Veaux | 200-500 |
| Chevaux (mg/tête/jour) | |
| Poulains | 500-750 |
| Chevaux de course et d'élevage | 1000-2000 |
| Saumon et truite | 150-250 |
| Poissons d'eau chaude (carpe et tilapia) | 150-250 |
| Dorade et bar | 150-250 |
| Crevettes | 250-500 |
| Chiens | 100-200 |
| Chats | 100-200 |
5.3. Autres utilisations
Les facteurs économiques limitent l’application de l’acide ascorbique en phytologie pour la germination des graines, la protection contre l’ozone, l’aide à la récolte, la résistance aux maladies et la régulation de la croissance.
Des applications mineures existent dans les industries des polymères, de la photographie et des cosmétiques.
Référence
- Vitamins, 14. Vitamin C (l-Ascorbic Acid); Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.o27_o10.pub2

