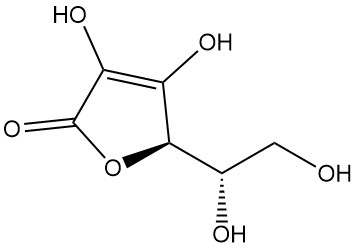
Was ist L-Ascorbinsäure?
L-Ascorbinsäure, auch bekannt als (2R)-2-[(1S)-1,2-Dihydroxyethyl]-3,4-dihydroxy-2H-furan-5-on, ist die IUPAC-Bezeichnung für Vitamin C. Es ist ein weißes oder geruchloses Pulver oder Kristall mit saurem Geschmack, das in der Natur vorkommt und antiskorbutische Wirkung hat, d. h. es beugt Skorbut vor, einer Krankheit, die durch Vitamin-C-Mangel verursacht wird.
L-Ascorbinsäure wurde erstmals 1928 isoliert und ihre Struktur fünf Jahre später bestimmt. Heute ist L-Ascorbinsäure das weltweit am häufigsten produzierte Vitamin mit einer geschätzten jährlichen Produktion von rund 150.000 Tonnen.
Ein wichtiges Merkmal von L-Ascorbinsäure ist ihre reversible Oxidation zu Dehydro-L-Ascorbinsäure. Dieses Redoxsystem ermöglicht es L-Ascorbinsäure, als Reduktionsmittel zu wirken.
Unter den vier Diastereomeren der Ascorbinsäure zeigt nur D-Araboascorbinsäure (auch bekannt als Isoascorbinsäure, Erythorbinsäure und D-Erythro-hex-2-ensäure-γ-lacton) eine schwache antiskorbutische Aktivität (etwa 5 % der Aktivität von L-Ascorbinsäure).
Inhaltsverzeichnis
1. Physikalische Eigenschaften von L-Ascorbinsäure
L-Ascorbinsäure ist ein weißes bis sehr blassgelbes kristallines Pulver, das in Wasser sehr gut löslich ist (1 g in 3 ml), in Ethanol, Propylenglykol und Glycerin mäßig löslich und in Ether, Chloroform, Benzol, Petrolether, Ölen, Fetten und Fettlösemitteln unlöslich ist.
Eine Zusammenfassung der physikalischen Eigenschaften von L-Ascorbinsäure finden Sie in der folgenden Tabelle.
| Eigenschaft | Wert |
|---|---|
| CAS-Nummer | [50-81-7] |
| Formel | C6H8O6 |
| Molekulargewicht | 176,13 g/mol |
| Schmelzpunkt | 190–192 °C (Zersetzung) |
| Dichte | 1,65 g/cm3 |
| Optische Drehung | [α]20H2O: +20,5° bis +21° (c = 1) |
| [α]20EtOH: +52° (c = 0,5) | |
| [α]20MeOH: +49,5° (c = 0,5) | |
| pH | 3 (5 g/L) 2 (50 g/L) |
| pK1 | 4,17 (3-OH) |
| pK2 | 11,57 (2-OH) |
| Redoxpotential | E = +0,127 V (pH=5) |
2. Chemische Eigenschaften von L-Ascorbinsäure
L-Ascorbinsäure kommt in mindestens fünf tautomeren Formen vor. Die am weitesten verbreitete Form, das Tautomer (1), stellt die kristalline Struktur dar und dominiert in sauren wässrigen Lösungen (pH = 2). Sowohl die 2-OH- als auch die 3-OH-Gruppen sind sauer und bilden mit Basen monobasische Salze; dibasische Salze sind jedoch instabil.
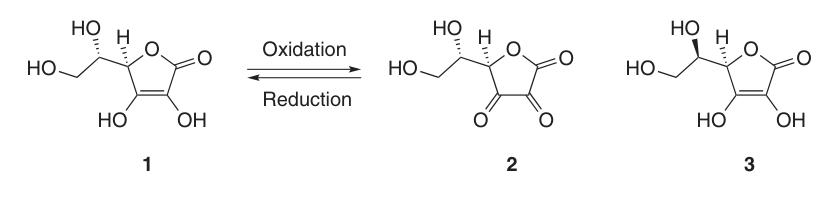
In Natrium- und Calciumascorbat interagiert das Metallion mit dem Sauerstoffatom an Position 3 (4a). Die negative Ladung des Ascorbatmonoanions ist innerhalb des π-Elektronensystems delokalisiert, was zur Stabilität seines Lactonrings in alkalischen Umgebungen beiträgt.
L-Ascorbinsäure isomerisiert beim Kochen in methanolischer Kaliumhydroxidlösung leicht zu L-Isoascorbinsäure.
Aufgrund ihrer Endiolstruktur wirkt L-Ascorbinsäure als starkes Reduktionsmittel. Die Oxidation von Ascorbinsäure (1) ergibt Dehydroascorbinsäure (2) und verläuft über das Radikalanion-Zwischenprodukt Semidehydroascorbinsäure (5).
Semidehydroascorbinsäure ist eine starke Säure (pKa = 0,45) und ein Radikalfänger, der mit sich selbst reagieren kann, um Ascorbinsäure und Verbindung (6) zu regenerieren, oder mit anderen freien Radikalen reagieren kann.
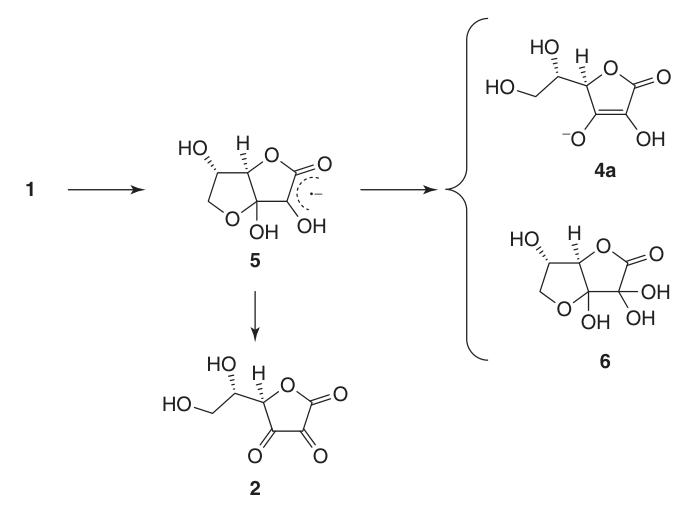
Übergangsmetalle wie Cu und Fe katalysieren die Autoxidation von Ascorbinsäure zu Dehydroascorbinsäure (2). Diese Metalle bilden mit Sauerstoff einen ternären Zwischenkomplex, der dissoziiert und Dehydroascorbinsäure (2), Wasserstoffperoxid und das Metallion ergibt.
Der Autoxidationsprozess wird oberhalb eines pH-Werts von 7 beschleunigt und kann durch Komplexierung von Metallionen mit Chelatbildnern wie EDTA, Metaphosphorsäure, Zitronensäure oder Oxalsäure gehemmt werden.
Die Behandlung von Ascorbinsäure mit Sauerstoff in Methanol mit Aktivkohle bildet ein sirupartiges Methanoladdukt, das bei weiterer Verarbeitung Dehydroascorbinsäure (2) als kristallines Dimer in 64 % Ausbeute liefert.
Bei einem pH-Wert von 2,5–5,5 in einer wässrigen Lösung und bei 4 °C ist Verbindung (2) mehrere Tage stabil; Reduktionsmittel wie Schwefelwasserstoff, Dithiothreitol oder Cystein können sie jedoch quantitativ wieder in Ascorbinsäure umwandeln.
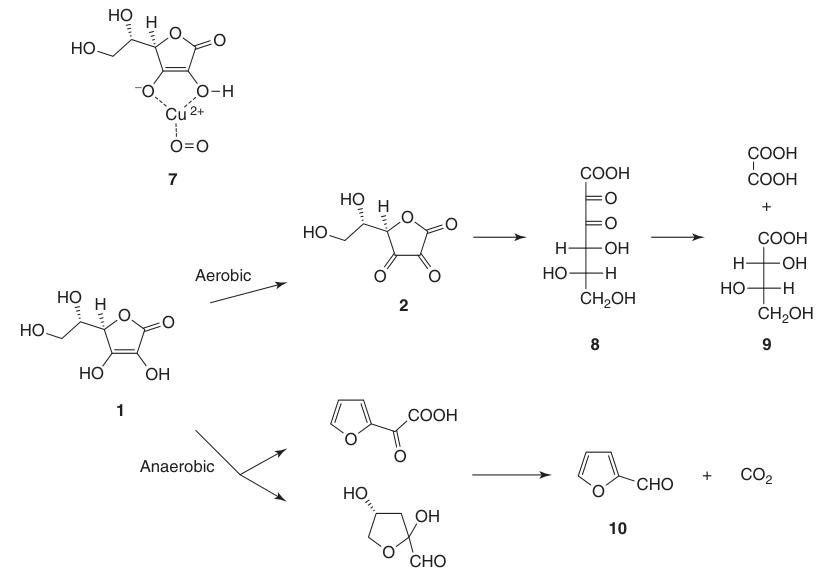
Während Dehydroascorbinsäure (2) die Vitamin-C-Aktivität behält, führt die irreversible Öffnung des Lactonrings zur Bildung von 2,3-Diketogulonsäure (8) zum vollständigen Verlust dieser Aktivität.
L-Ascorbinsäure wird in wässrigen Lösungen sowohl unter aeroben als auch unter anaeroben Bedingungen abgebaut. Die Zersetzungsgeschwindigkeit hängt von Faktoren wie pH-Wert, Temperatur, Licht, Konzentration und der Anwesenheit von Schwermetallkatalysatoren ab.
Die Anwesenheit von Sauerstoff beschleunigt den Abbauprozess im Vergleich zu anaeroben Bedingungen erheblich. Die endgültigen Oxidationsprodukte umfassen L-Threonsäure (9) und Oxalsäure. Unter anaeroben Bedingungen führt der Abbau zu Furfural (10) und CO2.
Feste L-Ascorbinsäure ist in Abwesenheit von Feuchtigkeit und Licht über lange Zeit sehr stabil.
Ein Schutz vor oxidativem Abbau in wässrigen Anwendungen kann durch Beschichtung mit Fetten und Polymeren oder durch chemische Substitution der Endiolhydroxylgruppen (L-Ascorbat-2-sulfat, L-Ascorbat-2-phosphat und 2-O-Methylascorbinsäure) erreicht werden.
3. Natürliche Vitamin-C-Quellen
Ascorbinsäure (Vitamin C) ist eine weit verbreitete Verbindung, die in Pflanzen und einigen Tieren vorkommt. Sie ist besonders reichlich in grünen Pflanzen vorhanden, wobei die höchsten Konzentrationen in tropischen Früchten und Gladiolenblättern beobachtet werden. Ihr Vorkommen in Hefe und nicht-cyanobakteriellen Prokaryonten ist noch unklar.
In den Wintermonaten war die Vitamin-C-Aufnahme früher vor allem durch Wurzelgemüse wie Kartoffeln und Kohl bedingt. Heute, wo das ganze Jahr über frisches Obst und Gemüse verfügbar ist, sind die Vitamin-C-Nahrungsquellen vielfältiger. Lagerungs- und Kochprozesse können jedoch zum Vitamin-C-Abbau beitragen.
Die Verteilung von Vitamin C in Pflanzengeweben variiert. Insbesondere einige Pflanzen, wie Brassica-Arten und Elaeocarpus-Arten, speichern Vitamin C in gebundener Form, die als Ascorbigen bzw. Elaeocarpusin bekannt ist.
Vitamin C kommt auch in Tieren vor, allerdings in geringeren Konzentrationen als in Pflanzen. Die höchsten Konzentrationen finden sich in den endokrinen Organen von Säugetieren wie Kühen (Hypophyse und Nebennieren).
Bestimmten Tierarten, darunter Menschen, Primaten, Meerschweinchen, fliegende Säugetiere, einige Vögel, Fische und Insekten, fehlt die Fähigkeit, Vitamin C zu synthetisieren, und sie sind auf die Aufnahme über die Nahrung angewiesen.
| Lebensmittelgruppe | Vitamin C (mg/100 g) |
|---|---|
| Fisch | 0–4 |
| Spargel | 7–25 |
| Fleisch (Rind, Schwein) | 0–10 |
| Bohnen | 5–30 |
| Milch (Kuh) | 1–2 |
| Brokkoli | 20–100 |
| Obst (Äpfel, Kirschen, Kiwis, Orangen) | 4–180 |
| Gemüse (Brokkoli, Rosenkohl, Blumenkohl, Spinat, Rüben) | 20–90 |
| Wurzelgemüse (Karotten, Kartoffeln) | 2–20 |
| Getreide (Hafer, Roggen, Weizen) | <1 |
| Reis | 0 |
4. Industrielle Produktion von L-Ascorbinsäure
Die erste erfolgreiche Synthese von L-Ascorbinsäure erfolgte noch bevor ihre vollständige chemische Struktur bestimmt war. Dabei wurde L-Xyloson (11) mit Kaliumcyanid zu L-Xylonitril (12) umgesetzt, das nach Lactonisierung und Enolisierung L-Ascorbinsäure in einer Konzentration von etwa 40 % ergab.
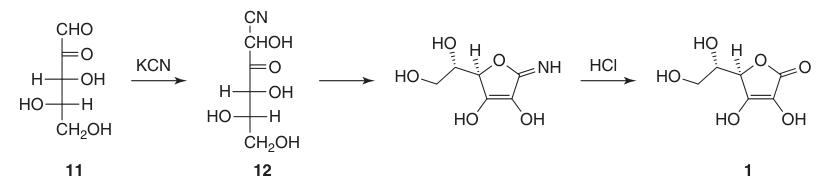
Ein großer Nachteil dieser anfänglichen Synthese war jedoch der Aufwand und die Kosten, die mit der Gewinnung von L-Xyloson (11) verbunden waren.
Glücklicherweise veröffentlichten Reichstein und Grüssner etwa ein Jahr später eine praktischere Methode zur Synthese von L-Ascorbinsäure, bei der leicht verfügbare D-Glucose (13) (ein C6-Zucker) als Ausgangsmaterial verwendet wurde. Diese Methode wurde über 60 Jahre lang zum dominierenden kommerziellen Produktionsweg, wobei im Laufe der Zeit kleinere Verbesserungen vorgenommen wurden.
Seit den 1980er Jahren hat sich der Herstellungsprozess deutlich verändert. Sorbitol ist zum bevorzugten Ausgangsmaterial geworden, wobei zur Herstellung von 2-Ketogulonsäure eine zweistufige fermentative Oxidation verwendet wird.
Während die Glucosehydrierung weiterhin eine Methode zur Sorbitolproduktion ist, wird sie nicht immer vom endgültigen Ascorbinsäurehersteller durchgeführt.
Trotz der Verlagerung hin zur Fermentation bleibt das Gesamtkonzept des modernen Prozesses mit der ursprünglichen Reichstein-Synthese verbunden. Der Hauptunterschied liegt in der Verwendung mikrobieller Oxidation anstelle chemischer Methoden.
4.1. Herstellung von L-Ascorbinsäure durch Reichstein-Synthese
Die Reichstein-Synthese von L-Ascorbinsäure ist eine Reihe einfacher, ertragreicher chemischer Reaktionen, die die Spaltung oder Bildung von Kohlenstoff-Kohlenstoff-Bindungen vermeiden.
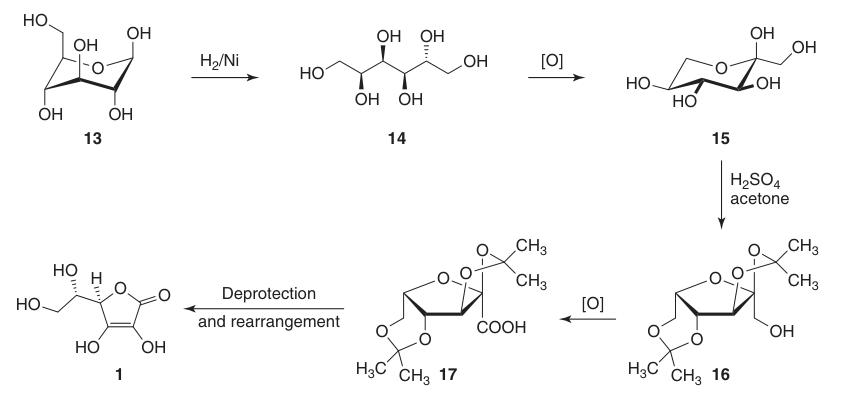
Es reduziert die C-1-Position von D-Glucose (13) und oxidiert die Positionen 5 und 6, während die Chiralität an C-2 und C-3 erhalten bleibt. Dies führt letztendlich zur gewünschten L-threo-Konfiguration an C-4 und C-5 im Endprodukt.
Die klassische Reichstein-Grussner-Synthese beginnt mit der Reduktion von D-Glucose (13) zu D-Sorbit (14) durch Hydrierung über einem Nickelkatalysator. D-Sorbit wird mikrobiologisch durch das Bakterium Acetobacter xylinum zu L-Sorbose (15) oxidiert.
L-Sorbose (15) wird bei niedrigen Temperaturen mit Aceton und Schwefelsäure behandelt, um das geschützte Zwischenprodukt 2,3:4,6-Di-O-Isopropyliden-α-L-sorbofuranose (16) zu bilden.
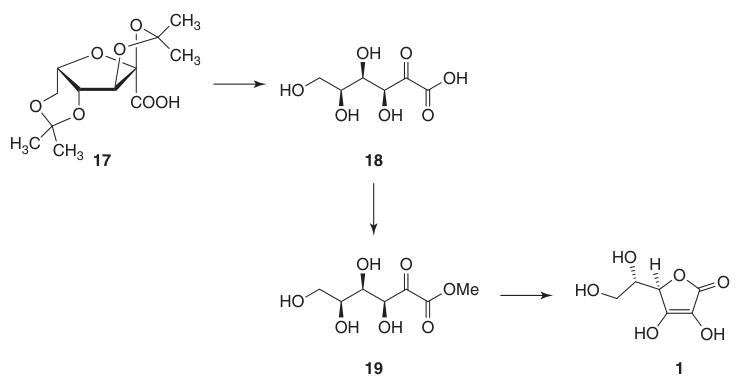
Dieser Schutz der Hydroxylgruppen an C-2, C-3, C-4 und C-6 ermöglicht eine Oxidation mit hoher Ausbeute zu Di-O-Isopropyliden-2-ketogulonsäure unter Verwendung von Kaliumpermanganat in einer alkalischen Lösung. Die Entschützung mit heißem Wasser ergibt 2-Keto-L-gulonsäure (18).
L-Ascorbinsäure wird durch Erhitzen von 2-Keto-L-gulonsäure (18) in Wasser auf 100 °C hergestellt, wobei eine Ausbeute von 20 % erreicht wird, oder durch Veresterung, gefolgt von Ansäuern, wobei eine Ausbeute von 70 % erreicht wird.
Die Gesamtausbeute an L-Ascorbinsäure aus D-Glucose (13) beträgt bei dieser Methode etwa 15–18 %.
4.2. Industrielle Herstellung nach dem Reichstein-Verfahren
Die Umwandlung des klassischen Reichstein-Verfahrens in ein kommerziell tragfähiges Verfahren erforderte eine erhebliche Optimierung jedes Reaktionsschritts. Diese Fortschritte umfassten sowohl technische als auch chemische Modifikationen und führten zu Ausbeuten von über 90 % in den einzelnen Schritten, was zu einer Gesamtausbeute an L-Ascorbinsäure aus D-Glucose (13) von etwa 60 % führte.
Wichtige Schritte und Optimierungen sind:
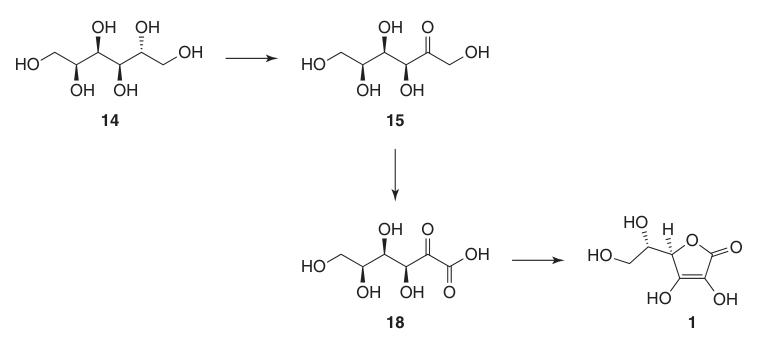
1. D-Sorbit (14)
Durch Hochdruckhydrierung von D-Glucose (13) mit einem Raney-Nickel-Katalysator bei erhöhten Temperaturen werden nahezu quantitative D-Sorbit (14)-Ausbeuten bei minimaler Bildung von Nebenprodukten wie D-Mannitol und L-Iditol erzielt.
Die Sorbitollösung wird ohne weitere Reinigung direkt in der Fermentation verwendet, daher wird hochwertige Ausgangsglucose benötigt.
2. L-Sorbose (15)
Die mikrobielle Oxidation steriler D-Sorbitol-(14)-Lösungen unter Verwendung von Stämmen wie Gluconobacter oxydans ergibt effizient L-Sorbose (15) mit über 90 % Umwandlung.
Fermentationen im großen Maßstab erfordern eine strenge Kontrolle des pH-Werts (4–6), der Temperatur (30–35 °C) und steriler Bedingungen, um den Produktverlust während der Oxidation und der Aufarbeitung durch Filtration und Kristallisation zu minimieren.
3. 2,3:4,6-Di-O-isopropyliden-α-L-sorbofuranose (16)
Der Schutz der 2,3- und 4,6-Hydroxygruppen in L-Sorbose (15) wird durch zyklische Ketalbildung mit Aceton und überschüssiger Schwefelsäure als Katalysatoren oder Dehydratisierungsmittel bei niedrigen Temperaturen (z. B. 4 °C) erreicht.
Das Hauptprodukt ist 2,3:4,6-Di-O-isopropyliden-α-L-sorbofuranose (16), wobei Monoisopropylidenderivate als wiedergewinnbare Nebenprodukte entstehen.
4. 2,3:4,6-Di-O-isopropyliden-2-keto-L-gulonsäure (17)
Ursprünglich wurde bei der Oxidation von 2,3:4,6-Di-O-isopropyliden-α-L-sorbofuranose (16) zu 2,3:4,6-Di-O-isopropyliden-2-keto-L-gulonsäure (17) KMnO4 bei erhöhten Temperaturen in verdünnter Natriumhydroxidlösung verwendet, um etwa 90 % Produkt zu erhalten.
Für kontinuierliche Prozesse wurden kostengünstigere Alternativen entwickelt, wie die Hypochloritoxidation mit katalytischem Nickelchlorid/-sulfat bei 60 °C, die eine Ausbeute von über 93 % liefert, und die elektrochemische Oxidation unter Verwendung von Nickel/Nickeloxidelektroden in alkalischer Lösung.
Eine weitere Methode, die gute Erträge liefert, ist die Oxidation eines Metallkatalysators (Palladium oder Platin auf Kohlenstoff) mit Luft oder Sauerstoff in einer alkalischen Lösung.
5. L-Ascorbinsäure (1)
Die Umwandlung von 2,3:4,6-Di-O-isopropyliden-2-keto-L-gulonsäure (17) in L-Ascorbinsäure kann durch zwei Methoden erreicht werden:
- Entschützung zu 2-Keto-L-gulonsäure (18), gefolgt von Veresterung mit Methanol und basenkatalysierter Cyclisierung.
- Direkte säurekatalysierte Cyclisierung von Ascorbinsäure aus entweder der geschützten oder der entschützten 2-Keto-L-gulonsäure (18).
Bei der basenkatalysierten Methode wird Methyl-2-keto-L-gulonat (19) verwendet, das aus 2-Keto-L-gulonsäure (18) durch Reaktion mit Methanol in Gegenwart von einer Säure. Nachfolgende Reaktionen mit Basen wie Natriumhydrogencarbonat erzeugen Natriumascorbat in hoher Ausbeute.
Der erste säurekatalysierte Weg zur Herstellung von Ascorbinsäure entstand kurz nach der Entdeckung des Reichstein-Verfahrens.
4.3. Moderne Ascorbinsäureproduktion: Chemische Oxidation durch Fermentation ersetzen
Die direkte Umwandlung von L-Sorbose (15) in 2-Keto-L-gulonsäure (18) (2-KGA), ein wichtiges Zwischenprodukt bei der Vitamin-C-Synthese, war ein Hauptziel für Verbesserungen. Während die chemische Oxidation unter Verwendung von Platin- oder Gold-Platin-Katalysatoren einige Erfolge erzielte, erwies sich die Fermentation als skalierbarerer und effizienterer Ansatz.
In frühen Versuchen wurde die Verwendung von Gluconobacter zur fermentativen Oxidation untersucht. Ein Durchbruch kam jedoch in den 1980er Jahren mit der Entdeckung von Ketogulonicigenium vulgare durch die Chinesische Akademie der Wissenschaften.
Dieser Mikroorganismus bot das Potenzial, die chemischen Oxidationsschritte im Reichstein-Verfahren vollständig zu ersetzen. Heute beruht praktisch die gesamte weltweite Vitamin-C-Produktion auf der 2-KGA-Fermentation (18) aus L-Sorbose (15) durch Ketogulonicigenium vulgare.
Die anfänglichen Umwandlungsschritte von D-Glucose in L-Sorbose (15) sind gegenüber der in den 1930er Jahren entwickelten Reichstein-Methode weitgehend unverändert geblieben. Die anschließende Umwandlung von L-Sorbose in L-Ascorbinsäure erfolgt heute in einem weltweit vorherrschenden zweistufigen Fermentationsverfahren:
- Kommerziell erhältliches D-Sorbitol (14) wird mit Gluconobacter oxydans zu L-Sorbose (15) fermentiert.
- Die sterilisierte L-Sorbose-Brühe (15) wird durch eine Mischfermentation mit Ketogulonicigenium vulgare und Bacillus megaterium weiter zu 2-KGA (18) oxidiert. Bacillus megaterium spielt eine unterstützende Rolle und ermöglicht es Ketogulonicigenium, das nur einen begrenzten Nährstoffbedarf hat, auf einem einfachen und kostengünstigen Medium zu gedeihen.
Dieser zweistufige Fermentationsprozess erreicht eine schnelle und effiziente Oxidation von L-Sorbose (15) zu 2-KGA (18), wobei Titer von über 100 g/l gemeldet werden und innerhalb von 40 Stunden etwa 90 % L-Sorbose gewonnen werden.
Jüngste Fortschritte haben die Notwendigkeit einer zwischenzeitlichen Sterilisation von L-Sorbose in einigen Prozessen überflüssig gemacht.
Die Kombination beider Fermentationsschritte in einem einzigen Tank wurde untersucht. Gluconobacter oxidiert zunächst D-Sorbitol (14) zu L-Sorbose (15), gefolgt von Ketogulonicigenium-Wachstum und L-Sorbose-Oxidation zu 2-KGA (18).
Dieser Ansatz erfordert eine sorgfältige zeitliche Abstimmung, um eine unerwünschte C-1-Oxidation von D-Sorbit durch das Enzym von Ketogulonicigenium zu verhindern. Trotz vielversprechender Ergebnisse mit 2-KGA-Titern (18) von 140 g/l und hohen Umwandlungserträgen bleibt die kommerzielle Rentabilität dieses Eintankverfahrens unklar.
Der Übergang von der chemischen Oxidation zur Fermentation hat die Vitamin-C-Produktion revolutioniert und bietet einen effizienteren, skalierbareren und möglicherweise einfacheren Prozess.
4.4. Andere Methoden zur Herstellung von Ascorbinsäure
Alle Herstellungsverfahren für L-Ascorbinsäure sind Teilsynthesen, bei denen die Chiralität an C-4 und C-5 von natürlich vorkommenden Zuckern, hauptsächlich D-Glucose, abgeleitet wird. Die Umwandlung von D-Glucose in L-Ascorbinsäure wird durch Manipulation der Stereochemie an C-4 und C-5 mithilfe einer Kohlenstoffketteninversion oder einer C-5-Konfigurationsinversion erreicht.
Historisch dominierte das Reichstein-Verfahren die industrielle L-Ascorbinsäure-Produktion. Dieses mehrstufige chemische und Fermentations-Verfahren wurde inzwischen größtenteils durch das effizientere 2-KGA-(18)-Fermentationsverfahren ersetzt.
Obwohl zahlreiche alternative Verfahren untersucht wurden, konnte keines die wirtschaftliche Bedeutung des 2-KGA-(18)-Fermentationsverfahrens übertreffen. Zu diesen Alternativen gehören:
- Alternative 2-KGA (18) Fermentation unter Verwendung von Mikroorganismen wie Pseudomonas und gentechnisch veränderten Gluconobacter-Stämmen.
- Herstellung von L-Ascorbinsäure durch Oxidations- und Reduktionsschritte von D-Gluconsäure.
- Direkte L-Ascorbinsäure-Fermentation unter Verwendung von L-Sorbosondehydrogenase oder gentechnisch veränderter Hefe/Mikroalgen.
- Erforschung günstigerer Optionen wie Pektin aus Abfallströmen der Obstverarbeitung oder Stärke.
- Chemische Umwandlungen in L-Ascorbinsäure-Zwischenprodukte, wie Stärke in L-Gulono-1,4-lacton, zur möglichen Kombination mit Biokatalyse.
Der Schwerpunkt für zukünftige Fortschritte liegt auf fermentativen und biokatalytischen Prozessen für eine einfachere und effizientere L-Ascorbinsäure-Produktion. Zu den vielversprechenden Bereichen gehören:
- Direkte biokatalytische Umwandlung mit Enzymen, die 2-KGA (18) oder L-Sorboson direkt in L-Ascorbinsäure umwandeln.
- Genetisch veränderte Mikroorganismen wie gentechnisch veränderte Hefe oder Mikroalgen.
- Alternative Ausgangsstoffe verwenden billigere und reichlichere Rohstoffe wie Stärke- oder Pektin-Abfallströme.
Trotz der Dominanz des 2-KGA (18)-Fermentationsprozesses strebt die kontinuierliche Forschung danach, nachhaltigere, kostengünstigere und rationalisiertere Methoden für die industrielle L-Ascorbinsäure-Produktion zu entwickeln.
4.5. Vitamin C aus natürlichen Quellen
Während synthetisches Vitamin C aufgrund seiner Erschwinglichkeit und der Produktion im großen Maßstab den Markt dominiert, ist seit 2010 natürliches Vitamin C aus Acerola- und Rosa-roxburghii-Früchten erhältlich, allerdings zu einem höheren Preis und mit geringerer Produktionskapazität.
Diese Früchte enthalten von Natur aus außergewöhnlich viel Vitamin C, etwa 2–3 g pro 100 g Fruchtfleisch.
Extraktionsverfahren ergeben Produkte mit einem Vitamin-C-Gehalt von 10–25 %, je nach zugesetzten Hilfsstoffen. Natürliches Vitamin C wird hauptsächlich für Anwendungen in der menschlichen Ernährung und Körperpflege vermarktet.
5. Industrielle Anwendungen von L-Ascorbinsäure
5.1. Verwendung von L-Ascorbinsäure in Arzneimitteln und Lebensmitteln
Etwa ein Drittel der Gesamtproduktion wird für Vitaminpräparate in der Pharmaindustrie verwendet. Der verbleibende Teil dient hauptsächlich als Lebensmittel- und Futterzusatz, um die Produktqualität und -stabilität zu verbessern.
L-Ascorbinsäure ist ein häufiger Bestandteil verschiedener pharmazeutischer Formulierungen, darunter Multivitamine, Tabletten, Sirupe, Elixiere und Brausetabletten. Feste Darreichungsformen sind sehr stabil, während flüssige Formulierungen anfällig für Abbau und Wechselwirkungen mit anderen Inhaltsstoffen sind.
Die Lebensmittelindustrie stellt den größten Anwendungsbereich dar, insbesondere in der Fleisch-, Obst- und Mehlverarbeitung. L-Ascorbinsäure fungiert als Antioxidans und essentielles Vitamin und trägt zu Folgendem bei:
- Hemmung der Nitrosaminbildung in Wurstwaren.
- Verhinderung der enzymatischen Bräunung in verarbeitetem Obst und Gemüse.
- Wiederherstellung und Anreicherung des Nährwerts von Lebensmitteln und Getränken.
- Verbesserung der Mehl- und Teigqualität.
- Verzögerung der oxidativen Ranzigkeit in Fetten und Ölen.
- Verbesserung der Klarheit in Wein und Bier.
- Synergistische Effekte in Kombination mit anderen Antioxidantien (z. B. Tocopherolen).
L-Ascorbinsäure, ihre Salze und Ascorbylpalmitat oder -stearat sind in der Europäischen Gemeinschaft zugelassene Lebensmittelzusatzstoffe (E300 ff–304b) und von der FDA als GRAS (Generally Recognized As Safe) eingestuft.
5.2. Verwendung von L-Ascorbinsäure in der Tierernährung
Obwohl Vitamin C für Masthähnchen, Puten und Legehennen aufgrund ihrer endogenen Produktion nicht unbedingt erforderlich ist, kann eine Vitamin-C-Ergänzung die Leistung von Geflügel positiv beeinflussen, indem sie Gewichtszunahme, Futterverwertung, Eierproduktion und Eierschalenstärke verbessert.
L-Ascorbinsäure trägt auch zu einer verbesserten Gesundheit und Immunkompetenz bei, insbesondere unter Stressbedingungen (z. B. Hitzestress), und hat in Kombination mit Vitamin E synergistische Effekte.
Vitamin C verbessert die Morphologie der Darmschleimhaut und schützt Spermien bei Zuchtmännchen vor oxidativen Schäden, was zu einer erhöhten Fruchtbarkeit führt.
Schweine können Vitamin C synthetisieren, aber die Effizienz ist altersabhängig. Ferkel haben bis zum Alter von 4–6 Wochen eine begrenzte Produktion und profitieren möglicherweise von einer Ergänzung für Leistung und Immunreaktion.
Fische können kein Vitamin C synthetisieren und müssen über die Nahrung aufgenommen werden. Ascorbinsäure oder ihre stabilere Form, 2-Phosphat-Ascorbinsäure, wird in der Fischzucht verwendet, um Skorbut vorzubeugen und die Immunfunktion zu stärken.
Eine Futterergänzung mit Vitamin C kann mit kristalliner Ascorbinsäure erfolgen, die auch im Trinkwasser verwendet werden kann.
Spezielle Formen wie Ethylcellulose-beschichtete Ascorbinsäure oder Na/Ca-Salze werden für wärme- und feuchtigkeitsbehandelte Futtermittel (Pellets oder Extrusion) verwendet.
Detaillierte Informationen zum Vitamin C-Bedarf verschiedener Tiere finden Sie in Tabelle 3.
| Tier | Empfohlene Ergänzung |
|---|---|
| Legehennen | 100-200 |
| Masthühner (vom Start- bis zum Endmasttier) | 100-200 |
| Masthühnerzuchttiere | 100-150 |
| Mastputen (vom Start- bis zum Endmasttier) | 100-200 |
| Putenzuchttiere | 100-200 |
| Ferkel (Prestarter und Starter) | 100-200 |
| Schweinezuchttiere | |
| Jungsauen und Sauen | 200-300 |
| Eber | 200-500 |
| Kälber | 200-500 |
| Pferde (mg/Kopf/Tag) | |
| Fohlen | 500-750 |
| Renn- und Zuchtpferde | 1000-2000 |
| Lachs und Forelle | 150-250 |
| Warmwasserfische (Karpfen und Tilapia) | 150-250 |
| Goldbrasse und Wolfsbarsch | 150-250 |
| Garnelen | 250-500 |
| Hunde | 100-200 |
| Katzen | 100-200 |
5.3. Andere Verwendungen
Wirtschaftliche Faktoren begrenzen die Anwendung von Ascorbinsäure in der Pflanzenwissenschaft zur Samenkeimung, zum Ozonschutz, zur Ernteunterstützung, zur Krankheitsresistenz und zur Wachstumsregulierung.
Kleinere Anwendungen gibt es in der Polymer-, Foto- und Kosmetikindustrie.
Referenz
- Vitamins, 14. Vitamin C (l-Ascorbic Acid); Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.o27_o10.pub2

