Cumarina: propiedades, reacciones, producción, usos y toxicología

¿Qué es la cumarina?
La cumarina, también conocida como 2H-1-benzopiran-2-ona o 1,2-benzopirona, es una lactona aromática natural con la fórmula química C9H6O2. Es un sólido cristalino incoloro con un olor agridulce como el heno y se utiliza como fijador en perfumes.
Vogel aisló por primera vez la cumarina de las habas tonka (Dipteryx odorata) en 1820, y en 1868, William Perkin la sintetizó mediante la reacción de Perkin.
La cumarina está ampliamente distribuida en el reino vegetal; se encuentra en el meliloto, la asperilla, la casia, el meliloto, la lavanda, el bálsamo del Perú y otras plantas en una concentración que varía de 87 000 ppm a 5 ppb.
En el pasado, la cumarina se utilizaba como aromatizante alimentario, especialmente junto con la vainillina, sin embargo, su uso en la industria alimentaria fue prohibido en Estados Unidos en 1954.
Tabla de contenido
1. Propiedades físicas de la cumarina
A temperatura ambiente, la cumarina se presenta en forma de foliolos incoloros y brillantes o cristales rómbicos con un agradable olor a vainilla dulce y un sabor amargo y aromático a quemado. Es muy soluble en cloroformo y piridina, soluble en etanol y éter, y ligeramente soluble en agua.
Las propiedades físicas de la cumarina se enumeran en la Tabla 1.
| Propiedad | Valor |
|---|---|
| Número CAS | [91-64-5] |
| Fórmula química | C9H6O2 |
| Peso molecular | 146,14 g/mol |
| Punto de fusión | 68-70 °C |
| Punto de ebullición | 301 °C a 100 kPa 170,4 °C a 2,7 kPa 138,5 °C a 0,7 kPa |
| Densidad | 0,94 g/cm3 a 25 °C 1,178 g/cm3 a 100 °C |
| Presión de vapor | 0,13 kPa a 106 °C |
| Punto de inflamación | 150 °C |
| Solubilidad en agua | 0,25 g/100 g de agua a 25 °C 2 g/100 g de agua a 100 °C |
2. Reacciones químicas de la cumarina
La cumarina sufre reacciones típicas de la lactona de un ácido aromático α,β-insaturado.
El anillo de lactona de la cumarina se hidroliza con álcalis para producir sales de ácido cumarínico o ácido o-hidroxi-cis-cinámico. Estas sales son inodoras y se convierten en cumarina mediante acidificación. La reacción de la cumarina con hidróxido de sodio fundido forma salicilato de sodio y acetato de sodio.
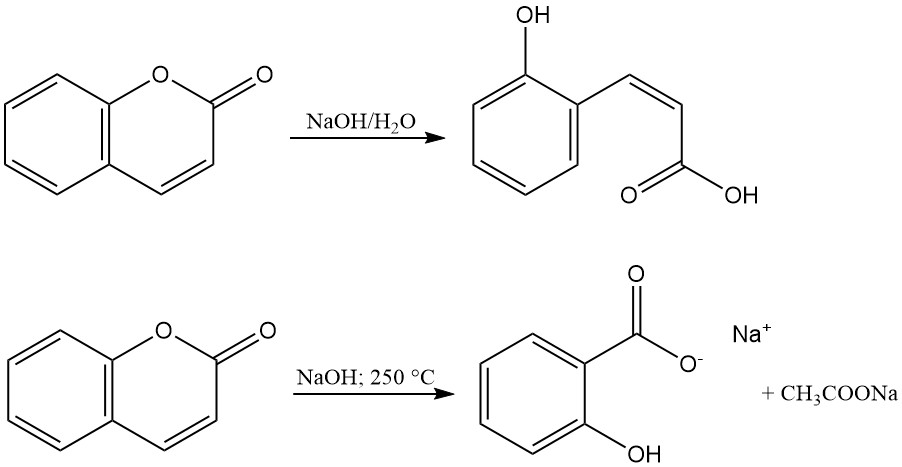
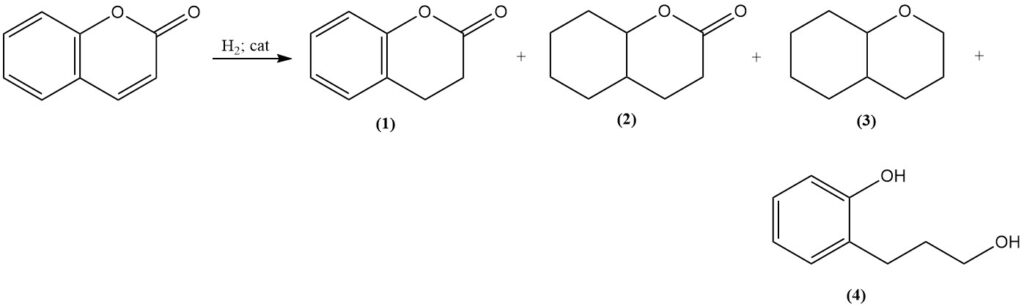
La hidrogenación catalítica de la cumarina produce diversos productos según las condiciones de reacción. En condiciones moderadas, utilizando un catalizador de níquel Raney, se forma 3,4-dihidrocumarina (1); sin embargo, el aumento de la temperatura y la presión conducen a la formación de octahidrocumarina (2), hexahidrocromano (3) y productos de polimerización.
La hidrogenación selectiva a 3,4-dihidrocumarina (1) se puede lograr con un catalizador de sulfuro de platino, y la hidrogenación a temperaturas elevadas utilizando un catalizador de cromito de cobre produce 3-(o-hidroxifenil)-1-propanol (4) con un rendimiento muy bueno.
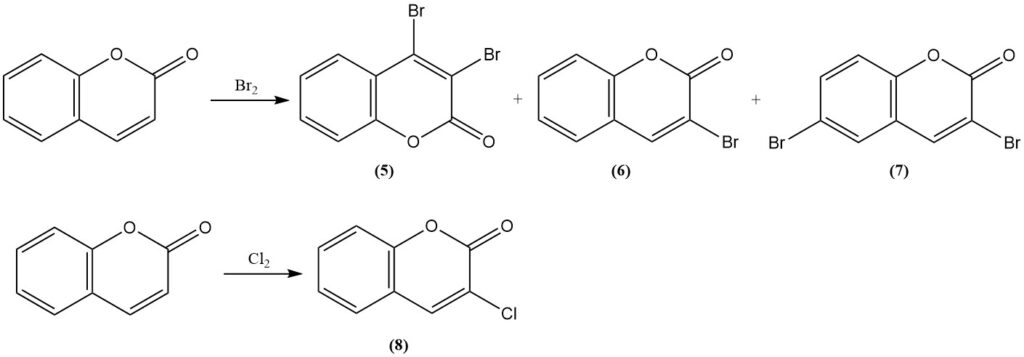
La reacción de la cumarina con bromo produce 3,4-dibromocumarina (5) en condiciones suaves. En condiciones más rigurosas se obtienen 3-bromocumarina (6) y 3,6-dibromocumarina (7). La reacción con cloro produce 3-clorocumarina (8).
La reducción de la cumarina con hidruro de litio y aluminio produce alcohol o-hidroxicinamílico.
El o-alilfenol se prepara mediante la reacción de la cumarina con diborano.
La cumarina forma hidrosulfonatos de sodio solubles con bisulfito de sodio, que pueden regenerar la cumarina cuando se acidifica. Esta técnica se utiliza para purificar la cumarina cruda.
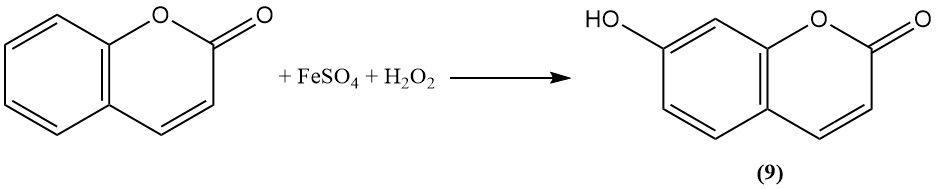
La oxidación con el reactivo de Fenton convierte la cumarina en umbeliferona (7-hidroxicumarina) (9).
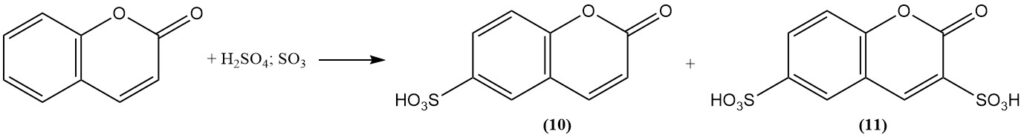
La sulfonación de cumarina utilizando ácido sulfúrico fumante forma ácido cumarina-6-sulfónico (10) a temperatura moderada y ácido cumarina-3,6-disulfónico (11) a temperatura más alta.
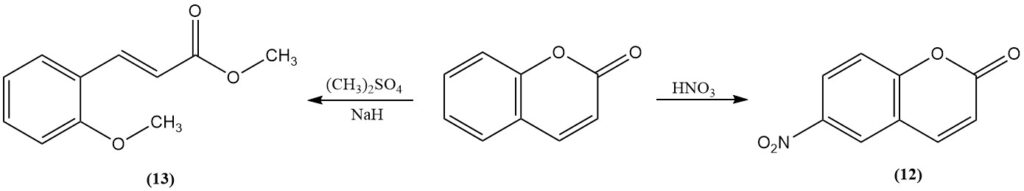
La nitración con ácido nítrico fumante produce 6-nitrocumarina (12). La metilación de la cumarina con sulfato de metilo o yoduro de metilo en presencia de hidruro de sodio produce 2-metoxicinamato de metilo (13). El trifluoruro de boro cataliza la fotodimerización de la cumarina.
La cumarina puede sufrir otras sustituciones electrofílicas aromáticas, como la halogenación, la alquilación y la acilación.
3. Producción de cumarina
Hasta finales de la década de 1980, la cumarina se derivaba exclusivamente de fuentes naturales mediante la extracción de habas tonka y lengua de venado. Hoy en día, se produce químicamente utilizando o-cresol, fenol y salicilaldehído como materiales de partida. Existe una diversidad de vías sintéticas para la síntesis de cumarina a partir de cada una de estas materias primas.
3.1. Producción de cumarina a partir de o-cresol
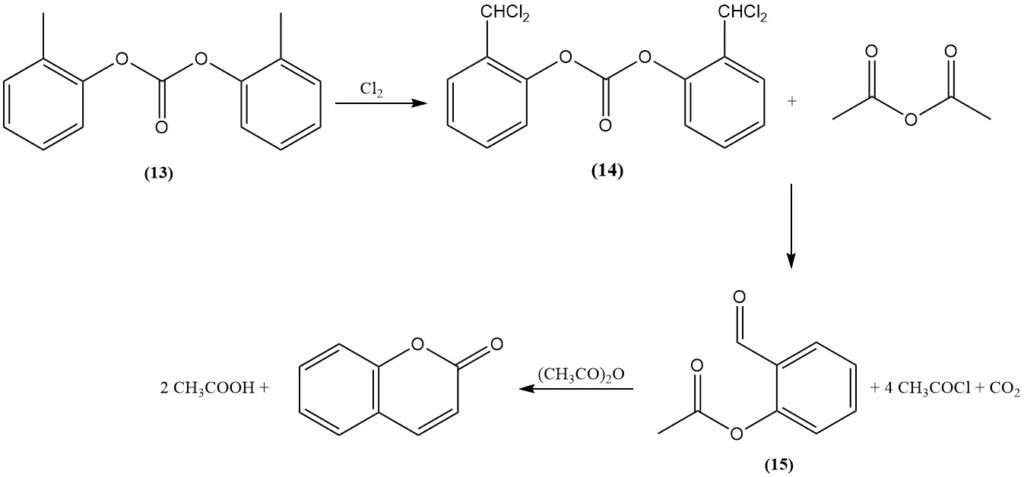
El proceso Raschig, descubierto en 1909, es una ruta de síntesis primaria para la cumarina a partir de o-cresol. Inicialmente, el grupo hidroxilo fenólico del o-cresol se protege mediante esterificación con fosfato o, preferentemente, carbonato (13). Posteriormente, el grupo metilo se transforma en un intermediario de cloruro de benzal (14) mediante dicloración.
El éster α,α-diclorocresílico resultante se hace reaccionar con un acetato alcalino en un hidróxido fundido o con anhídrido acético catalizado por un óxido metálico, como el óxido de cobalto, para formar o-acetilsalicílico aldehído (15), cloruro de acetilo y dióxido de carbono.
Finalmente, la ciclización del o-acetilsalicílico aldehído utilizando anhídrido acético genera cumarina y ácido acético.
3.2. Producción de cumarina a partir de fenol
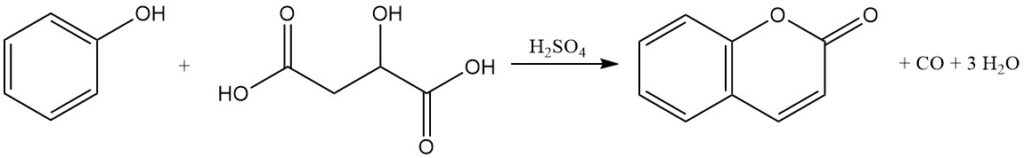
La condensación de Pechmann, descubierta en 1883, representa un método primario para la producción de cumarina a partir de fenol. En este proceso, la cumarina se produce mediante la reacción del fenol con ácidos málico, maleico o fumárico en presencia de ácido sulfúrico concentrado.
La reacción de Pechmann se utiliza ampliamente en la síntesis de numerosos derivados de la cumarina. Por ejemplo, la condensación de fenol con acetoacetato de etilo produce 4-metilcumarina. Además, el fenol puede reaccionar con dicetena para formar cumarina.
El fenol reacciona con derivados específicos del ácido acrílico para producir cumarina.
La cumarina también se produce por la reacción del fenol con cloruro de ácido 3-etoxiacrílico para producir etoxiacrilato de fenilo, seguida de una reacción de ciclización con ácido sulfúrico. Además, la cumarina se sintetiza por la reacción del fenol con acrilato de metilo en un medio ácido en presencia de aire.
3.3. Producción de cumarina a partir de salicilaldehído
Reacción de Perkin
La reacción de Perkin, descubierta inicialmente por Perkin en 1868, representa un método clásico para la síntesis de cumarina a partir de salicilaldehído. Este proceso implica la reacción del salicilaldehído con anhídrido acético en presencia de acetato de sodio como catalizador. La reacción se lleva a cabo mediante la formación de ácido cis-o-acetoxicinámico (16) como intermediario.
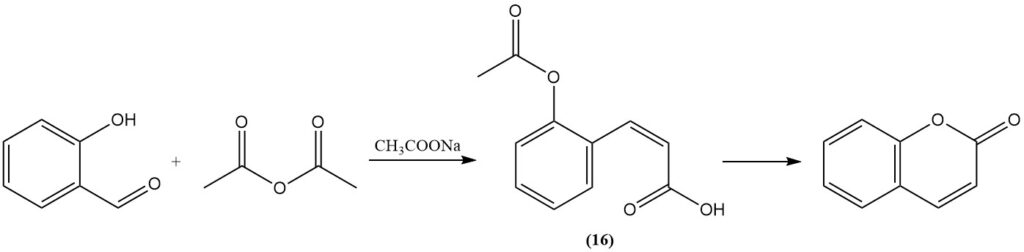
La reacción de Perkin es importante a nivel industrial, por lo que se ha estudiado y modificado ampliamente para mejorar su eficiencia. Estas modificaciones incluyen la adición de yodo, óxidos metálicos o sales; la adición de piridina o piperidina como catalizadores; la sustitución del acetato de sodio por carbonato de potasio o acetato de cesio; y el uso de biacetato de metal alcalino.
Reacción de Knoevenagel
La condensación de Knoevenagel es una reacción para sintetizar cumarinas 3-sustituidas a partir de salicilaldehído. Implica la condensación de salicilaldehído con compuestos de metileno activos, como ácido acetoacético, ácido malónico o ácido cianoacético, en presencia de un catalizador de base orgánica como amoníaco, piridina y aminas primarias y secundarias.
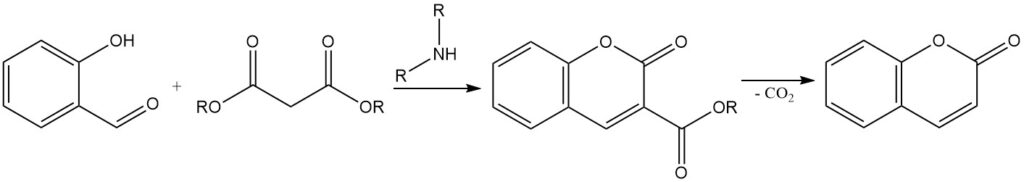
La cumarina 3-sustituida resultante se puede convertir en cumarina mediante la eliminación del grupo sustituyente. Por ejemplo, el ácido 3-carboxílico de cumarina, obtenido a partir de la condensación de salicilaldehído con ácido malónico, se puede descarboxilar calentando hasta 290 °C para formar cumarina.
Se puede lograr una reacción de descarboxilación suave con un mejor rendimiento utilizando sales de mercurio.
3.4. Otros métodos
Las rutas sintéticas alternativas para la cumarina incluyen la ciclodeshidrogenación de propionato de oxociclohexano y la deshidrogenación utilizando azufre elemental o catálisis en fase de vapor con óxidos metálicos de 3,4-dihidrocumarina, que se obtiene a partir de la oxidación de Baeyer-Villiger de 1-indanona.
3.5. Purificación de la cumarina
La cumarina sintética debe tener una alta pureza para ser utilizada en perfumes. Los métodos de purificación convencionales incluyen la destilación fraccionada a presión reducida y la cristalización a partir de disolventes como el metanol o el etanol.
Los tratamientos adicionales antes del proceso de destilación incluyen los siguientes pasos: calentar la cumarina cruda con ácido sulfúrico concentrado, neutralizarla y lavarla con agua; disolver el producto lavado en ácido sulfúrico concentrado seguido de oxidación; y calentar a reflujo con hidróxido de sodio acuoso con posterior separación de fases orgánicas y lavado.
La destilación azeotrópica al vacío con alcoholes polihidroxílicos, como el trietilenglicol, es un método de purificación alternativo. También se han descrito técnicas de fusión por zonas para la purificación de la cumarina.
4. Usos de la cumarina
Debido a su distintivo aroma dulce y estabilidad, la cumarina se utiliza como ingrediente de fragancia en perfumes, jabones, detergentes y lociones en concentraciones que van del 0,01 al 2,4 %.
La cumarina, que se combina con frecuencia con aromas herbáceos, es fundamental en la composición de los tipos de fragancias fougère y chipre. Se utiliza como fijador para mejorar la longevidad de los aceites esenciales naturales, como la lavanda, los cítricos, el romero y el musgo de roble.
Más allá de la perfumería, la cumarina imparte aromas agradables a los productos domésticos y los productos industriales, al tiempo que enmascara los olores desagradables.
También se utiliza como medio en los tintes láser y como sensibilizador en las tecnologías fotovoltaicas más antiguas.
La cumarina y sus derivados han sido estudiados para posibles usos terapéuticos, incluido el tratamiento de la esquizofrenia, los trastornos de la microcirculación, las úlceras angiopáticas, los edemas de alto contenido proteico y el cáncer.
Se utiliza como fármaco para el tratamiento del linfedema de alto contenido proteico y para mejorar la circulación venosa, y se ha probado en ensayos clínicos como antineoplásico.
Se ha demostrado que la cumarina es activa en la propagación de la pigmentación y en la desaceleración de la caída del cabello. Se ha empleado un derivado de la cumarina para polarizar cristales emisores de luz.
En la actualidad, la cumarina está prohibida para su uso como aditivo alimentario directo; sin embargo, se utiliza como saborizante de tabaco y también se utiliza en la industria de la galvanoplastia.
Es importante mencionar que, si bien los compuestos derivados de la cumarina, como la warfarina, son potentes anticoagulantes, la cumarina en sí no es un anticoagulante.
5. Toxicología de la cumarina
La cumarina plantea importantes riesgos para la salud. La ingestión, inhalación y contacto con los ojos son peligrosos, mientras que el contacto con la piel es menos grave. La sobreexposición aguda puede ser mortal. La cumarina muestra una toxicidad moderada para el hígado y los riñones, con una dosis letal media de 275 mg/kg. La hepatotoxicidad es más pronunciada en ratas que en ratones.
Los datos toxicológicos (DL50) de la cumarina son:
- 293 mg/kg (rata)
- 196 mg/kg (ratón)
- 202 mg/kg (conejillo de indias)
La corteza de casia, una variedad de canela, contiene altos niveles de cumarina. El consumo excesivo de corteza de casia puede ser perjudicial debido a su elevado contenido de cumarina.
La Administración de Alimentos y Medicamentos de los Estados Unidos ha prohibido la adición directa de cumarina a los productos alimenticios. Sin embargo, los aditivos naturales que contienen cumarina, como la asperilla, están permitidos en las bebidas alcohólicas bajo regulaciones específicas.
5.1. Vías de exposición
La exposición humana a la cumarina se produce principalmente por contacto dérmico con perfumes y productos que contienen fragancias de cumarina. La piel absorbe fácilmente la cumarina, lo que la convierte en una vía de administración importante para aplicaciones terapéuticas como el tratamiento del linfedema.
Además, la exposición humana puede producirse por ingestión oral a través de alimentos naturales, productos farmacéuticos y productos de tabaco. La absorción gastrointestinal de la cumarina es rápida.
5.2. Toxicocinética
Una amplia investigación ha descrito la absorción, el metabolismo y la excreción de la cumarina. La vía de exposición influye significativamente en los niveles sanguíneos y la toxicidad.
Las dosis en bolo oral dan lugar a concentraciones plasmáticas claramente superiores a las observadas en la ingesta alimentaria, a pesar de los niveles equivalentes de miligramos por kilogramo de peso corporal.
La exposición dérmica evita el metabolismo hepático inicial (efecto de primer paso). La cumarina en la sangre pasa primero por los pulmones, donde una parte significativa puede exhalarse antes del metabolismo hepático.
Los seres humanos metabolizan principalmente la cumarina en 7-hidroxicumarina no tóxica. La formación hepática de ácido o-hidroxiacético es mínima y se desintoxica rápidamente. La ausencia de abundantes células Clara en los pulmones humanos impide la generación pulmonar de epóxido y ácido o-hidroxiacético, incluso con dosis altas de cumarina.
Los estudios realizados con microsomas hepáticos humanos correlacionan una baja capacidad de 7-hidroxilación con una menor formación de epóxido.
5.3. Toxicidad aguda y a corto plazo
- Estudios en animales
Los valores de LD50 informados para la cumarina varían de 160 a 780 mg/kg de peso corporal, con variaciones atribuidas a la especie animal, la cepa y el estado de ayuno. Se ha observado una leve irritación de los ojos y la piel después de la exposición.
La exposición dietética a la cumarina en niveles ≥2500 ppm durante al menos cuatro semanas puede provocar una disminución del consumo de alimentos, una reducción del peso corporal y cambios microscópicos en el hígado. Concentraciones dietéticas más altas (1-2%) dan como resultado rechazo de alimentos y mortalidad.
La reproducción puede verse afectada negativamente en dosis altas que afectan significativamente el consumo de alimentos, pero no se han reportado efectos reproductivos o de desarrollo en dosis más bajas.
- Estudios en humanos
La exposición humana a la cumarina se produce a través del consumo de canela, té verde, miel de meliloto y otros alimentos. Se han notificado casos de hemorragia asociados con infusiones de hierbas que contienen haba tonka, meliloto y asperilla.
Las dosis farmacéuticas de cumarina varían de 70 a 7000 mg/día, siendo la dosis más común de 200 mg una o dos veces al día.
Se ha notificado con poca frecuencia hepatotoxicidad tras el uso de cumarina farmacéutica. Los cambios en las enzimas hepáticas asociados suelen ser reversibles al interrumpir el tratamiento y, a veces, incluso mientras se continúa el tratamiento.
Las tasas de incidencia notificadas varían de <0,1 a 6 %, según la población estudiada y la dosis. Aunque se han relacionado algunas muertes con el uso de cumarina, factores de confusión como las condiciones médicas preexistentes complican la interpretación causal.
Los estudios que investigan el polimorfismo CYP2A6 en humanos no han establecido una conexión con la disfunción hepática asociada a la cumarina.
La cumarina se ha sometido a pruebas de sensibilización en varios modelos, incluida la aplicación dérmica en cobayas, la prueba de hinchazón de la oreja en ratones y el ensayo de ganglio linfático local (LLNA). La cumarina pura arrojó constantemente resultados negativos, incluso en concentraciones de hasta el 50 % en estudios de LLNA recientes.
Sin embargo, una impureza clorada (6-clorocumarina) y una cumarina menos pura derivada del o-cresol han demostrado propiedades sensibilizantes, en consonancia con los casos de sensibilización informados que involucran derivados de la cumarina.
Las poblaciones humanas, a diferencia de los animales de laboratorio, pueden tener exposición preexistente a la cumarina o a sustancias con reactividad cruzada, lo que complica la evaluación de la sensibilización humana.
La actividad anticoagulante de la cumarina es significativamente menor que la de la warfarina. Los informes de casos sugieren que la cumarina puede potenciar los efectos de los antagonistas de la vitamina K, aunque el mecanismo subyacente sigue sin estar claro. La cumarina no se ha asociado con teratogenicidad ni efectos adversos sobre la reproducción en humanos.
5.4. Toxicidad crónica
- Estudios en animales
Se han realizado estudios exhaustivos de toxicidad y carcinogenicidad a largo plazo sobre la cumarina. Los principales efectos adversos observados en animales son una disminución del consumo de alimentos que conduce a una reducción del peso corporal y toxicidad hepática, en particular en ratas.
Se han notificado tumores hepáticos, aunque no metastásicos ni letales, en ratas expuestas a dosis altas (≥150 mg/kg de peso corporal) que redujeron significativamente el aumento de peso corporal. Se han identificado tumores pulmonares en ratones expuestos a dosis altas en bolo (≥150 mg/kg de peso corporal), pero no en aquellos expuestos a través de la dieta.
- Estudios en humanos
La exposición ocupacional al polvo de cumarina puede causar irritación respiratoria. Además, la cumarina puede actuar como un sensibilizador dérmico débil en individuos susceptibles, y el grado de sensibilización depende de la pureza de la sustancia. No se han documentado otros efectos adversos a largo plazo en humanos.
La Agencia Internacional para la Investigación sobre el Cáncer (IARC) ha clasificado la cumarina en el Grupo 3, lo que indica que no es clasificable como carcinógeno humano.
Toxicidad in vitro
La cumarina no es mutagénica y no se une al ADN. No muestra propiedades clastogénicas, lo que indica un impacto insignificante en los cromosomas.
Toxicidad reproductiva
A diferencia de la warfarina, la cumarina no es teratogénica.
Genotoxicidad
Múltiples estudios han demostrado de manera consistente que la cumarina no es genotóxica. Ha mostrado propiedades protectoras contra las mutaciones inducidas por doxorrubicina.
Carcinogenicidad
No hay evidencia concluyente para clasificar la cumarina como carcinógeno. De hecho, algunas investigaciones sugieren posibles efectos antioxidantes y antineoplásicos.
Manejo clínico de la sobredosis
Debido a la toxicidad relativamente baja de la cumarina, los protocolos específicos para el manejo de la sobredosis son limitados. Se pueden considerar medidas generales, como la descontaminación gástrica en casos de ingestión oral significativa. Se recomienda el control del índice internacional normalizado y de las pruebas de función hepática.
Ecotoxicidad
La cumarina exhibe baja toxicidad ambiental. Los estudios de toxicidad acuática han mostrado valores de CL50 de 56 mg/L para peces y valores de CE50 de 55 mg/L para Daphnia magna. La respiración de las algas se inhibe en concentraciones de laboratorio de 50 mmol/L.
Dada su persistencia relativamente baja, se espera que la cumarina se degrade fácilmente en el medio ambiente.
Referencias
- Coumarin; Kirk‐Othmer Encyclopedia of Chemical Technology. – https://onlinelibrary.wiley.com/doi/10.1002/0471238961.0315211302150919.a01.pub2
- Coumarins. – https://www.sciencedirect.com/science/article/abs/pii/B9780123864543007983
- https://www.sciencedirect.com/science/article/abs/pii/B0123694000002696
- https://onlinelibrary.wiley.com/doi/10.1002/mnfr.200900281
- https://www.sciencedirect.com/science/article/abs/pii/B9780124095472126204
- https://pubchem.ncbi.nlm.nih.gov/compound/Coumarin
