Crotonaldehído: Propiedades, Reacciones, Producción y Usos
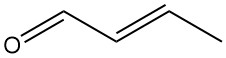
El crotonaldehído [4170-30-3], también conocido como 2-butenal, es un líquido incoloro con un olor acre y fuertes propiedades lagrimales. Tiene una fórmula química de CH3CH=CHCHO y existe como dos estereoisómeros: cis-crotonaldehído [15798-64-8] y trans-crotonaldehído [123-73-9].
El crotonaldehído disponible comercialmente contiene una mezcla de ambos isómeros, siendo el isómero trans la forma dominante (>95%) debido a su mayor estabilidad termodinámica.
El crotonaldehído se encuentra naturalmente en varias plantas y productos vegetales, incluidos los frijoles franceses, el aceite de colza y el aceite de soja.
Tabla de contenido
| Propiedad | Valor |
|---|---|
| Masa molecular | 70,09 g/mol |
| Punto de ebullición | 102,2 °C |
| Punto de fusión | -76 °C |
| Densidad (20°C) | 0,852 g/cm3 |
| Índice de refracción (n20D) | 1.438 |
| Calor de vaporización | 515 J/g |
| Azeótropo crotonaldehído-agua | 24,8 % en peso de H2O |
| Punto de ebullición del azeótropo | 84 °C |
| Solubilidad en agua (20°C) | 181g/L |
| Solubilidad del agua en crotonaldehído (20 °C) | 9,5 g/100 g |
| Presión de vapor (a 20 °C) | 4,3 kPa |
| Punto de inflamación | 13 °C |
| Temperatura de autoignición | 165 °C |
| Límites de explosión en el aire |
Inferior: 2,1% vol Superior: 15,5% vol. |
2. Reacciones químicas del crotonaldehído
El crotonaldehído es altamente reactivo debido a la presencia de un grupo carbonilo y un doble enlace carbono-carbono en su estructura. La contaminación con ácidos o álcalis fuertes inicia fácilmente reacciones de condensación exotérmica.
La exposición a ácidos fuertes cataliza la dimerización del crotonaldehído a dicrotonaldehído (5,6-dihidro-2,6-dimetil-2H-piran-3-carboxaldehído).
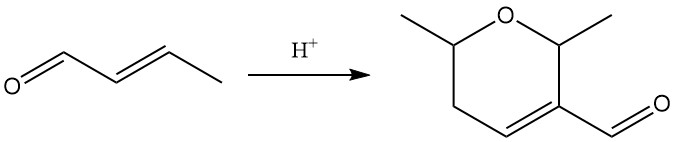
Las reacciones primarias del crotonaldehído incluyen hidrogenación, reducción, oxidación y adición.
Tanto el grupo carbonilo como el doble enlace C-C pueden sufrir reducción. La hidrogenación catalítica, que normalmente utiliza catalizadores de níquel o cobre, ofrece el enfoque más económico.
La hidrogenación selectiva del resto olefínico a temperaturas y presiones de reacción más bajas era un proceso empleado anteriormente para la producción de n-butanal. Actualmente, la hidroformilación del propeno es el método preferido para la síntesis de butiraldehído.
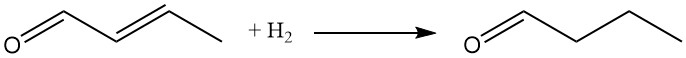
La hidrogenación de ambos grupos funcionales produce n-butanol, comúnmente producido hoy en día mediante hidrogenación de n-butiraldehído.
La hidrogenación catalítica selectiva en el grupo carbonilo conduce a alcohol crotílico (CH3CH=CHCH2OH).

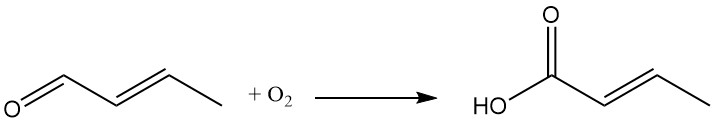
La oxidación del crotonaldehído da como resultado la formación de ácido crotónico.
La adición de varias moléculas a través del doble enlace del crotonaldehído lo convierte en un valioso intermediario químico. Por ejemplo, la adición de alcoholes o tioles al doble enlace olefínico, catalizada por un catalizador básico, es importante para la síntesis de 3-alcoxibutiraldehídos.
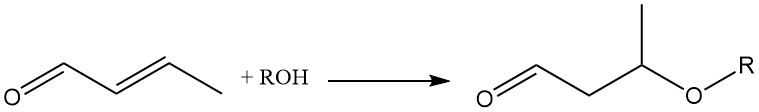
La adición de metanol al crotonaldehído forma el intermediario 3-metoxibutiraldehído, que se somete a hidrogenación y esterificación consecutivas para producir disolventes especiales como 3-metoxibutanol (1) y acetato de 3-metoxibutilo (2).

El crotonaldehído también se puede utilizar como dienófilo en las reacciones de Diels-Alder.
3. Producción de crotonaldehído
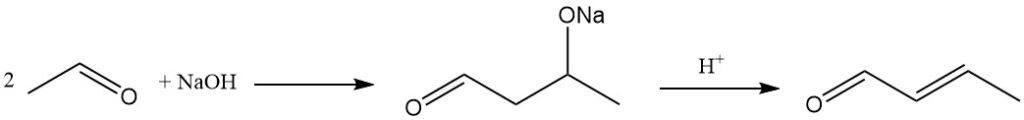
El método industrial dominante para la producción de crotonaldehído es la condensación aldólica de acetaldehído, seguida de la deshidratación del aldólico resultante y la posterior destilación. Este proceso produce un producto con alrededor del 99% de pureza.
La reacción de aldolización puede ser catalizada por una amplia gama de catalizadores básicos, incluidos catalizadores de metales alcalinos o alcalinotérreos, sales de amonio, zeolitas, tamices moleculares y materiales similares a la arcilla.
El ácido acético, los ácidos minerales o las resinas ácidas de intercambio catiónico se utilizan como catalizadores para el paso de deshidratación que convierte el aldol en crotonaldehído.
Celanese Chemicals y Daicel son importantes productores comerciales de crotonaldehído. En la Figura 1 se ilustra una unidad de producción continua de crotonaldehído simplificada.
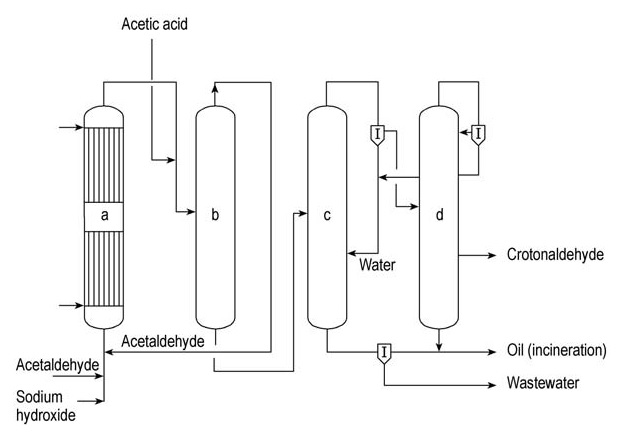
a) Reactor aldol; b) columna de extracción de acetaldehído; c) columna de destilación azeótropa; d) Columna de rectificación
En este proceso, el acetaldehído se somete a aldolización en un reactor aldólico refrigerado por agua (a) utilizando una solución acuosa de hidróxido de sodio como catalizador. Luego, el producto se neutraliza con ácido acético antes de introducirlo en una columna de extracción (b).
El acetaldehído sin reaccionar se recupera en la parte superior de esta columna y se recicla de nuevo al reactor aldólico (a). El producto del fondo de la columna (b), el aldol intermedio, se alimenta a la columna de destilación azeotrópica (c). Aquí, el aldol se deshidrata y se destila el azeótropo de crotonaldehído-agua.
Este azeótropo se separa posteriormente en agua y una fase acuosa de crotonaldehído que contiene aproximadamente un 10% de agua. El agua se recicla de nuevo a la columna de azeótropo (c), saliendo como producto del fondo.
La corriente acuosa de crotonaldehído luego se alimenta a la columna de rectificación (d), donde se forma otro azeótropo de crotonaldehído-agua y sale por encima. Este azeótropo se separa en agua, que se recicla a la columna de azeótropo (c), y crotonaldehído acuoso, que se recicla nuevamente a la columna de rectificación (d).
El crotonaldehído puro se obtiene como una corriente secundaria de esta columna.
Las fracciones pesadas se eliminan del fondo de la columna (d) y se combinan con residuos orgánicos de la columna azeotrópica (c) antes de incinerarse. Las aguas residuales generadas en la columna (c) se tratan en una planta de purificación de aguas residuales exclusiva.
Métodos de producción alternativos
Si bien la condensación aldólica de acetaldehído sigue siendo el método industrial dominante, se han explorado tecnologías alternativas. Un método es la oxidación de butadieno a su monoepóxido, seguida de la isomerización a crotonaldehído.
Este proceso tiene algunas similitudes con el proceso Wacker-Hoechst para la producción de acetaldehído a partir de etileno. Sin embargo, el uso de paraldol como alternativa al aldol para la producción de 1,3-butilenglicol de grado cosmético parece ser más prometedor que su aplicación en la síntesis de crotonaldehído.
Otros métodos, como la oxidación catalítica de olefinas, la deshidrogenación de alcohol alílico con aminas, la hidratación en fase de vapor de acetileno y la oxidación enzimática de 2-buteno no han alcanzado importancia práctica para la producción de crotonaldehído.
El crotonaldehído también se puede formar como subproducto durante la síntesis de 1,3-butilenglicol y en la producción de ácido acético mediante la carbonilación de metanol. Además, los procesos de combustión incompleta, como los que ocurren en los gases de escape de los automóviles, generan crotonaldehído como componente de los gases de escape.
4. Usos del crotonaldehído
El crotonaldehído se utiliza como precursor en la síntesis de diversos productos industriales.
Se utilizan grandes cantidades de crotonaldehído en la producción de ácido sórbico, un conservante alimentario común. La síntesis implica la condensación de crotonaldehído con cetena en presencia de sales orgánicas de zinc, seguida de la despolimerización del poliéster resultante, ya sea térmicamente o utilizando un ácido mineral.
El α-tocoferol, uno de los ocho componentes naturales con actividad de vitamina E, se sintetiza industrialmente mediante la condensación de fitol con 2,3,6-trimetilhidroquinona, que se formado a partir de crotonaldehído y dietilcetona mediante un proceso de cuatro pasos.
El 3-metoxibutanol se produce mediante la adición de metanol a crotonaldehído seguido de hidrogenación. Este producto y su éster de acetato se utilizan como disolventes especiales, especialmente valorados por su capacidad para controlar la viscosidad, el comportamiento de secado y el brillo en lacas y barnices.
El crotonaldehído es un precursor de una amplia gama de productos químicos intermedios. Un ejemplo principal es el ácido crotónico, obtenido por oxidación del crotonaldehído. Estos intermediarios derivados del crotonaldehído se utilizan en varios sectores, entre ellos:
- Productos farmacéuticos y biocompatibles/médicos
- Agroquímicos
- Resinas, espesantes poliméricos
- Pinturas y revestimientos
- Colorantes
- Cauchos y antioxidantes del caucho
- Endurecimiento de gelatina
- Adhesivos
- Curtido y encolado de cueros (cuero y papel)
- Brillantes para metales
- Lubricantes
- Inhibidores de corrosión
5. Toxicología del crotonaldehído
El crotonaldehído plantea un riesgo importante para la salud debido a sus potentes propiedades irritantes. Aquí hay un desglose de sus efectos:
Efectos sobre la salud humana
- El crotonaldehído irrita los ojos, la piel y el tracto respiratorio. Los estudios sugieren distintos umbrales de irritación, que van desde 0,035 ppm a 0,56 ppm para la detección de olores y la irritación, respectivamente.
- La inhalación puede causar sensación de ardor en la nariz y el tracto respiratorio, lagrimeo, tos, broncoconstricción y potencialmente edema pulmonar o daño pulmonar profundo.
- El crotonaldehído está presente en el humo del tabaco, los gases de escape de los motores y la quema de leña. También se produce de forma natural en algunos alimentos.
Límites de exposición laboral
En ausencia de niveles de exposición ocupacional específicos, se pueden utilizar directrices como los AEGL (niveles de referencia de exposición aguda) y los ERPG (directrices de planificación de respuesta a emergencias) para la evaluación de riesgos durante accidentes o emergencias.
Datos toxicológicos
- Toxicidad aguda:
- LD50 oral (rata): 174 mg/kg
- CL50 por inhalación (rata, macho, 4 h): 336 mg/m3
- LD50 dérmica (conejillo de indias): 26 mg/kg
- Genotoxicidad: si bien el crotonaldehído forma aductos in vitro (en un laboratorio), la evidencia de mutagenicidad in vivo es menos clara.
- El crotonaldehído está clasificado como mutagénico según el Reglamento CLP (CE) nº 1272/2008.
Efectos en animales y microorganismos
Animales:
- Los peces son las especies más sensibles al crotonaldehído, con una CL50 de 96 horas (concentración letal para el 50% de la población) de 0,65 mg/L para la trucha arco iris.
- El crotonaldehído irrita el tracto respiratorio en varios animales, siendo las ratas las más sensibles (inhalación LC50 de 4 horas de 120 ppm).
Los microorganismos son menos susceptibles que los animales; Pseudomonas putida muestra una EC10 de 18 horas (concentración del efecto para el 10% de la población) de 10,4 mg/l.
El crotonaldehído está clasificado como un contaminante marino a pesar de su alta biodegradabilidad (>83%).
Referencias
- Crotonaldehyde and Crotonic Acid; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a08_083.pub2
- CROTONALDEHYDE; IARC MONOGRAPHS VOLUME 63. – https://publications.iarc.fr/81
