Bencilamina
La bencilamina es un compuesto orgánico con la fórmula química C6H5CH2NH2. Es un líquido incoloro con un olor característico a amina. Es una amina primaria con un anillo de benceno adherido.
Tabla de contenido
1. Propiedades físicas de la bencilamina
| Propiedad | Valor |
|---|---|
| Sinónimos | α-aminotolueno, fenilmetilamina |
| Fórmula química | C7H9N |
| Peso molecular | 107,16 g/mol |
| Apariencia física | Líquido incoloro con un débil olor parecido a una amina |
| Solubilidad | Miscible con agua, alcohol y éter dietílico |
| Punto de ebullición | 184,5 °C a 101,3 kPa 90 °C a 1,6 kPa |
| Punto de solidificación | <-30 °C |
| Presión de vapor | ca. 60 Pa a 20 °C ca. 130 Pa a 30 °C 520 Pa a 50 °C |
| Calor de vaporización | 49 kJ/mol |
| Calor de combustión | 4058,7 kJ/mol a 101,3 kPa y 20 °C |
| Índice de refracción a 20 °C | 1,5401 |
| Densidad a 20 °C | 0,9813 |
| Constante dieléctrica | 4,6 a 20,6 °C |
| Constante de disociación electrolítica en agua | 2,35 × 10-5 a 20 °C |
| Viscosidad | 1,78 mPa·s a 21,2 °C 0,295 mPa·s a 178,2 °C |
| Tensión superficial | 38,82 × 10-5 N/cm a 21,1 °C 31,70 × 10-5 N/cm a 88 °C |
| Temperatura de autoignición | 390°C |
| Punto de inflamación | 65 °C |
| Límite de explosión | 0,9 % (inferior) a 14 % (superior) |
| Momento dipolar (20 °C) | 1,18 D (puro), 1,25 D en tolueno, 1,29 D en hexano, 1,30 D en ciclohexano, 1,33 D en benceno |
| Viscosidad dinámica | 0,01596 g cm-1 s-1 a 25 °C |
| Absorción máxima lmax en agua | 255,9 nm (e 249 L mol-1 cm-1) |
| Susceptibilidad magnética | −75,3 × 10-6 cm3/mol |
2. Reacciones químicas de la bencilamina
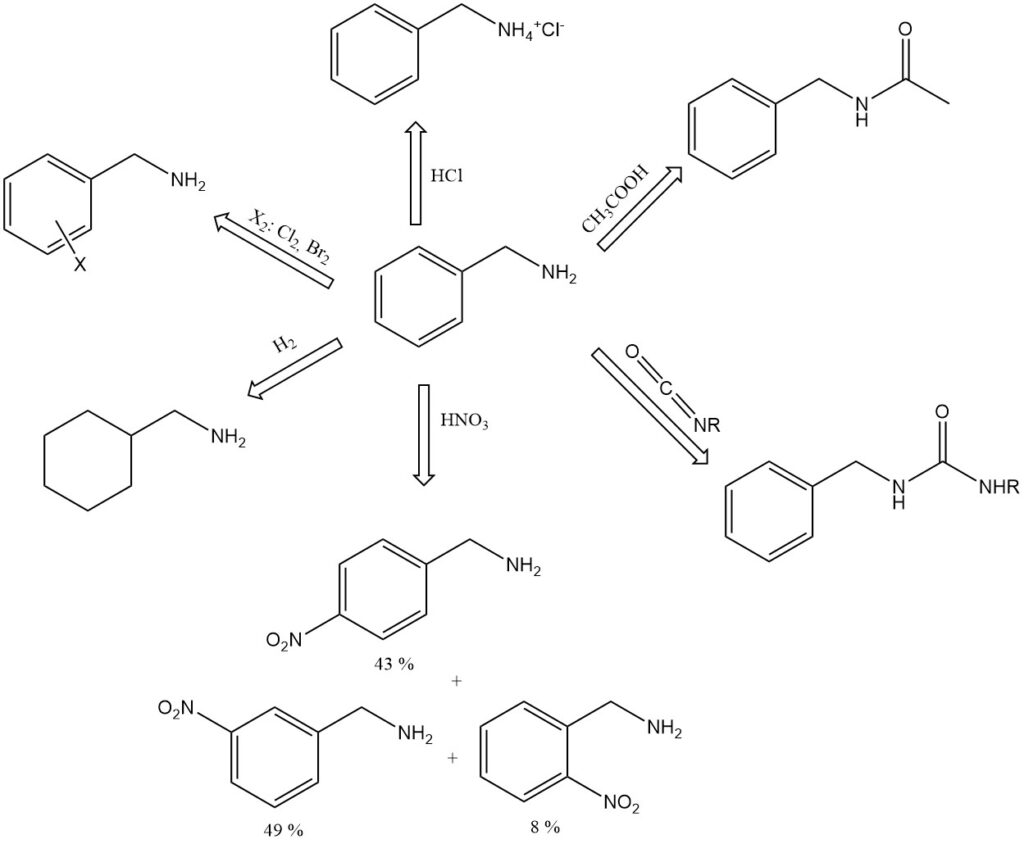
La bencilamina es una base más fuerte que sus isómeros de toluidina y es fuertemente alcalina incluso cuando se diluye con un poco de agua (pH 11,6 en 100 g/L de agua).
Forma compuestos de adición con fenol (1:3, pf 15,3 °C), p-cresol (1:1, pf −6 °C) y ácido fórmico (1:1, pf 81 °C). Ejemplos de sales de bencilamina incluyen el clorhidrato, C6H5CH2NH+3 Cl−, pf 260 °C (descomp.), y el picrato, pf 194 °C.
La bencilamina absorbe dióxido de carbono del aire para formar una sal sólida de ácido carbámico.
Cuando se hierve con ácido acético glacial, la bencilamina forma N-acetilbencilamina.
La bencilamina reacciona con isocianatos para dar ureas sustituidas, C6H5CH2NHCONHR.
El ácido nítrico nitrata la bencilamina en el núcleo aromático para dar 8% de orto, 49% de meta y 43% de paranitrobencilamina.
La hidrogenación catalítica de bencilamina da hexahidrobencilamina, C6H11CH2NH2.
La bencilamina puede sufrir reacciones aromáticas en el anillo de benceno, como alquilación, acilación, sulfonación y halogenación.
3. Producción de bencilamina
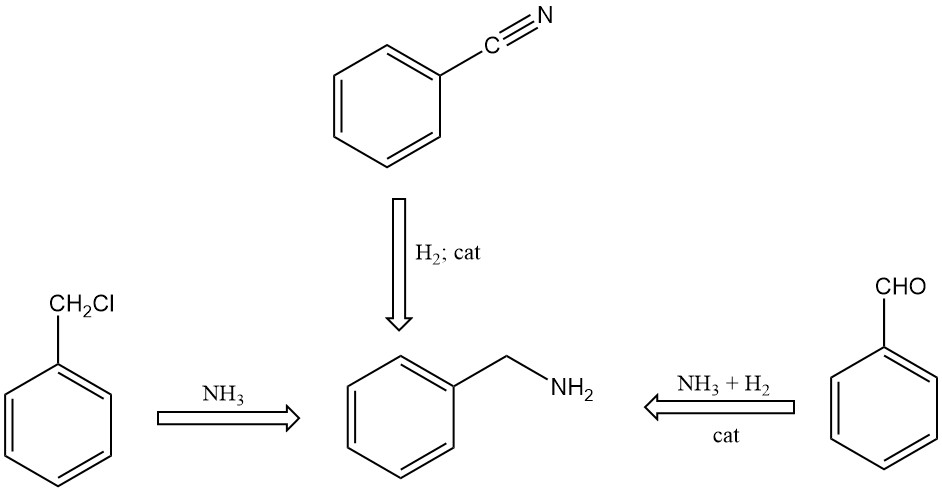
Existen varios métodos para sintetizar bencilamina:
- Reacción del cloruro de bencilo con amoníaco en una solución acuosa.
- Hidrogenación catalítica de benzonitrilo.
- Reacción de benzaldehído con amoníaco en presencia de hidrógeno y catalizadores, utilizando disolventes orgánicos en la mezcla de reacción.
La bencilamina se produce por la ruta del benzaldehído de la siguiente manera:
- Combine 8 kg de níquel Raney (equivalente a aproximadamente 4 kg de 100% Ni), 10 g de ácido acético glacial, 110 kg de amoníaco y una mezcla de 250 kg de metanol y 500 kg de benzaldehído en un autoclave de acero de 1200 L. .
- Hidrogenar la mezcla a 100 °C y 15 MPa durante 3 a 5 horas, reponiendo el hidrógeno cada 10 minutos aproximadamente. Una vez que cese el consumo de hidrógeno, mantenga el recipiente de reacción a la misma temperatura y presión durante 30 minutos más.
- Separar el catalizador de los productos de reacción utilizando un filtro a presión. El filtrado contiene aproximadamente 470 kg de bencilamina para un rendimiento del 93 %, junto con trazas de alcohol bencílico, dibencilamina, base de Schiff (N-benzalbencilamina), metanol, agua de reacción y amoníaco, para un rendimiento del 93 %.
- La destilación al vacío se utiliza para obtener bencilamina de la pureza técnica necesaria.
También se ha identificado bencilamina en las hojas y flores de la planta Reseda media.
4. Usos de la bencilamina
La bencilamina se utiliza en la producción de textiles sintéticos, pinturas e inhibidores de corrosión. También se utiliza como intermediario en la producción de productos farmacéuticos y pesticidas. En estos casos, se suele utilizar bencilamina como nitrógeno protegido.
La bencilamina es un intermedio versátil y un componente básico en una variedad de aplicaciones, incluidos recubrimientos y protección de cultivos.
Se utiliza en la fabricación industrial de numerosos productos farmacéuticos, incluidos alniditan, lacosamida, moxifloxacina y nebivolol.
La bencilamina también se utiliza para fabricar el explosivo militar hexanitrohexaazaisowurtzitane (HNIW).
5. Toxicología de la bencilamina
La bencilamina es fácilmente biodegradable, pero tiene un efecto débil y nocivo para la vida acuática (clase alemana de peligros para el medio ambiente acuático: 1, WGK 1).
La toxicidad aguda de la bencilamina varía entre organismos:
- Pseudomonas fluorescens (bacteria): EC0 500 mg
- Scenedesmus quadricauda (alga): EC10 96-h 6 mg
- Dafnia magna: CE50 48 h 60 mg
- Leuciscus idus (pez): EC0 48 h 20 mg
- Pimephals promelas (pescado): CE50 96 h 102 mg
La bencilamina puede provocar quemaduras en la piel y los ojos y puede provocar sensibilización. Si se expone a la bencilamina, enjuague inmediatamente con agua y lave la piel con jabón. Se debe disponer de una solución acuosa de ácido acético al 5% para neutralizar la piel contaminada. Si se ingiere, diluir con agua potable y enjuagar la boca. En casos de riesgo de inhalación, utilizar filtros ABEK en mascarillas respiratorias (DIN 3181).
La bencilamina mostró un resultado negativo en la prueba de Ames, lo que indica que no hay efecto mutagénico. Los valores agudos de LD50 oral y percutánea para ratas son 1130 mg/kg y 1340 mg/kg, respectivamente. Está clasificado como clase de toxicidad 3 en Suiza.
Las ratas sobrevivieron un período de dos semanas después de 3 horas de exposición por inhalación de bencilamina en todo el cuerpo, pero el 17% de las ratas murieron después de 5 horas de exposición.
Referencias
- Benzylamine; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a04_009.pub2
- https://products.basf.com/global/en/ci/benzylamine.html
