Alquilación de compuestos aromáticos
Alquilación de Friedel-Crafts
La alquilación de Friedel-Crafts de compuestos aromáticos implica una sustitución electrófila catalizada por ácido, en la que un grupo alquilo reemplaza un hidrógeno aromático. Para este fin se emplea habitualmente una amplia gama de agentes alquilantes, tales como olefinas, haluros de alquilo y alcoholes.
Esta reacción se puede aplicar a varios sustratos aromáticos, incluidos compuestos heteroaromáticos e incluso compuestos como el ferroceno. Estas reacciones suelen ser rápidas y exotérmicas y, a menudo, se llevan a cabo en condiciones suaves en la fase líquida.
Sin embargo, en algunos casos, para ciertos sustratos se utilizan procesos en fase de vapor con condiciones más estrictas. Cuando se utilizan olefinas, haluros de alquilo y alcoholes como agentes alquilantes, las reacciones generales se desarrollan de la siguiente manera:
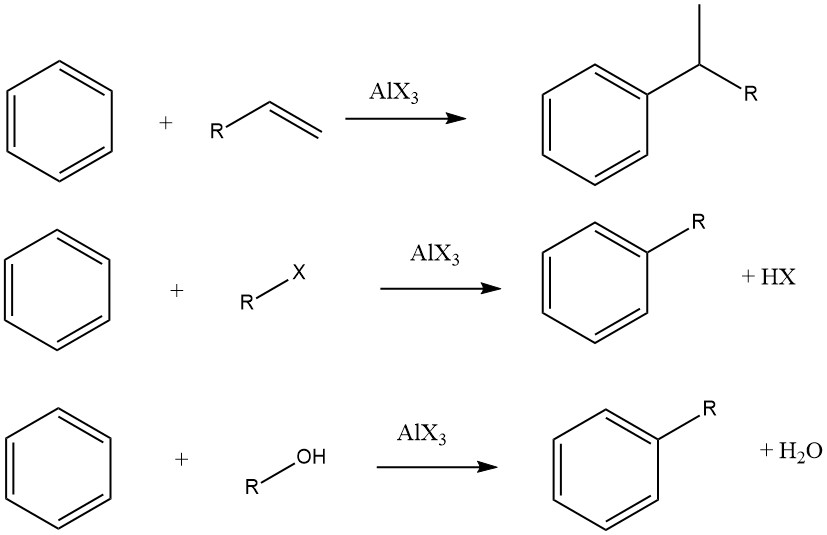
Tabla de contenido
El grado de isomerización del resto alquilo y el cumplimiento de la regla de Markovnikov durante el proceso de adición varían dependiendo de la acidez del catalizador.
1.1. Catalizadores para la alquilación de Friedel-Crafts
Los catalizadores utilizados en el proceso de alquilación de Friedel-Crafts son ácidos y su eficacia depende de varios factores, incluidas las condiciones de reacción, los agentes alquilantes y los sustratos aromáticos. Tanto los ácidos de Lewis como los ácidos de Brønsted pueden actuar como catalizadores activos, y los catalizadores utilizados con frecuencia se clasifican según sus estructuras químicas.
| Grupo | Ejemplos | Tipo de ácido |
|---|---|---|
| Halogenuros ácidos | AlCl3, AlBr3, SnCl4, SbCl5, FeCl3 | Ácidos de Lewis |
| Alquilos y alcóxidos metálicos | AlR3, BR3, ZnR2, Al(OPh)3 | Ácidos de Lewis |
| Ácidos protónicos | HCl, HCl – AlCl3, H2SO4, HF, H3PO4 | Ácido de Brønsted |
| Óxidos ácidos y derivados | zeolitas, óxidos mixtos y superácidos sólidos, arcillas, heteropoliácidos | Ácido de Brønsted/Lewis |
| Ácidos soportados | H3PO4 – SiO2, BF3 – Al2O3 | Ácido de Brønsted/Lewis |
| Resinas de intercambio catiónico | Permutit Q, Amberlite IR 112, Dowex 50, Nafion – sílice, Deloxan | Ácido de Brønsted |
Tradicionalmente, los haluros ácidos como ALCL3 o ALBR3, y los ácidos de protones como HCl, HF o H2SO4, se han empleado en tierra diatomeas. Sin embargo, se está produciendo un cambio hacia la sustitución de estos catalizadores con zeolitas y óxidos inorgánicos debido a su amistad ambiental, facilidad de manejo e implicaciones de menor costo en el diseño del proceso.
La presencia de bases, especialmente los compuestos de nitrógeno orgánicos, reduce la acidez y la eficiencia del catalizador. El oxígeno, incluso a concentraciones tan bajas como 20 ppm, puede conducir a la formación de materiales resinosos pesados en el catalizador. Los dienos como el butadieno en una alimentación de buteno también contribuyen a la producción de sustancias resinosas o alquitranadas en el catalizador.
Curiosamente, los rastros de humedad u otros proveedores de protones pueden mejorar la actividad catalítica, particularmente para los ácidos de Lewis. Sin embargo, las cantidades más altas de estos compuestos son perjudiciales para el rendimiento del catalizador.
En algunos casos, los venenos de catalizador leve, como los compuestos nitro orgánicos, se usan intencionalmente para reducir la acidez del catalizador y prevenir reacciones laterales como la isomerización. Estos compuestos nitro orgánicos forman complejos estequiométricos con ácidos Lewis, lo que resulta en procesos de alquilación más limpios con rendimientos moderados.
Además, ciertos aductos como BF3 · OET2 o BF3 · C6H5OH actúan como catalizadores suaves de Friedel-Crafts. Las impurezas en los catalizadores, como la presencia de cloruro férrico en el cloruro de aluminio, pueden disminuir significativamente el rendimiento del producto y afectar el curso de la reacción catalizada por los ácidos de Lewis.
1.2. Isomerización de los agentes alquilantes
Debido a la naturaleza ácida de las condiciones de reacción en la alquilación de Friedel-Crafts, los reactivos de alquilación a menudo sufren reordenamientos y tienden a transformarse en el isómero más ramificado posible. Esto se demuestra en reacciones de benceno con cloruro de propil, donde el isopropilbenceno es el producto principal y con cloruro de N-butilo, lo que conduce a la formación de Sec-butilbenceno.
En estos casos, la isomerización del agente alquilante se inicia mediante la migración de un átomo de hidrógeno en lugar de reordenamientos directos de carbono. La fuerza impulsora detrás de esta isomerización es la formación de la carbocatión más estable, siguiendo la tendencia habitual: primaria <secundaria <terciaria.
Por ejemplo, cuando el benceno está alquilado con 1-olefinas lineales de cadena larga, la reacción conduce no solo a la formación de 2-alquilbenceno sino también a una distribución aleatoria del sustituyente de fenilo a lo largo de la cadena alquilo en la mayoría de los casos.
Este efecto también podría atribuirse a la isomerización de los productos de reacción alquilados, ya que el N-butilbenceno se transforma en Sec-butilbenceno en presencia de un catalizador de Crafts Friedel como ALCL3.
Bajo ciertas condiciones de reacción, la alquilación de benceno con haluros de alquilo terciario puede dar como resultado la formación de alquilbencenos secundarios en lugar de alquilbencenos terciarios.
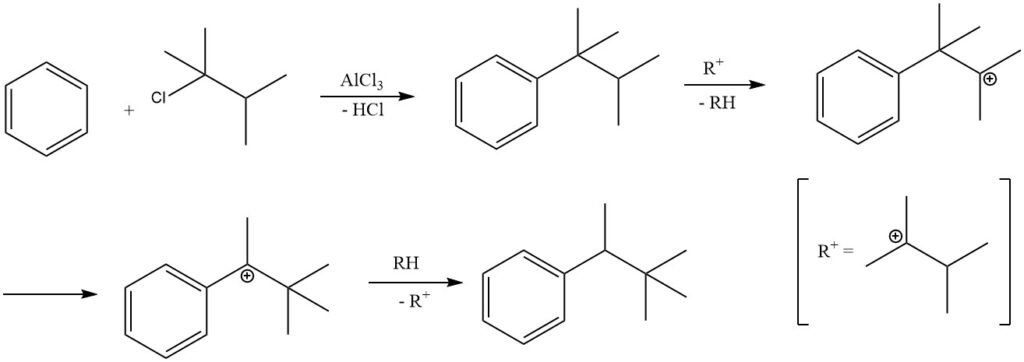
Por ejemplo, la alquilación de benceno con 2-cloro-2,3-dimetilbutano produce predominantemente 2,2-dimetil-3-fenilbutano debido a la isomerización del producto primario terc-hexilbenceno. El aislamiento del producto primario, terc-hexilbenceno, sólo es posible cuando se emplean catalizadores menos activos, como el cloruro férrico.
1.3. Reactividad de sustratos aromáticos
La sustitución electrófila de compuestos aromáticos en la alquilación de Friedel-Crafts está influenciada por la presencia de sustituyentes en el sustrato aromático. Los sustituyentes donadores de electrones como alquilo, NR2 u OR (donde R es un grupo alquilo) aumentan la reactividad, lo que hace que el nuevo sustituyente entre preferiblemente en la posición orto o para.
Como resultado, cuando el benceno se alquila con olefinas, se forma benceno monosustituido. Sin embargo, este benceno monosustituido reacciona más rápido con otra molécula de olefina que el propio benceno, dando lugar a una mezcla compleja de bencenos mono y polialquilados.
El grado de polisustitución se ve afectado por las condiciones de reacción y se reduce por el impedimento estérico de los grupos alquilo voluminosos. Las olefinas voluminosas como el ciclohexeno o las olefinas lineales C6 – C18 permiten buenos rendimientos de monoalquilación en benceno.
El etileno o el propeno se pueden monoalquilar mediante el reciclaje de productos polialquilados y la elección cuidadosa de las condiciones de reacción, como se ve en la síntesis industrial de etilbenceno y cumeno.
En la alquilación de bencenos monosustituidos predominan inicialmente los isómeros orto y para. Sin embargo, la isomerización posterior a menudo da como resultado una mezcla en equilibrio más rica en metaproducto.
La sustitución orto sólo se favorece si está estéricamente impedida. Por ejemplo, la reacción de benceno y 4-metilciclohexeno catalizada por HF produce un 75% de derivado monoalquilo y un 25% de derivado dialquilo, siendo el 75% el isómero para y sólo el 25% el isómero meta.
De manera similar, la alquilación de cumeno por 2-buteno sobre BF3 – H3PO4 produce un 91% de paraproducto, y la dialquilación de benceno con propeno sobre sílice – alúmina da preferentemente p-diisopropilbenceno, adecuado para la síntesis de ácido tereftálico e hidroquinona.
La sustitución del benceno por haluros desactiva la reacción. Los fenoles o éteres fenílicos reaccionan mucho más rápido que el benceno en la alquilación debido a la densidad electrónica significativamente mayor en las posiciones orto y para.
En materiales microporosos, las reactividades, selectividades de productos y preferencias de isómeros dependen en gran medida del tipo, número y fuerza de los sitios ácidos y de la geometría de los poros de la zeolita. La alquilación utilizando catalizadores sólidos generalmente requiere temperaturas más altas, con la excepción de ácidos sólidos muy fuertes, como los superácidos sólidos.
1.4. Desalquilación y Transalquilación
Muchos de los catalizadores utilizados para alquilar compuestos aromáticos también pueden promover la reacción inversa de alquilación, especialmente a temperaturas más altas. Por ejemplo, cuando los alquilbencenos se calientan con AlCl3, se forman mezclas de benceno y bencenos polialquilados mediante alquilación inversa.
La tendencia de los compuestos alquilaromáticos a sufrir desproporción también depende de la estructura del sustituyente alquilo, siguiendo el orden: terc-C4H9 > iso-C3H7 > n-C3H7 > C2H5 > CH3.
La desproporcionación y transalquilación de metilbencenos ocurren a 300 – 450 °C en presencia de catalizadores ácidos sólidos como SiO2 – Al2O3, mientras que la desproporción y transalquilación de etilbencenos e isopropilbencenos tienen lugar por debajo de 100 °C con catalizadores típicos de Friedel-Crafts.
La transferencia intermolecular de grupos alquilo (transalquilación) se utiliza en diversos procesos industriales. Por ejemplo, en la síntesis de etilbenceno, el producto de dialquilación no deseado reacciona con un exceso de benceno fresco para lograr una alta conversión de etileno en etilbenceno.
En presencia de un exceso de BF3 – HF, la desproporción de monoalquilbencenos produce predominantemente el isómero meta. Esto se debe a la alta estabilidad del complejo [m-Et2C6H5]+[BF4]−. Se utiliza comercialmente un tipo similar de complejo para extraer selectivamente m-xileno de mezclas de compuestos aromáticos C8.
El equilibrio entre las reacciones de alquilación y desalquilación explica la distribución de productos en la alquilación de compuestos aromáticos sustituidos. Inicialmente se forman los isómeros orto y para, que pueden aislarse con tiempos de reacción cortos (control cinético). Sin embargo, con tiempos de reacción prolongados, estos isómeros se isomerizan en metaisómeros más estables (control termodinámico).
Comercialmente, los procesos de desalquilación se utilizan para convertir tolueno en benceno, isomerizar m-xileno a los derivados orto y para deseados y desproporcionar tolueno en benceno y xilenos. Estos procesos aprovechan el comportamiento de equilibrio del compuesto alquilaromático.
2. Alquilación del benceno
La alquilación del benceno encuentra tres aplicaciones comerciales principales:
1. Alquilación con etileno para producir etilbenceno, que sirve como intermediario para la producción de estireno. La capacidad de producción mundial de etilbenceno fue de aproximadamente 20 millones de toneladas métricas por año en 1991.
2. Alquilación con propeno para producir cumeno, que es un intermediario para la producción de fenol, con acetona como subproducto. La capacidad de producción mundial de cumeno fue de alrededor de 7,5 millones de toneladas métricas por año en 1992.
3. Alquilación con olefinas de cadena larga que contienen entre 10 y 18 átomos de carbono para producir alquilbencenos, que luego se sulfonan para producir compuestos tensioactivos. La capacidad de producción de alquilbencenosulfonatos lineales (LAB) en 1992 era de aproximadamente 180.000 toneladas métricas por año.
2.1. Alquilación de benceno con etileno
La alquilación de benceno con etileno da como resultado la formación de etilbenceno, una reacción rápida y exotérmica.
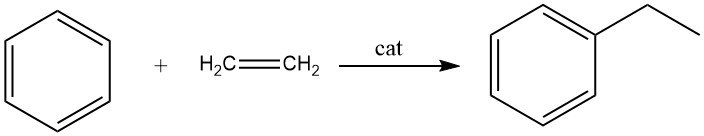
Durante este proceso se producen cantidades significativas de polietilbencenos como productos secundarios. La alquilación se puede llevar a cabo tanto en fase líquida como en fase vapor.
En los procesos en fase líquida, el AlCl3 es el catalizador más utilizado, pero también se utilizan otros catalizadores como BF3, FeCl3, ZrCl4, SnCl4, H3PO4 y fosfatos alcalinotérreos. La reacción normalmente se lleva a cabo a presión atmosférica y temperaturas que oscilan entre 85 y 95 °C.
La alquilación del benceno en fase de vapor se practica ampliamente, especialmente en los Estados Unidos. Generalmente se lleva a cabo a aproximadamente 300 °C y 40 – 65 bar utilizando catalizadores ácidos heterogéneos como Al2O3-SiO2 o H3PO4-SiO2.
Para mejorar la selectividad a la monoalquilación, se utiliza una relación baja de etileno-benceno (0,2: 1,0). El proceso Alkar, desarrollado por Universal Oil Products, se emplea comercialmente en varias plantas y utiliza trifluoruro de boro soportado sobre alúmina anhidra modificada como catalizador no corrosivo.
El proceso Alkar permite un amplio rango de concentración de etileno (5 – 95 %) en el gas de alimentación, lo que permite el uso de gases residuales del craqueo catalítico o de la parte superior del desmetanizador, o etileno de alta pureza. Las condiciones del proceso suelen implicar temperaturas de alrededor de 300 °C y presiones de alrededor de 60 bar, lo que lleva a la conversión completa de etileno.
La distribución de isómeros obtenida utilizando el catalizador Alkar para la alquilación de benceno con etileno es la siguiente:
Dietilbencenos:
1,2- (26%);
1,3- (49%); y
1,4- (25%).
Trietilbencenos:
1,2,3- (3%);
1,2,4- (35%); y
1,3,5- (62%).
Los catalizadores de zeolita han ganado un interés significativo para la etilación del benceno. Mobil Oil y Badger introdujeron un proceso en fase de vapor de lecho fijo utilizando zeolitas ZSM-5 patentadas, realizadas a 420 – 430 °C y 15 – 20 bar.
Se puede utilizar etileno puro o diluido como materia prima después de la purificación. Los polialquilbencenos se pueden reciclar para transalquilación, lo que da como resultado un alto rendimiento final de etilbenceno (98 – 99 % en moles). Los catalizadores a base de zeolita tienen ventajas sobre los catalizadores líquidos ácidos de Brønsted o Lewis, ya que no son corrosivos y son ambientalmente benignos, lo que simplifica la construcción, el manejo y la eliminación.
Otro proceso basado en zeolita llamado proceso EBMax, que utiliza el catalizador de zeolita MCM-22 patentado por Mobil, opera en fase líquida. Además, un catalizador a base de zeolita desarrollado por Unocal se emplea en una tecnología de alquilación en fase líquida de lecho fijo con licencia de Lummus/Unocal/UOP.
2.2. Alquilación de benceno con propeno
La alquilación de benceno con propeno conduce a la producción de cumeno, que es una reacción exotérmica. El cumeno es un compuesto esencial utilizado principalmente en la síntesis de fenol con acetona como coproducto. Una pequeña porción de cumeno también se utiliza en la producción de α-metilestireno.
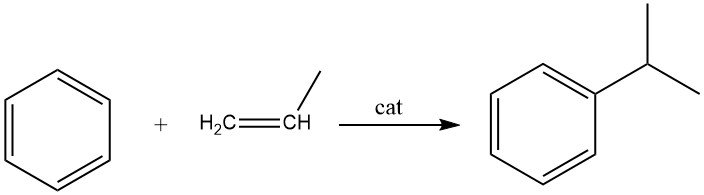
Tanto los procesos en fase líquida como los de fase vapor se emplean comercialmente para la síntesis de cumeno. El proceso en fase líquida ampliamente utilizado por Universal Oil Products utiliza un catalizador de ácido fosfórico sólido (SPA) soportado sobre tierra de diatomeas.
La reacción se lleva a cabo a 15 – 35 bar y temperaturas de 200 – 250 °C. Para evitar la polialquilación y lograr una alta conversión de propeno (aproximadamente 94%), se requiere una relación molar de benceno a propeno de 5:1. La conversión disminuye al 70% cuando se utiliza una relación de alimentación de benceno-propeno de 4:1.
El aumento de la presión y la temperatura mejora la conversión en lugar de los rendimientos de cumeno. Además del catalizador SPA, también se utilizan ácido sulfúrico y AlCl3 para la producción de cumeno.
Varias empresas, como Mobil/Raytheon, UOP, CDTech, Dow/Kellogg y Enichem, desarrollaron nuevas tecnologías de producción de cumeno basadas en catalizadores de zeolita. Estos procesos suelen implicar dos reactores y una unidad de destilación.
El primer reactor realiza la alquilación, mientras que el segundo reactor transalquila los extremos pesados (tri y poliisopropilbencenos) con benceno fresco.
La zeolita MCM-22 de Mobil, la zeolita patentada de UOP en el proceso QMax, la zeolita mordenita altamente desaluminada de Dow y el catalizador de zeolita BEA de Enichem son ejemplos de zeolitas utilizadas en estos procesos.
Además, el cumeno se puede alquilar adicionalmente con propeno utilizando un catalizador de silicato de aluminio pretratado en fase líquida bajo presión a 150 – 250 °C. Esto conduce a la producción principalmente de p-diisopropilbenceno y m-diisopropilbenceno, con sólo trazas del isómero orto.
Los isómeros se pueden separar por destilación y la mezcla de m-diisopropilbenceno y o-diisopropilbenceno se puede isomerizar para producir adicionalmente p-diisopropilbenceno mediante transalquilación con benceno. Los diisopropilbencenos también son intermediarios importantes en la producción de hidroquinona o resorcinol.
2.3. Alquilación de benceno con olefinas superiores
Los monoalquilbencenos con 10 a 14 átomos de carbono en la cadena alquílica, como el dodecilbenceno, desempeñan un papel importante como intermediarios en la producción de alquilbencenosulfonatos, ampliamente utilizados en productos detergentes aniónicos comerciales (tensioactivos).
Hasta aproximadamente 1965, la olefina primaria utilizada para esta reacción era el tetrámero de propeno. Sin embargo, debido a preocupaciones medioambientales relacionadas con la biodegradabilidad de los detergentes a base de tetrámero de propeno, la industria giró hacia los alquilbencenosulfonatos lineales.
Actualmente se utilizan olefinas lineales con entre 10 y 14 átomos de carbono como materia prima para la producción de alquilbencenosulfonato. La reacción normalmente está catalizada por HF, H2SO4 o AlCl3 líquidos, y las condiciones de reacción adecuadas son las siguientes:
- HF: 0 – 10 °C, relación molar de benceno a alqueno de 4 – 10 y 2 – 3 kg de alqueno por kilogramo de HF.
- H2SO4: 10 – 30 °C, relación molar de benceno a alqueno de 4 – 5 y 2 volúmenes de alqueno por volumen de 96 – 98 % de H2SO4.
- AlCl3: 55 – 60 °C, relación molar de benceno a olefina de 3 – 4 y 25 moles de alqueno por mol de AlCl3.
El proceso HF se considera el más económico en términos de consumo de catalizador. Se lleva a cabo en fase líquida a presión atmosférica y 10 °C. Son necesarios una agitación y un enfriamiento eficaces para controlar la reacción exotérmica y determinar los tiempos de reacción.
El producto se separa del ácido en un sedimentador, se lava y luego se destila a presión atmosférica para recuperar el benceno y a presión reducida para aislar los alquilbencenos.
Recientemente, se han descrito en la literatura algunos catalizadores de alquilación sólidos, pero debido a la disminución de la demanda de alquilbencenos lineales (LAB) en las regiones industrializadas, solo el proceso Detal de UOP ha comercializado una nueva tecnología que utiliza un catalizador no corrosivo para reemplazar el HF. Este proceso utiliza un catalizador de sílice fluorada y alúmina y opera en fase líquida a alrededor de 130 °C, logrando una alta linealidad y conversión.
Las propiedades detergentes de los alquilbencenosulfonatos están influenciadas por el grado de ramificación de la cadena lateral alquilo, siendo óptimo de tres a cinco grupos metilo en el dodecilbenceno. La posición del grupo fenilo en la cadena alquílica también afecta las propiedades detergentes.
La alquilación de Friedel – Crafts conduce a una mezcla de productos en equilibrio con una distribución aleatoria del fenilo a lo largo de la cadena alquílica. La composición del producto está influenciada por la naturaleza del catalizador, y diferentes catalizadores favorecen diferentes isómeros de monoalquilbencenos.
Los ácidos de Lewis como el AlCl3 son capaces de isomerizar los fenilalcanos formados, mientras que los ácidos protónicos isomerizan sólo las olefinas antes de la alquilación final del benceno.
2.4. Alquilación de benceno con cloruros de alquilo
Comercialmente, la alquilación de benceno con cloruros de alquilo es otro método utilizado para producir alquilatos de detergentes. El cloruro de alquilo, obtenido de la cloración de parafinas, contiene alrededor de un 70% de parafina. Esta mezcla se hace reaccionar con un gran exceso de benceno en una torre de alquilación esmaltada, utilizando AlCl3 como catalizador, a 80 °C.
Durante la reacción, se forma cloruro de hidrógeno en cantidades estequiométricas, lo que garantiza una mezcla completa de los reactivos y se separa en la parte superior del reactor.
Luego, los productos se separan del catalizador en un sedimentador, se neutralizan, se lavan y se destilan para recuperar benceno y parafina, que se reciclan. Los alquilatos se purifican adicionalmente mediante destilación a presión reducida.
Un desafío de este proceso es la formación de cantidades considerables de derivados de indano y tetralina como subproductos debido a la presencia de impurezas de dicloroalcano en el cloruro de alquilo.
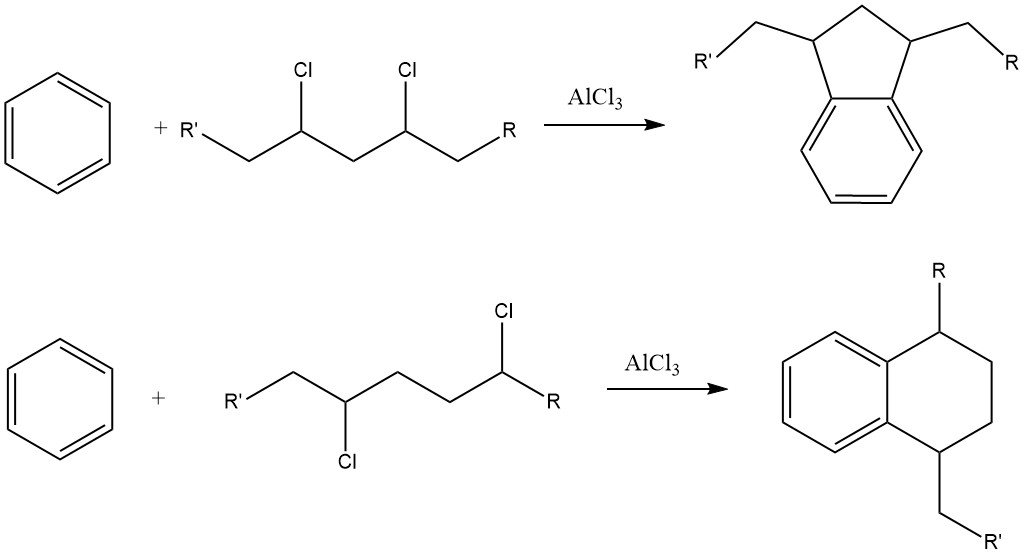
Los alquilbencenos con más de 15 átomos de carbono en la cadena lateral dan lugar a alquilbencenosulfonatos que son casi insolubles en agua pero muy solubles en medios orgánicos, como los aceites minerales.
Estas soluciones en aceite mineral encuentran uso en la industria metalúrgica como fluidos de perforación y corte o en la industria textil como fluidos de hilatura o discontinuos. Además, los alquilbencenosulfonatos de este tipo se utilizan cada vez más como agentes de inundación en procesos mejorados de recuperación de petróleo.
2.5. Alquilaciones diversas de benceno
El benceno puede sufrir alquilación con una amplia gama de compuestos, incluidas varias olefinas, haluros de alquilo, alcoholes, éteres, alquinos y dienos lineales, ramificados, cíclicos, aril-o sustituidos de otro modo.
Algunas de estas reacciones se han comercializado con éxito, como la síntesis de terc-butilbenceno a partir de benceno e isobuteno. El terc-butilbenceno encuentra aplicación en la producción de perfumes.
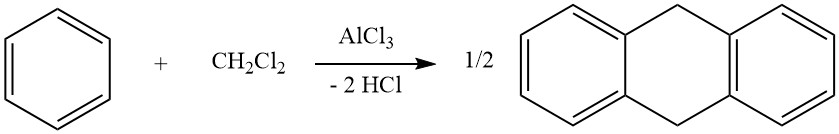
3. Cicloalquilación
Un ejemplo de cicloalquilaciones intermoleculares implica la reacción de diclorometano y benceno, lo que lleva a la formación de 9,10-dihidroantraceno junto con algo de difenilmetano. En esta reacción también se producen derivados del antraceno.
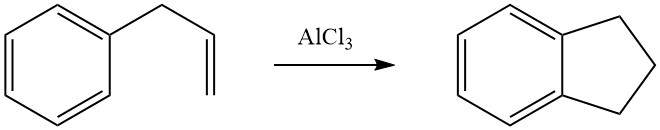
La cicloalquilación intramolecular es posible para compuestos aromáticos alquilados que llevan un doble enlace o un grupo funcional, como un halógeno o un grupo hidroxi, en su cadena lateral. Por ejemplo, el 3-fenil-1-propeno sufre isomerización en presencia de AlCl3 para formar indano.
BASF desarrolló una síntesis de antraquinona basada en la cicloalquilación. Se trata de la dimerización del estireno en fase líquida a 1-metil-3-fenilindano, utilizando ácido fosfórico como catalizador. Luego, el compuesto resultante se somete a oxidación catalítica en fase de vapor para producir antraquinona.
3.1. Arilación de compuestos aromáticos
La arilación de compuestos aromáticos se puede lograr utilizando varios métodos, incluida la reacción con haluros de arilo, la reacción con haluros de diazonio y la condensación deshidrogenante.
Los haluros de arilo, como el fluorobenceno, el clorobenceno y el bromobenceno, se pueden utilizar como agentes arilantes en las arilaciones de Friedel-Crafts. Sin embargo, su reactividad es relativamente baja, siendo el fluorobenceno el más reactivo seguido del clorobenceno y el bromobenceno.
La arilación con fluorobenceno puede producir bifenilos como productos, mientras que la descomposición de tetrafluoroboratos de arildiazonio en disolventes aromáticos puede dar lugar a productos con anillos arilados junto con fluorobenceno.
La reacción de Scholl es una condensación deshidrogenante de un compuesto aromático en presencia de catalizadores de Friedel-Crafts. Por ejemplo, la naftaleno se puede convertir en perileno y la piridina se puede convertir en 2,2′-dipiridilo mediante esta reacción. También se pueden formar compuestos aromáticos policondensados de alto peso molecular mediante la reacción de Scholl.
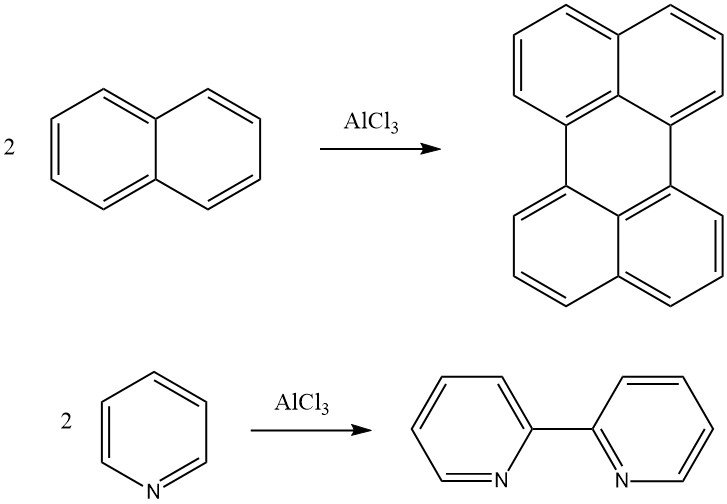
4. Alquilación de bencenos sustituidos
La alquilación del benceno normalmente conduce a una mezcla de compuestos monoalquilados, dialquilados y polisustituidos. La reactividad y orientación en el segundo paso de sustitución dependen de las propiedades electrónicas y estéricas del primer sustituyente y del tamaño del agente alquilante.
Los bencenos dialquilados tienen una importante importancia comercial. Por ejemplo, los dietilbencenos se utilizan para mejorar el octanaje de los combustibles para motores y se obtienen como subproductos en la producción de etilbenceno.
Los dialquilbencenos se pueden deshidrogenar para producir divinilbencenos, que son cruciales para reticular poliolefinas como el poliestireno en la fabricación de resinas de intercambio iónico.
El etilmetilbenceno, formado al etilar tolueno, es valioso industrialmente como material de partida para estirenos que tienen sustituciones metilo en el anillo aromático. Otro ejemplo es la producción de diisopropilbenceno mediante la reacción de propeno con cumeno (alquilación de benceno con propeno).
4.1. La alquilación de tolueno con propeno
El proceso industrial de alquilación de tolueno con propeno para producir cimeno lo llevan a cabo empresas como Sumitomo Chemicals. La mezcla de cimeno resultante consta principalmente de isómeros meta y para, que luego se somete a oxidación para producir acetona y cresoles.
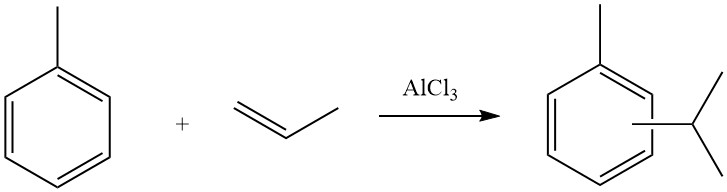
Estos cresoles comprenden aproximadamente un 39,5% de metacresoles y paracresoles y un 36% de metacresol y sirven como materias primas esenciales para resinas fenólicas y plastificantes.
Otro aspecto importante implica la producción de bencenos polimetilados mediante procesos como la desproporción de tolueno o la metilación de benceno o tolueno. Estos bencenos polimetilados pueden sufrir oxidación para formar los ácidos correspondientes, que encuentran aplicaciones en diversos polímeros como poliésteres, poliamidas y poliimidas.
4.2. Alquilación de compuestos aromáticos superiores
Se ha documentado la alquilación de compuestos aromáticos superiores, como bifenilo, indano, tetralina y compuestos aromáticos polinucleares como naftaleno, acenafteno, antraceno, fluoreno y fenantreno.
Por ejemplo, la alquilación de naftaleno con olefinas superiores se emplea comercialmente para producir agentes fluorescentes utilizados en aceites lubricantes. Esta reacción en fase líquida utiliza AlCl3 como catalizador a temperaturas de hasta 180 °C.
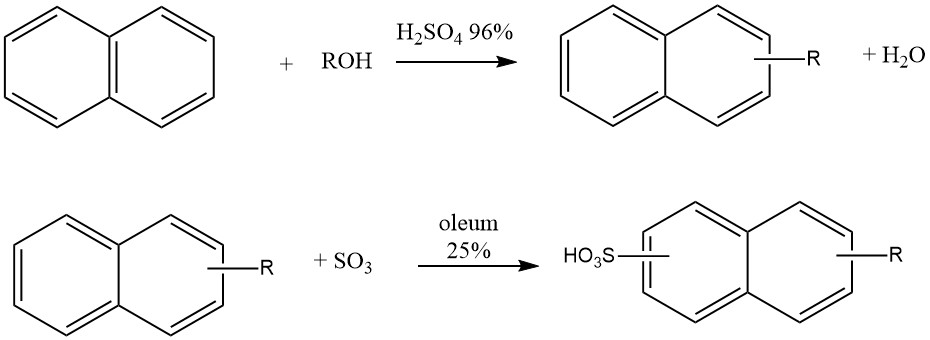
Otra aplicación industrial de la alquilación de naftaleno es la producción de detergentes tipo ‘Nekal’ (BASF), que son alquilnaftalenosulfonatos. Estos compuestos estuvieron entre los primeros detergentes sintéticos y continúan utilizándose como tensioactivos en la industria textil.
La síntesis de estos alquilnaftalenosulfonatos implica un proceso en un solo recipiente en el que el naftaleno reacciona con butanol, hexanol o mezclas de propanol-butanol en presencia de ácido sulfúrico al 96% a 50 °C. Después de la alquilación, se añade 25% de óleum para la sulfonación.
Además, el proceso de Hock implica la oxidación de 2-isopropilnaftaleno, lo que da como resultado 2-naftol. Para obtener 2-isopropilnaftaleno, se puede realizar una reacción entre naftaleno y propeno usando ZnCl2 o silicatos de aluminio como catalizadores a 150 – 200 °C, produciendo también pequeñas cantidades del isómero 1-isopropilo.
Además, los 2,6-dialquilnaftalenos han despertado un gran interés debido a su conversión en ácido 2,6-naftalenodicarboxílico, utilizado en la producción de poli(etilen-2,6-naftalendicarboxilato) plástico de alto rendimiento (polietilenaftenato, PEN).
Se han estudiado varios catalizadores de forma selectiva, incluida la mordenita, para alquilar naftalenos. Alternativamente, Amoco comercializó otra ruta en 1995 con una capacidad de aproximadamente 40.000 t/a. Alquilan o-xileno con butadieno sobre un catalizador fuertemente básico, produciendo o-tolilpenteno, que luego sufre ciclación, deshidrogenación e isomerización.
5. Alquilación de fenoles
La alquilación de fenoles es una reacción industrial de gran importancia, que da como resultado la producción de alquilfenoles ampliamente utilizados en diversas aplicaciones, como antioxidantes, herbicidas, insecticidas y polímeros.
Debido al aumento de la densidad electrónica en el anillo aromático asociado con el grupo hidroxilo nucleofílico, la alquilación se produce en condiciones más suaves en comparación con los hidrocarburos aromáticos.
Varios factores, incluidas las condiciones de reacción, los catalizadores y los agentes alquilantes, influyen en la formación de fenoles predominantemente orto o para monoalquilados, 2,4 o 2,6 dialquilados y 2,4,6 trialquilados.
Las temperaturas más altas conducen a metaisómeros termodinámicamente más estables debido a reacciones secundarias. Además, las bajas temperaturas y las concentraciones de catalizador pueden producir cantidades significativas de alquilaril éteres, mientras que las temperaturas más altas, las concentraciones de catalizador y la fuerza del ácido favorecen la formación predominante de alquilfenoles.
En el proceso de alquilación se emplean agentes alquilantes como olefinas, alcoholes y haluros de alquilo. Se han desarrollado tres tipos principales de procesos industriales para la alquilación de fenol:
- La alquilación en fase líquida implica agregar el agente alquilante a una solución o suspensión del catalizador en el fenol. Después de la reacción, el catalizador se separa y cualquier catalizador residual se descompone mediante neutralización.
- Los procesos de lecho fijo en fase líquida funcionan con los reactivos pasando sobre el catalizador en reactores tubulares a presiones elevadas, que se enfrían externamente.
- La alquilación en fase de vapor implica enviar fenol y el agente alquilante, como metanol o una olefina, a un reactor de lecho fijo que funciona a 300 – 400 °C, con eliminación eficiente del calor de reacción.
La recuperación del producto implica la destilación, con los fenoles no convertidos y los agentes alquilantes reciclados, y varios fenoles mono, di y trialquilados separados. La eliminación completa de las trazas de catalizador ácido es crucial para evitar reacciones secundarias durante la destilación, como la isomerización, la transalquilación y la desproporción.
Los procesos en fase líquida utilizan catalizadores ácidos de Lewis como AlCl3, BF3 o Al(C6H5O)3, ácidos protónicos como HF, H2SO4, H3PO4 o ácido p-tolilsulfónico, o resinas ácidas de intercambio iónico, como resinas Nafion o poliestirenos sulfonados.
Los procesos en fase de vapor requieren catalizadores con alta estabilidad térmica, como montmorillonitas, zeolitas como faujasita y óxidos metálicos como γ-Al2O3, MgO, CaO y Fe2O3 – CrO3.
La regioselectividad se puede controlar utilizando diferentes catalizadores. Por ejemplo, HF, BF3, Al2O3·SiO2 o resinas de intercambio iónico ácidas promueven predominantemente productos p-sustituidos al alquilar fenoles con olefinas.
Por otro lado, el Al(C6H5O)3, formado a partir de fenol y aluminio metálico, especialmente en presencia de trazas de sales de mercurio, conduce casi exclusivamente a productos 2-alquilados y 2,6-dialquilados. Esta selectividad para la orto alquilación se atribuye a un estado de transición de seis miembros que involucra fenolato de aluminio y una olefina.
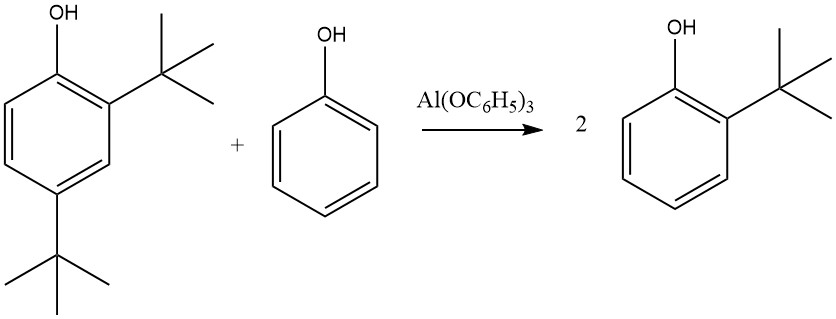
Otras sales metálicas de fenol, incluidas las de zinc, magnesio y calcio, también pueden activar esta reacción, que no se limita al fenol; El 2-naftol, el 2-cresol o el 4-cresol también pueden alquilarse con etileno, propeno, butenos, ciclohexeno u otras olefinas, con reactividad variable, donde el isobuteno muestra la reactividad más alta y el etileno la más baja.
En presencia de γ-Al2O3 como catalizador, se puede lograr una alta selectividad por o-fenoles monoalquilados. Este proceso funciona a temperaturas elevadas de 200 – 350 °C en fase líquida a presiones de 20 – 200 bar y es adecuado para funcionamiento continuo en lecho fijo.
En cuanto a los productos de alquilfenol, los alquilfenoles a menudo se producen en operaciones por lotes, lo que ofrece una mayor flexibilidad. Sin embargo, para compuestos producidos en grandes cantidades, como cresoles, 2,6-xilenol, 2-sec-butilfenol, 4-terc-butilfenol, octilfenol, nonilfenol, dodecilfenol, timol o 2,6-di-terc-butil- 4-metilfenol, se han introducido procesos continuos con capacidades de hasta 25.000 t/a cada uno.
5.1. Alquilación de fenol con metanol
La alquilación de fenol con metanol a temperaturas elevadas y con un catalizador produce principalmente 2-cresol (60 – 70% con una conversión de fenol del 50% y 300 °C) y 2,6-xilenol, acompañado de cantidades menores de 4-cresoles, 2, 4- y 2,3-xilenoles y una pequeña cantidad de 3-cresol.
La reacción se puede realizar en fase líquida o de vapor. En los procesos en fase de vapor, los reactivos se introducen a presión atmosférica o ligeramente elevada en un reactor tubular con un catalizador de lecho fijo a temperaturas que oscilan entre 300 y 450 °C.
El uso de Al2O3 activado a 300 °C y MgO y CeO2 a 540 y 450 °C, respectivamente, da como resultado una alta selectividad para el 2-cresol y el 2,6-xilenol. Sin embargo, el uso de catalizadores altamente ácidos como óxido de aluminio, silicatos de aluminio, zeolitas y fosfato de aluminio, especialmente a temperaturas más altas, conduce a la transalquilación-isomerización, lo que da como resultado una mayor producción de 3-cresol y 4-cresol.
Los procesos en fase líquida utilizan catalizadores como Al2O3, Al(OMe)3, Al(OC6H5)3 o ZnCl2 – HCl a presiones elevadas. En todos los casos, la relación xilenol:cresol aumenta con la relación metanol:fenol, la temperatura y la presión.
5.2. Alquilación de fenoles con olefinas
La alquilación de fenol con metanol se lleva a cabo a temperaturas elevadas, normalmente entre 320 y 340 °C, en presencia de 1 – 2 % de Al(C6H5O)3 y a 200 bar, lo que da como resultado la formación de 2-etilfenol.
Por otro lado, la alquilación de fenol con propeno para producir 2-isopropilfenol se puede lograr a temperaturas más bajas de 280 – 300 °C utilizando γ-Al2O3 como catalizador.
Además, la propilación de cresoles para producir timol o carvacol se lleva a cabo en procesos continuos en fase líquida utilizando γ-Al2O3, silicatos de aluminio o zeolitas. En condiciones similares, se puede producir 2-sec-butilfenol a partir de fenol y n-butenos.
La producción de 2-terc-butilfenol y 2,6-di-terc-butilfenol se puede lograr a 100 °C bajo presiones de hasta 20 bar en presencia de Al(C6H5O)3, aprovechando la alta reactividad del isobuteno.
Alternativamente, el 4-terc-butilfenol se puede preparar a presión atmosférica y temperaturas que oscilan entre 80 y 140 °C usando H2SO4, H3PO4, BF3 o, preferiblemente, resinas de intercambio catiónico ácidas.
El importante antioxidante 2,6-di-terc-butil-4-metilfenol se produce a partir de 4-cresol e isobuteno a 70 °C utilizando H2SO4 como catalizador. De manera similar, la alquilación de fenol con 2-metilbutenos a 100 – 120 °C en presencia de BF3 o H3PO4 da como resultado 4-terc-amilfenol, y con un exceso de 2-metilbutenos, se forma 2,4-di-terc-amilfenol. .
Un proceso comercial importante implica la alquilación de fenol con olefinas lineales o ramificadas que contienen entre 6 y 20 átomos de carbono, lo que da lugar a alquilfenoles que, después de etoxilar y sulfatar, encuentran una amplia aplicación como detergentes aniónicos.
Los agentes alquilantes preferidos son diisobuteno, tripropeno y tetrapropeno, y la reacción se cataliza en condiciones suaves (50 – 85 °C) utilizando BF3 en reactores tubulares o discontinuos continuos. Las resinas ácidas de intercambio catiónico, como el poliestireno sulfonado macrorreticular, también son excelentes catalizadores que facilitan la separación del catalizador.
Para lograr un mejor control de la temperatura, la reacción se puede llevar a cabo en dos etapas, empleando un catalizador de acidez reducida en la primera etapa. Chemische Werke H€uls (ahora Degussa-H€uls) en Alemania utiliza un proceso de este tipo para producir nonilfenol.
En la primera etapa de este proceso de lecho fijo, la temperatura aumenta de 80 a 120 °C, y en la segunda etapa, de 110 a 130 °C. Los silicatos de aluminio activados también pueden servir como catalizadores, pero requieren temperaturas de reacción más altas y tiempos de reacción más largos.
La producción industrial de alquilfenoles, haloalquilfenoles y compuestos relacionados es extensa, y estos compuestos se utilizan ampliamente como inhibidores de oxidación, detergentes, bactericidas, fungicidas, insecticidas y desinfectantes.
6. Alquilación de aminas aromáticas
Debido a la basicidad de las aminas aromáticas, los catalizadores ácidos no son adecuados para su alquilación. Por ejemplo, el uso del catalizador de Friedel-Crafts AlCl3 en la reacción de etileno con anilina produce predominantemente productos resinosos no identificados con sólo pequeñas cantidades de 2-etilanilina.
Sin embargo, la anilida de aluminio, Al(C6H5NH)3, formada in situ mediante el calentamiento de polvo de aluminio en anilina con desprendimiento de hidrógeno, demuestra ser un catalizador eficaz para esta reacción. En condiciones de 300 – 340 °C y 200 bar se obtiene 2,6-dietilanilina al cabo de 2 – 3 horas, mientras que tiempos de reacción más cortos conducen a la formación de 2-etilanilina.
La actividad catalítica de la anilida de aluminio se mejora aún más mediante la adición de catalizadores Friedel – Crafts como AlCl3, SnCl4, TiCl4, SiCl4, BF3 o ZnCl2. Las mezclas de metales alcalinos y AlCl3 en anilina también muestran actividad, lo que conduce selectivamente a la N-alquilación.
Esta reacción se ha extendido a varias anilinas sustituidas, incluidas 2-, 3- y 4-toluidina, 2,6-, 2,4- y 2,5-xilidina, 2-propilanilina, 2- y 3-cloroanilina, y α-naftilamina. Además, también pueden sufrir alquilación diaminas como m-fenilendiamina o 2,4-toluilendiamina, así como aminas secundarias como difenilamina.
En el proceso de alquilación con olefinas, la reactividad disminuye en el orden etileno > propeno > 1-buteno > isobuteno, lo que es opuesto al orden de reactividad observado en la alquilación de fenol con catalizador Al(OC6H5)3.
En particular, el isobuteno demuestra actividad con catalizadores de Friedel-Crafts como AlCl3, BF3 o montmorillonita incluso a 200 – 250 °C, pero con la anilida de aluminio, la reacción avanza lentamente. Cuando se utiliza montmorillonita, se produce la formación selectiva de 4-terc-butilanilina, mientras que los catalizadores BF3 o AlCl3 producen mezclas de los isómeros 2 y 4.
En la alquilación de anilinas con metanol, los tamices moleculares actúan como catalizadores, dando como resultado una mezcla compleja que contiene 2-toluidina, 2,6- y 2,4-xilidina y 2,4,6-trimetilanilina. Industrialmente, las 2,6-dialquilanilinas, como la 2-etil-6-metilanilina, se producen como intermediarios para herbicidas y colorantes.
7. Alquilación de compuestos heteroaromáticos y sustratos relacionados
Varios compuestos aromáticos heterocíclicos, incluidos furanos, tiofenos y N-heterociclos, pueden someterse a reacciones de alquilación, aunque se dispone de información limitada sobre sus aplicaciones comerciales.
Los derivados de ciclopentadienilo también se someten a alquilación de Friedel-Crafts de manera similar a otros compuestos aromáticos.
7.1. furano
El furano exhibe una mayor reactividad en las alquilaciones de Friedel – Crafts en comparación con el benceno. Sin embargo, los furanos tienden a sufrir una rápida resinificación en presencia de ácidos, lo que puede complicar la separación del producto.
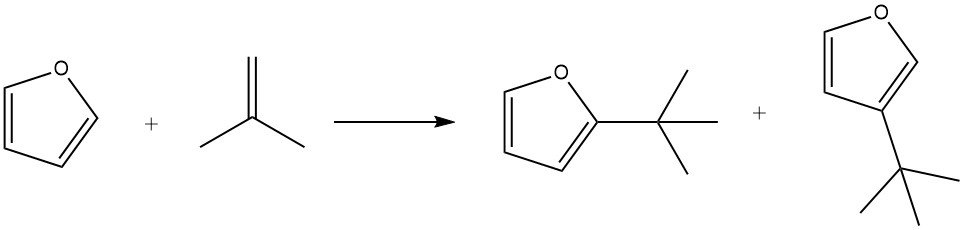
Al utilizar ácido fosfórico sobre kieselguhr como catalizador, el furano se puede alquilar eficientemente con isobuteno a 100 °C en 3 horas, lo que da como resultado un rendimiento del 85 % de los alquilatos, junto con cantidades menores de isoocteno.
En condiciones suaves (por ejemplo, 50 °C durante 1 hora), se prefiere la sustitución en la posición 2. Sin embargo, tiempos de reacción más largos (7 horas), temperaturas más altas (150 °C) y mayores concentraciones de catalizador promueven la formación de productos sustituidos en la posición 3. Además, durante el proceso también se ha observado la formación de 2,5-di-terc-butilfurano.
7.2. tiofeno
El tiofeno exhibe una reactividad significativamente mayor en las reacciones de Friedel-Crafts en comparación con los hidrocarburos aromáticos, lo que permite su alquilación con varias olefinas, incluidos propeno, 1-buteno, 2-metilbutenos, ciclohexeno y alcoholes como el alcohol isopropílico y el alcohol terc-butílico.
Se han obtenido resultados exitosos utilizando catalizadores ácidos como el ácido fosfórico a 60 °C o alúmina sílice a 200 °C. Sin embargo, el uso de H2SO4, HF, BF3·OMe2 y AlCl3 provocó reacciones secundarias. En todos los casos, se sustituyó el tiofeno en la posición 2 y también se produjeron productos de punto de ebullición más elevado, como compuestos dialquilados.
Además, la eliminación del tiofeno de la gasolina craqueada durante el refinado con ácido sulfúrico concentrado en frío es probablemente una reacción de alquilación. Las olefinas presentes en la gasolina actúan como agentes alquilantes, dando lugar a la formación de alquiltiofenos de alto punto de ebullición, que quedan como residuo tras la destilación.
7.3. N-heterociclos
Los N-heterociclos pueden sufrir alquilación en presencia de amidas de aluminio como catalizadores. Mientras que los compuestos heterocíclicos como el carbazol y el indol reaccionan lentamente con el aluminio metálico para formar la amida, la anilida de aluminio sirve como un catalizador eficaz.
Por ejemplo, cuando el carbazol reacciona con etileno en presencia de anilina y aluminio en polvo, produce 1-etilcarbazol. Esta reacción se produce en un autoclave a 280 °C y 200 bar.
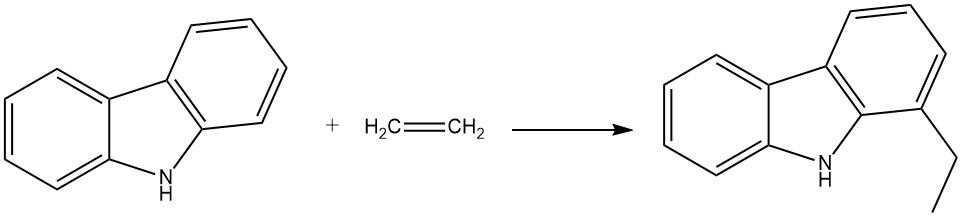
El propeno también puede reaccionar en condiciones similares para producir 1-isopropilcarbazol, aunque con un rendimiento ligeramente menor.
La combinación de carbazol y propeno con AlCl3 como catalizador a 90 – 100 °C da como resultado la formación de diisopropilcarbazol. Otra reacción sobre un catalizador de silicato de aluminio a 180 – 200 °C da tetra y pentaisopropilcarbazol. Además, la etilación del pirrol se puede lograr utilizando un catalizador de silicato de aluminio a 200 – 370 °C.
7.4. Compuestos aromáticos no bencenoideos
Los compuestos aromáticos no bencenoideos, como ferrocenos, fulvenes, azulenos, pseudoazulenos, indolicinas y ciclacinas, comparten similitudes químicas no sólo con los sistemas bencenoideos sino también con las olefinas.
Sus reacciones de sustitución electrófila suelen ocurrir en condiciones más suaves en comparación con los derivados del benceno. Sin embargo, debido a su estabilidad relativamente baja, es esencial una selección cuidadosa de los catalizadores y las condiciones de reacción.
El ferroceno puede sufrir alquilación en presencia de ácidos de Lewis, como AlCl3, con varios sustratos que incluyen haluros de metanol, etilo, isopropilo, butilo y bencilo, 1,2-dicloroetano, etileno, propeno e isobuteno.
La reacción a menudo conduce a mezclas complejas de productos homoanulares y heteroanulares (donde ambos anillos están alquilados), ya que el sistema se vuelve más reactivo después del primer paso de alquilación.
La alquilación del ferroceno con olefinas parece ser más favorable, al igual que la reacción con isobuteno, que se produce incluso a temperatura ambiente. A temperaturas más altas (100 – 150 °C), se obtiene tri-terc-butilferroceno heteroanular con un rendimiento del 44%, junto con algo de tetra-terc-butilferroceno. El impedimento estérico impide la unión de más de dos sustituyentes terc-butilo al mismo anillo ciclopentadienilo.
8. Reacciones diversas de alquilación
La alquilación de compuestos aromáticos utilizando reactivos bi o polifuncionales da como resultado la formación de una amplia gama de valiosos productos mono, di o polinucleares con importantes aplicaciones comerciales.
8.1. Haloalquilaciones
En condiciones de reacción adecuadas, las haloalquilaciones de compuestos aromáticos con agentes alquilantes bi o polifuncionales pueden producir productos de haloalquilación primaria evitando al mismo tiempo la cicloalquilación o unión no deseada de múltiples núcleos.
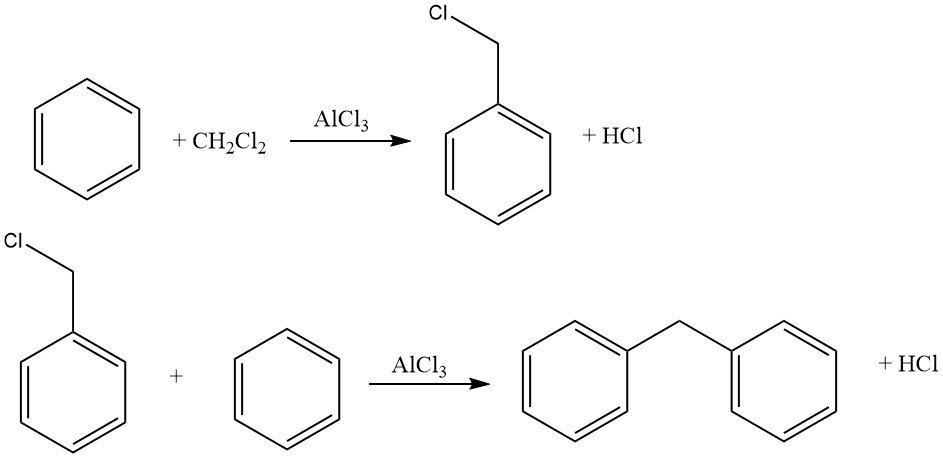
Los agentes haloalquilantes comunes incluyen aldehído-haluro de hidrógeno, éteres haloalquilo, haloalcoholes y compuestos similares. Este proceso permite la halometilación, la haloetilación, la haloalquilación superior, así como la bis y polialquilación.
La reacción suele ser catalizada por cloruro de zinc, pero otros catalizadores como haluros ácidos (p. ej., ZnCl2 – AlCl3, SnCl4, AlCl3–cetonas, AlCl3 – piridina) o ácidos protónicos (HCl, H2SO4, H3PO4, ácido p-toluenosulfónico) también pueden ser catalizados por cloruro de zinc. ser usado.
Un ejemplo común de esta reacción es la clorometilación utilizando formaldehído-HCl (reacción de Blanc). Si bien esta reacción es valiosa desde el punto de vista sintético, se debe tener precaución debido a la formación de intermediarios reactivos, en particular éteres clorometílicos, que son altamente cancerígenos.
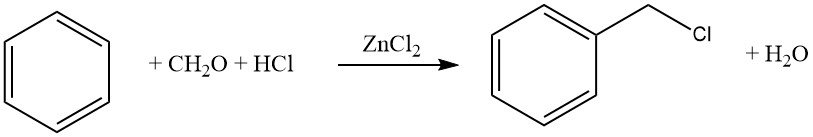
8.2. Hidroxialquilación
La hidroxialquilación de compuestos aromáticos utilizando aldehídos y cetonas en presencia de ácidos tiene una gran importancia industrial. Los electrófilos que atacan al núcleo aromático se forman por la reacción de aldehídos o cetonas con ácidos de Lewis o protónicos (donde R, R0 = H, alquilo, arilo).
La reacción da como resultado la formación de un alcohol bencílico sustituido. En condiciones ácidas, este alcohol reacciona con otra molécula del compuesto aromático para producir un diarilmetano sustituido.
Un ejemplo notable de esta reacción es la hidroxialquilación de fenol con acetona, produciendo 2,2-bis-(4-hidroxifenil)propano, comúnmente conocido como bisfenol A. Este compuesto se produce industrialmente en procesos continuos utilizando H2SO4 (o HCl seco en el Proceso Hooker) como catalizador y metilmercaptano como promotor, lo que da como resultado rendimientos casi cuantitativos a 50 °C.
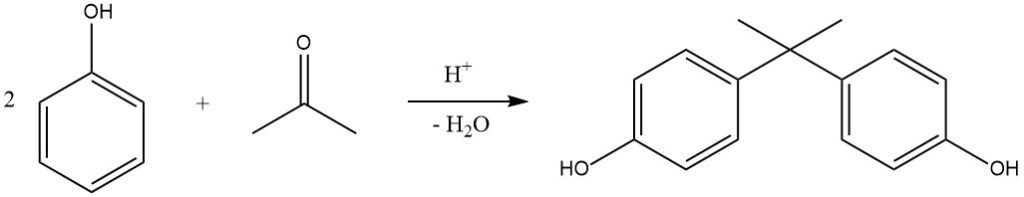
Las resinas de intercambio catiónico también se utilizan cada vez más como catalizadores debido a su proceso de separación simplificado. El bisfenol A se utiliza principalmente para la producción de resinas epoxi y policarbonato.
Las hidroxialquilaciones son muy versátiles y permiten que numerosos aldehídos y cetonas sustituidos con alquilo y arilo reaccionen con diversos compuestos aromáticos. Por ejemplo, el insecticida DDT se produce a partir de cloral y clorobenceno. La reacción del fenol con formaldehído conduce a hidroximetilfenoles, que pueden condensarse aún más para formar resinas fenólicas a temperaturas elevadas.
Cuando se utilizan oxiranos (epóxidos) como agentes alquilantes, se obtienen compuestos aromáticos β-hidroxialquilo. Por ejemplo, la reacción del benceno con óxido de etileno en presencia de una cantidad estequiométrica de AlCl3 conduce a un alcóxido de aluminio que, tras la hidrólisis, produce β-feniletanol.
8.3. Amidometilación
La amidometilación, también conocida como reacción de Tscherniac-Einhorn, es un proceso en el que las N-hidroximetilamidas o las imidas correspondientes reaccionan con compuestos aromáticos en condiciones suaves en presencia de ácido sulfúrico. Esta reacción permite la introducción de un grupo amidometilo en el núcleo aromático.
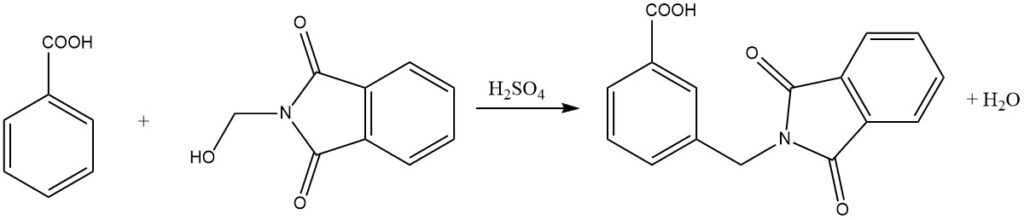
Además, los compuestos aromáticos menos reactivos, como los ácidos benzoicos, también pueden sufrir amidoalquilación mediante este proceso. Sorprendentemente, incluso los compuestos aromáticos nitrosustituidos pueden alquilarse utilizando amidas del ácido N-clorometilcarboxílico en presencia de AlCl3 como catalizador.
Referencia
- Acylation and Alkylation; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a01_185
Preguntas más frecuentes
La alquilación de Friedel-Crafts es una reacción química que se utiliza para introducir grupos alquilo (como metilo, etilo, etc.) en un anillo aromático. Implica la sustitución de un átomo de hidrógeno en el anillo aromático por un grupo alquilo, lo que da como resultado la formación de compuestos alquilaromáticos.
La alquilación de Friedel-Crafts tiene diversas aplicaciones industriales. Los compuestos alquilaromáticos producidos mediante esta reacción se utilizan como materiales de partida en la síntesis de tintes, productos farmacéuticos, fragancias y agroquímicos. Además, sirven como intermediarios en la producción de polímeros y otros compuestos orgánicos.
Además del benceno, otros compuestos aromáticos como naftaleno, tolueno, fenol, anilina y diversos compuestos aromáticos heterocíclicos como furanos y tiofenos pueden sufrir reacciones de alquilación. Las condiciones y reactivos específicos pueden variar dependiendo de la naturaleza del compuesto aromático y de la sustitución alquílica deseada.
Sí, la alquilación de Friedel-Crafts tiene algunas limitaciones y desafíos. Una limitación importante es la posibilidad de sobrealquilación, que puede conducir a productos polialquilados. El impedimento estérico en ciertos compuestos aromáticos también puede dificultar la reacción. Además, algunos agentes alquilantes y catalizadores ácidos de Lewis pueden ser sensibles a la humedad y al aire, lo que requiere una manipulación y condiciones de reacción cuidadosas.
Si bien la alquilación de Friedel-Crafts es una herramienta útil para la introducción de grupos alquilo en anillos aromáticos, puede que no siempre sea adecuada para la síntesis de moléculas altamente complejas debido al potencial de múltiples productos de sustitución. En tales casos, pueden ser necesarios métodos más selectivos o controlados para lograr la síntesis deseada.
