Ácido L-ascórbico: propiedades, reacciones, producción y usos
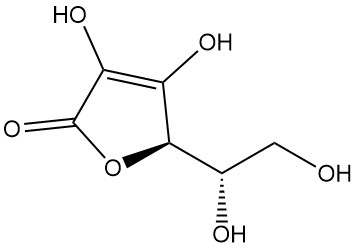
¿Qué es el ácido L-ascórbico?
El ácido L-ascórbico, también conocido como (2R)-2-[(1S)-1,2-dihidroxietil]-3,4-dihidroxi-2H-furan-5-ona, es la designación de la IUPAC para la vitamina C. Es un polvo o cristal blanco o inodoro con un sabor ácido que se encuentra en la naturaleza y tiene actividad antiescorbútica, lo que significa que previene el escorbuto, una enfermedad causada por la deficiencia de vitamina C.
El ácido L-ascórbico se aisló por primera vez en 1928 y su estructura se determinó cinco años después. Hoy en día, el ácido L-ascórbico es la vitamina más producida a nivel mundial, con una producción anual estimada de alrededor de 150.000 toneladas.
Una característica clave del ácido L-ascórbico es su oxidación reversible a ácido deshidro-L-ascórbico. Este sistema redox permite que el ácido L-ascórbico actúe como un agente reductor.
Entre los cuatro diastereómeros del ácido ascórbico, solo el ácido D-araboascórbico (también conocido como ácido isoascórbico, ácido eritórbico y ácido D-eritro-hex-2-enoico γ-lactona) muestra una actividad antiescorbútica débil (aproximadamente el 5% de la del ácido L-ascórbico).
Tabla de contenido
1. Propiedades físicas del ácido L-ascórbico
El ácido L-ascórbico es un polvo cristalino de color blanco a amarillo muy pálido que es altamente soluble en agua (1 g en 3 ml), moderadamente soluble en etanol, propilenglicol y glicerol, e insoluble en éter, cloroformo, benceno, éter de petróleo, aceites, grasas y disolventes grasos.
En la siguiente tabla se ofrece un resumen de las propiedades físicas del ácido L-ascórbico.
| Propiedad | Valor |
|---|---|
| Número CAS | [50-81-7] |
| Fórmula | C6H8O6 |
| Peso molecular | 176,13 g/mol |
| Punto de fusión | 190–192 °C (descomposición) |
| Densidad | 1,65 g/cm3 |
| Rotación óptica | [α]20H2O: +20,5° a +21° (c = 1) |
| [α]20EtOH: +52° (c = 0,5) | |
| [α]20MeOH: +49,5° (c = 0,5) | |
| pH | 3 (5 g/L) 2 (50 g/L) |
| pK1 | 4,17 (3-OH) |
| pK2 | 11,57 (2-OH) |
| Potencial redox | E = +0,127 V (pH=5) |
2. Propiedades químicas del ácido L-ascórbico
El ácido L-ascórbico existe en al menos cinco formas tautoméricas. La forma más frecuente, el tautómero (1), representa la estructura cristalina y predomina en soluciones acuosas ácidas (pH = 2). Tanto los grupos 2-OH como 3-OH son ácidos y forman sales monobásicas con bases; sin embargo, las sales dibásicas son inestables.
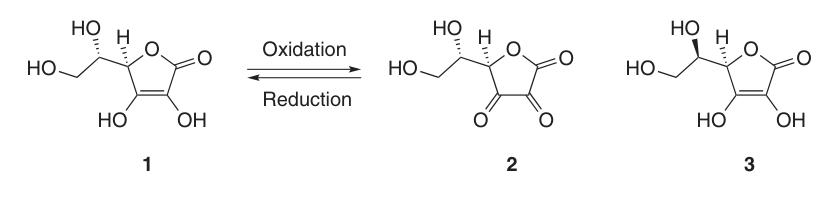
En el ascorbato de sodio y calcio, el ion metálico interactúa con el átomo de oxígeno en la posición 3 (4a). La carga negativa del monoanión ascorbato está deslocalizada dentro del sistema de electrones π, lo que contribuye a la estabilidad de su anillo de lactona en ambientes alcalinos.
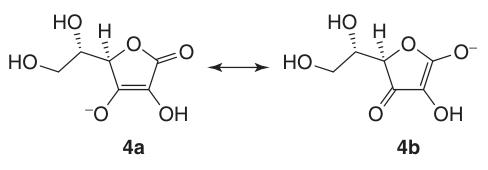
El ácido L-ascórbico se isomeriza fácilmente para dar ácido L-isoascórbico al hervirlo en hidróxido de potasio metanólico.
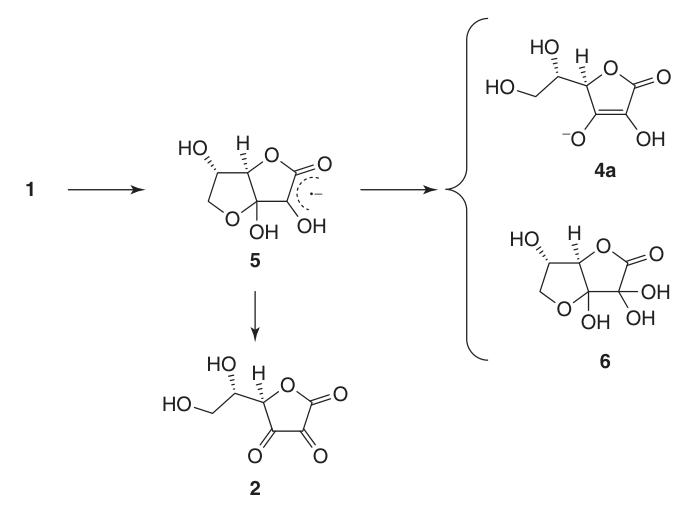
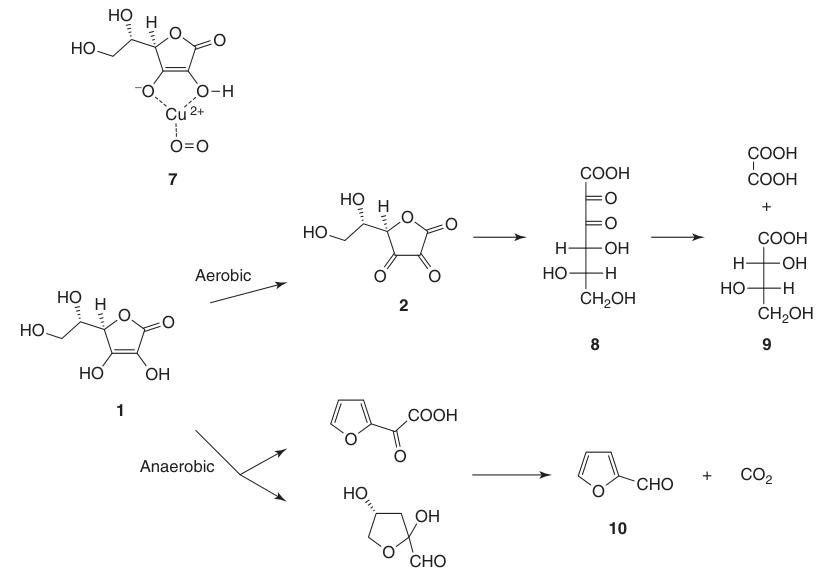
Debido a su estructura endodiol, el ácido L-ascórbico actúa como un potente agente reductor. La oxidación del ácido ascórbico (1) produce ácido deshidroascórbico (2), pasando por el intermedio anión radical, ácido semideshidroascórbico (5).
El ácido semideshidroascórbico es un ácido fuerte (pKa = 0,45) y un eliminador de radicales que puede reaccionar consigo mismo para regenerar ácido ascórbico y el compuesto (6) o reaccionar con otros radicales libres.
Los metales de transición como el Cu y el Fe catalizan la autooxidación del ácido ascórbico para formar ácido deshidroascórbico (2). Estos metales forman un complejo intermedio ternario con el oxígeno, que se disocia para producir ácido deshidroascórbico (2), peróxido de hidrógeno y el ion metálico.
El proceso de autooxidación se acelera por encima del pH 7 y se puede inhibir mediante la formación de complejos de iones metálicos con agentes quelantes como el EDTA, el ácido metafosfórico, el ácido cítrico o el ácido oxálico.
El tratamiento del ácido ascórbico con oxígeno en metanol que contiene carbón activado forma un aducto de metanol almibarado que, tras un procesamiento posterior, proporciona ácido deshidroascórbico (2) como un dímero cristalino con un rendimiento del 64 %.
A un pH de 2,5 a 5,5 en una solución acuosa y a 4 °C, el compuesto (2) es estable durante varios días; sin embargo, los agentes reductores como el sulfuro de hidrógeno, el ditiotreitol o la cisteína pueden convertirlo cuantitativamente de nuevo en ácido ascórbico.
Si bien el ácido deshidroascórbico (2) conserva la actividad de la vitamina C, la apertura irreversible del anillo de lactona para formar ácido 2,3-dicetogulónico (8) conduce a la pérdida completa de esta actividad.
El ácido L-ascórbico sufre degradación en soluciones acuosas tanto en condiciones aeróbicas como anaeróbicas. La velocidad de descomposición depende de factores como el pH, la temperatura, la luz, la concentración y la presencia de catalizadores de metales pesados.
La presencia de oxígeno acelera significativamente el proceso de degradación en comparación con las condiciones anaeróbicas. Los productos finales de la oxidación incluyen ácido L-treónico (9) y ácido oxálico. En condiciones anaeróbicas, la degradación conduce al furfural (10) y CO2.
El ácido L-ascórbico sólido es muy estable durante mucho tiempo en ausencia de humedad y luz.
La protección contra la degradación oxidativa en aplicaciones acuosas se puede lograr mediante el recubrimiento con grasas y polímeros o mediante la sustitución química de los grupos hidroxilo del enodiol (L-ascorbato 2-sulfato, L-ascorbato 2-fosfato y ácido 2-O-metil ascórbico).
3. Fuentes naturales de vitamina C
El ácido ascórbico (vitamina C) es un compuesto ampliamente distribuido que se encuentra en plantas y algunos animales. Es particularmente abundante en plantas verdes, con las concentraciones más altas observadas en frutas tropicales y hojas de gladiolo. Su presencia en levaduras y procariotas no cianobacterianos sigue siendo poco clara.
Históricamente, durante los meses de invierno, la ingesta de vitamina C dependía en gran medida de vegetales de raíz como papas y repollo. Hoy, con acceso durante todo el año a frutas y vegetales frescos, las fuentes dietéticas de vitamina C son más diversas. Sin embargo, los procesos de almacenamiento y cocción pueden contribuir a la degradación de la vitamina C.
La distribución de la vitamina C dentro de los tejidos vegetales varía. Cabe destacar que algunas plantas, como las especies de Brassica y Elaeocarpus spp., almacenan vitamina C en formas ligadas, conocidas como ascorbigen y elaeocarpusina, respectivamente.
La vitamina C también se encuentra en animales, pero en concentraciones más bajas en comparación con las plantas. Los niveles más altos se encuentran en los órganos endocrinos de mamíferos como las vacas (hipófisis y glándulas suprarrenales).
Ciertas especies animales, incluidos los humanos, los primates, los conejillos de indias, los mamíferos voladores, algunas aves, los peces y los insectos, carecen de la capacidad de sintetizar vitamina C y dependen de la ingesta dietética.
| Grupo de alimentos | Vitamina C (mg/100 g) |
|---|---|
| Pescado | 0–4 |
| Espárragos | 7–25 |
| Carne (ternera, cerdo) | 0–10 |
| Frijoles | 5–30 |
| Leche (vaca) | 1–2 |
| Brócoli | 20–100 |
| Frutas (manzanas, cerezas, kiwis, naranjas) | 4–180 |
| Verduras (brócoli, coles de Bruselas, coliflor, espinacas, nabos) | 20–90 |
| Verduras de raíz (zanahorias, patatas) | 2–20 |
| Granos (avena, centeno, trigo) | <1 |
| Arroz | 0 |
4. Producción industrial de ácido L-ascórbico
La primera síntesis exitosa de ácido L-ascórbico ocurrió incluso antes de que se determinara su estructura química completa. En este proceso, la L-xilosona (11) se hizo reaccionar con cianuro de potasio para formar l-xilonitrilo (12), que, después de la lactonización y enolización, produjo ácido L-ascórbico en aproximadamente un 40%.
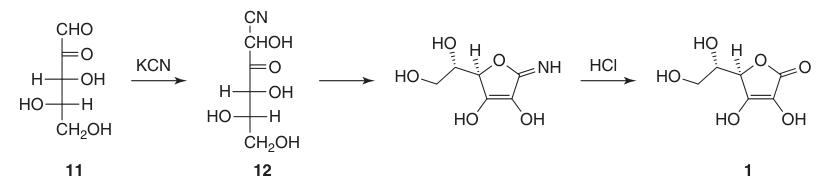
Sin embargo, una desventaja importante de esta síntesis inicial fue la dificultad y el costo asociados con la obtención de L-xilosona (11).
Afortunadamente, aproximadamente un año después, Reichstein y Grüssner publicaron un método más práctico para sintetizar ácido L-ascórbico que utiliza D-glucosa (13) (un azúcar C6) fácilmente disponible como material de partida, y se convirtió en la ruta de producción comercial dominante durante más de 60 años, con pequeñas mejoras a lo largo del camino.
Desde la década de 1980, el proceso de fabricación ha experimentado un cambio significativo. El sorbitol se ha convertido en el material de partida preferido, y se utiliza una oxidación fermentativa de dos pasos para producir ácido 2-cetogulónico.
Si bien la hidrogenación de la glucosa sigue siendo un método para la producción de sorbitol, no siempre lo realiza el fabricante final de ácido ascórbico.
A pesar del cambio hacia la fermentación, el concepto general detrás del proceso moderno conserva su conexión con la síntesis original de Reichstein. La diferencia clave radica en el uso de oxidación microbiana en lugar de métodos químicos.
4.1. Producción de ácido L-ascórbico mediante síntesis de Reichstein
La síntesis de Reichstein de ácido L-ascórbico es una serie de reacciones químicas simples y de alto rendimiento que evitan la formación o escisión de enlaces carbono-carbono.
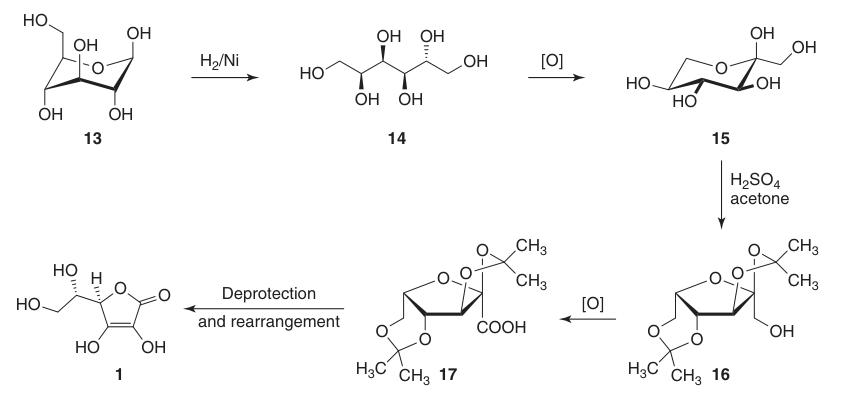
Reduce la posición C-1 de la D-glucosa (13) y oxida las posiciones 5 y 6, manteniendo al mismo tiempo la quiralidad en C-2 y C-3. Esto conduce finalmente a la configuración L-treo deseada en C-4 y C-5 en el producto final.
La síntesis clásica de Reichstein-Grussner comienza reduciendo la D-glucosa (13) a D-sorbitol (14) mediante hidrogenación sobre un catalizador de níquel. La bacteria Acetobacter xylinum oxida microbiológicamente el D-sorbitol a L-sorbosa (15).
La L-sorbosa (15) se trata con acetona y ácido sulfúrico a bajas temperaturas para formar el intermedio protegido 2,3:4,6-di-O-isopropilideno-α-L-sorbofuranosa (16).
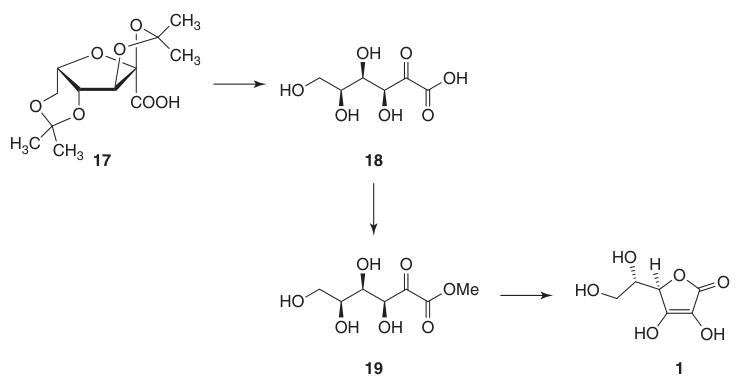
Esta protección de los grupos hidroxilo en C-2, C-3, C-4 y C-6 permite una oxidación de alto rendimiento a ácido di-O-isopropilideno-2-cetogulónico utilizando permanganato de potasio en una solución alcalina. La desprotección con agua caliente produce ácido 2-ceto-L-gulónico (18).
El ácido L-ascórbico se produce calentando el ácido 2-ceto-L-gulónico (18) en agua a 100 °C para obtener un rendimiento del 20 % o mediante esterificación seguida de acidificación para obtener un rendimiento del 70 %.
El rendimiento total de ácido L-ascórbico a partir de D-glucosa (13) utilizando este método es de alrededor del 15-18 %.
4.2. Fabricación industrial por la ruta de Reichstein
La transformación del proceso clásico de Reichstein en un método comercialmente viable implicó una optimización significativa de cada paso de la reacción. Estos avances abarcaron modificaciones tanto técnicas como químicas y dieron como resultado rendimientos de cada paso individual superiores al 90 %, lo que llevó a un rendimiento total de ácido L-ascórbico a partir de D-glucosa (13) de aproximadamente el 60 %.
Los pasos clave y las optimizaciones son:
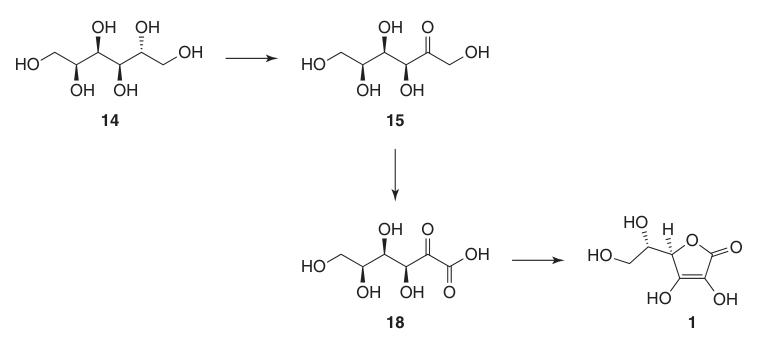
1. D-sorbitol (14)
La hidrogenación a alta presión de D-glucosa (13) con un catalizador de níquel Raney a temperaturas elevadas logra rendimientos casi cuantitativos de D-sorbitol (14) con una formación mínima de subproductos como D-manitol y L-iditol.
La solución de sorbitol se utiliza directamente en la fermentación sin purificación adicional, por lo que se necesita glucosa de partida de alta calidad.
2. L-sorbosa (15)
La oxidación microbiana de soluciones estériles de D-sorbitol (14) utilizando cepas como Gluconobacter oxydans produce eficientemente L-sorbosa (15) con una conversión superior al 90 %.
Las fermentaciones a gran escala requieren un control estricto del pH (4-6), la temperatura (30-35 °C) y las condiciones estériles para minimizar la pérdida de producto durante la oxidación y el procesamiento por filtración y cristalización.
3. 2,3:4,6-Di-O-isopropilideno-α-L-sorbofuranosa (16)
La protección de los grupos 2,3 y 4,6-hidroxilo en la L-sorbosa (15) se logra mediante la formación de cetales cíclicos con acetona y exceso de ácido sulfúrico como catalizadores o agentes deshidratantes a bajas temperaturas (p. ej., 4 °C).
El producto principal es 2,3:4,6-di-O-isopropilideno-α-L-sorbofuranosa (16), con derivados de monoisopropilideno como subproductos recuperables.
4. Ácido 2,3:4,6-di-O-isopropilideno-2-ceto-L-gulónico (17)
Originalmente, la oxidación de 2,3:4,6-di-O-isopropilideno-α-L-sorbofuranosa (16) a ácido 2,3:4,6-di-O-isopropilideno-2-ceto-L-gulónico (17) utilizaba KMnO4 a temperaturas elevadas en hidróxido de sodio diluido para producir alrededor del 90 % del producto.
Se han desarrollado alternativas más rentables para procesos continuos, como la oxidación de hipoclorito con cloruro/sulfato de níquel catalítico a 60 °C, que proporciona un rendimiento superior al 93 %, y la oxidación electroquímica utilizando electrodos de níquel/óxido de níquel en solución alcalina.
La oxidación con catalizadores metálicos (paladio o platino sobre carbono) con aire u oxígeno en una solución alcalina es otro método que ofrece buenos rendimientos.
5. Ácido L-ascórbico (1)
La conversión del ácido 2,3:4,6-di-O-isopropilideno-2-ceto-L-gulónico (17) en ácido L-ascórbico se puede lograr a través de dos métodos:
- Desprotección a ácido 2-ceto-L-gulónico (18), seguida de esterificación con metanol y ciclización catalizada por una base.
- Ciclización catalizada por un ácido directo del ácido ascórbico a partir del ácido 2-ceto-L-gulónico protegido o desprotegido (18).
El método catalizado por una base utiliza 2-ceto-L-gulonato de metilo (19), preparado a partir del ácido 2-ceto-L-gulónico (18) mediante la reacción con metanol en presencia de un ácido. Las reacciones posteriores con bases como el hidrogenocarbonato de sodio producen ascorbato de sodio con un alto rendimiento.
La primera ruta catalizada por ácido para obtener ácido ascórbico surgió poco después del descubrimiento del proceso de Reichstein.
4.3. Producción moderna de ácido ascórbico: sustitución de la oxidación química por la fermentación
La conversión directa de L-sorbosa (15) en ácido 2-ceto-L-gulónico (18) (2-KGA), un intermediario crucial en la síntesis de vitamina C, ha sido un objetivo importante para la mejora. Si bien la oxidación química con catalizadores de platino o de oro-platino logró cierto éxito, la fermentación demostró ser un enfoque más escalable y eficiente.
Los primeros intentos exploraron el uso de Gluconobacter para la oxidación fermentativa. Sin embargo, un gran avance se produjo en la década de 1980 con el descubrimiento de Ketogulonicigenium vulgare por parte de la Academia China de Ciencias.
Este microorganismo ofrecía el potencial de reemplazar por completo los pasos de oxidación química en el proceso de Reichstein. Hoy en día, prácticamente toda la producción mundial de vitamina C depende de la fermentación de 2-KGA (18) a partir de L-sorbosa (15) por Ketogulonicigenium vulgare.
Los pasos iniciales de conversión de D-glucosa a L-sorbosa (15) permanecen prácticamente sin cambios desde el método de Reichstein desarrollado en la década de 1930. La conversión posterior de L-sorbosa en ácido L-ascórbico utiliza actualmente un proceso de fermentación de dos pasos que domina en todo el mundo:
- El D-sorbitol (14) obtenido comercialmente se fermenta con Gluconobacter oxydans para producir L-sorbosa (15).
- El caldo de L-sorbosa (15) esterilizado sufre una oxidación adicional a 2-KGA (18) mediante una fermentación mixta que involucra Ketogulonicigenium vulgare y Bacillus megaterium. Bacillus megaterium desempeña un papel de apoyo, permitiendo que Ketogulonicigenium, que tiene requisitos nutricionales limitados, prospere en un medio simple y económico.
Este proceso de fermentación de dos pasos logra una oxidación rápida y eficiente de L-sorbosa (15) a 2-KGA (18), con títulos informados que superan los 100 g/L y rendimientos de alrededor del 90% de L-sorbosa en 40 horas.
Los avances recientes han eliminado la necesidad de esterilización intermedia de L-sorbosa en algunos procesos.
Se ha explorado la combinación de ambos pasos de fermentación en un solo tanque. Gluconobacter primero oxida D-sorbitol (14) a L-sorbosa (15), seguido por el crecimiento de Ketogulonicigenium y la oxidación de L-sorbosa a 2-KGA (18).
Este enfoque requiere una sincronización cuidadosa para evitar la oxidación no deseada de C-1 del D-sorbitol por la enzima de Ketogulonicigenium. A pesar de los resultados prometedores con títulos de 2-KGA (18) de 140 g/L y altos rendimientos de conversión, la viabilidad comercial de este proceso de un solo tanque sigue sin estar clara.
El cambio de la oxidación química a la fermentación ha revolucionado la producción de vitamina C, ofreciendo un proceso más eficiente, escalable y potencialmente más simple.
4.4. Otros métodos para la producción de ácido ascórbico
Todos los procesos de producción de ácido l-ascórbico son síntesis parciales en las que la quiralidad en C-4 y C-5 se deriva de azúcares naturales, principalmente D-glucosa. La conversión de D-glucosa a ácido L-ascórbico se logra manipulando la estereoquímica en C-4 y C-5 utilizando inversión de la cadena de carbono o inversión de la configuración C-5.
Históricamente, el proceso Reichstein dominó la producción industrial de ácido L-ascórbico. Desde entonces, este método químico y de fermentación de múltiples pasos ha sido reemplazado en gran medida por el proceso de fermentación 2-KGA (18), más eficiente.
Si bien se han explorado numerosos métodos alternativos, ninguno ha superado la importancia económica del proceso de fermentación 2-KGA (18). Estas alternativas incluyen:
- Fermentación alternativa de 2-KGA (18) utilizando microorganismos como Pseudomonas y cepas de Gluconobacter modificadas genéticamente.
- Producción de ácido L-ascórbico mediante pasos de oxidación y reducción del ácido D-glucónico.
- Fermentación directa de ácido L-ascórbico utilizando l-sorbosona deshidrogenasa o levaduras/microalgas modificadas genéticamente.
- Exploración de opciones más económicas como la pectina a partir de corrientes de desechos de procesamiento de frutas o almidón.
- Conversiones químicas a intermediarios de ácido L-ascórbico, como almidón a L-gulono-1,4-lactona, para una posible combinación con biocatálisis.
El foco de los avances futuros se encuentra en los procesos fermentativos y biocatalíticos para una producción más simple y eficiente de ácido L-ascórbico. Las áreas prometedoras incluyen:
- Conversión biocatalítica directa con enzimas que convierten 2-KGA (18) o L-sorbosona directamente en ácido L-ascórbico.
- Microorganismos modificados genéticamente, como levaduras de ingeniería o microalgas.
- Las materias primas alternativas utilizan materias primas más baratas y abundantes, como almidón o residuos de pectina.
A pesar del predominio del proceso de fermentación 2-KGA (18), la investigación continua se esfuerza por desarrollar métodos más sostenibles, rentables y optimizados para la producción industrial de ácido L-ascórbico.
4.5. Vitamina C de fuentes naturales
Si bien la vitamina C sintética domina el mercado debido a su asequibilidad y producción a gran escala, desde 2010 se encuentra disponible la vitamina C natural de las frutas de acerola y rosa roxburghii, aunque a un precio más alto y con una menor capacidad de producción.
Estas frutas contienen naturalmente niveles excepcionalmente altos de vitamina C, alrededor de 2 a 3 g por cada 100 g de pulpa.
Los procesos de extracción dan como resultado productos con un contenido de vitamina C que varía entre el 10 y el 25 %, según los excipientes añadidos. La vitamina C natural se comercializa principalmente para aplicaciones de nutrición humana y cuidado personal.
5. Aplicaciones industriales del ácido L-ascórbico
5.1. Usos del ácido L-ascórbico en productos farmacéuticos y alimentos
Aproximadamente un tercio de la producción total se utiliza para suplementos vitamínicos en la industria farmacéutica. La porción restante sirve principalmente como aditivo para alimentos y piensos para mejorar la calidad y la estabilidad del producto.
El ácido L-ascórbico es un componente común en diversas formulaciones farmacéuticas, incluidas multivitaminas, comprimidos, jarabes, elixires y comprimidos efervescentes. Las formas farmacéuticas sólidas son muy estables, mientras que las formulaciones líquidas son susceptibles a la degradación y la interacción con otros ingredientes.
La industria alimentaria representa el sector de aplicación más grande, en particular en el procesamiento de carne, frutas y harina. El ácido L-ascórbico funciona como antioxidante y vitamina esencial, contribuyendo a:
- Inhibición de la formación de nitrosaminas en carnes curadas.
- Prevención del pardeamiento enzimático en frutas y verduras procesadas.
- Restauración y fortificación del valor nutricional de alimentos y bebidas.
- Mejora de la calidad de la harina y la masa.
- Retraso de la rancidez oxidativa en grasas y aceites.
- Mejora de la claridad en el vino y la cerveza.
- Efectos sinérgicos cuando se combina con otros antioxidantes (p. ej., tocoferoles).
El ácido L-ascórbico, sus sales y el palmitato o estearato de ascorbilo son aditivos alimentarios aprobados en la Comunidad Europea (E300 ff–304b) y clasificados como GRAS (generalmente reconocidos como seguros) por la FDA.
5.2. Usos del ácido L-ascórbico en la nutrición animal
Si bien no es esencial para pollos de engorde, pavos y ponedoras debido a su producción endógena, la suplementación con vitamina C puede tener un impacto positivo en el rendimiento de las aves de corral al mejorar la ganancia de peso, la conversión alimenticia, la producción de huevos y la resistencia de la cáscara.
El ácido L-ascórbico también contribuye a mejorar la salud y la competencia inmunológica, en particular en condiciones estresantes (por ejemplo, estrés por calor), y tiene efectos sinérgicos cuando se combina con la vitamina E.
La vitamina C mejora la morfología de la mucosa intestinal y protege a los espermatozoides del daño oxidativo en los machos reproductores, lo que aumenta la fertilidad.
Los cerdos pueden sintetizar vitamina C, pero la eficiencia depende de la edad. Los lechones tienen una producción limitada hasta las 4-6 semanas, por lo que potencialmente se benefician de la suplementación para el rendimiento y la respuesta inmunológica.
Los peces no pueden sintetizar vitamina C y requieren ingesta dietética. El ácido ascórbico, o su forma más estable, el ácido ascórbico 2-fosfato, se utiliza en la piscicultura para prevenir el escorbuto y reforzar la función inmunológica.
La suplementación de la alimentación con vitamina C se puede realizar con ácido ascórbico cristalino, que también se puede utilizar en el agua de bebida.
Se utilizan formas especiales como el ácido ascórbico recubierto de etilcelulosa o las sales de Na/Ca para los alimentos tratados con calor y humedad (pellets o extrusión).
Consulte la Tabla 3 para conocer los requisitos detallados de vitamina C en varios animales.
| Animal | Suplementación recomendada |
|---|---|
| Gallinas ponedoras | 100-200 |
| Pollos de engorde (de inicio a finalización) | 100-200 |
| Reproductoras de pollos de engorde | 100-150 |
| Pavos de engorde (de inicio a finalización) | 100-200 |
| Pavo Criadores | 100-200 |
| Lechones (prestarter y starter) | 100-200 |
| Criadores de cerdos | |
| Cerdas jóvenes y adultas | 200-300 |
| Verracos | 200-500 |
| Terneros | 200-500 |
| Caballos (mg/cabeza/día) | |
| Potros | 500-750 |
| Caballos de carreras y de cría | 1000-2000 |
| Salmón y trucha | 150-250 |
| Peces de aguas cálidas (carpa y tilapia) | 150-250 |
| Dorada y lubina | 150-250 |
| Camarones | 250-500 |
| Perros | 100-200 |
| Gatos | 100-200 |
5.3. Otros usos
Los factores económicos limitan la aplicación del ácido ascórbico en la ciencia vegetal para la germinación de semillas, la protección del ozono, la asistencia en la cosecha, la resistencia a enfermedades y la regulación del crecimiento.
Existen aplicaciones menores en las industrias de polímeros, fotográfica y cosmética.
Referencia
- Vitamins, 14. Vitamin C (l-Ascorbic Acid); Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.o27_o10.pub2
