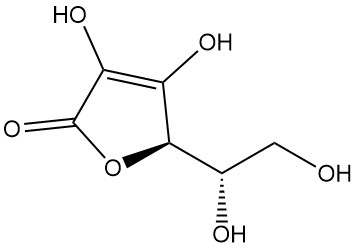
Wat is L-ascorbinezuur?
L-ascorbinezuur, ook bekend als (2R)-2-[(1S)-1,2-dihydroxyethyl]-3,4-dihydroxy-2H-furan-5-one, is de IUPAC-aanduiding voor vitamine C. Het is een wit of geurloos poeder of kristal met een zure smaak dat in de natuur voorkomt en antiscorbutische activiteit heeft, wat betekent dat het scheurbuik voorkomt, een ziekte die wordt veroorzaakt door een vitamine C-tekort.
L-ascorbinezuur werd voor het eerst geïsoleerd in 1928 en de structuur ervan werd vijf jaar later bepaald. Tegenwoordig is L-ascorbinezuur wereldwijd de meest geproduceerde vitamine, met een geschatte jaarlijkse productie van ongeveer 150.000 ton.
Een belangrijk kenmerk van L-ascorbinezuur is de omkeerbare oxidatie tot dehydro-L-ascorbinezuur. Dit redoxsysteem zorgt ervoor dat L-ascorbinezuur als reductiemiddel kan fungeren.
Van de vier diastereomeren van ascorbinezuur vertoont alleen D-araboascorbinezuur (ook bekend als isoascorbinezuur, erythorbinezuur en D-erythro-hex-2-eenzuur γ-lacton) een zwakke antiscorbutische activiteit (ongeveer 5% van die van L-ascorbinezuur).
Inhoudsopgave
1. Fysieke eigenschappen van L-ascorbinezuur
L-ascorbinezuur is een wit tot zeer lichtgeel kristallijn poeder dat zeer oplosbaar is in water (1 g in 3 ml), matig oplosbaar in ethanol, propyleenglycol en glycerol, en onoplosbaar in ether, chloroform, benzeen, petroleumether, oliën, vetten en vetoplosmiddelen.
Een samenvatting van de fysieke eigenschappen van l-ascorbinezuur wordt gegeven in de volgende tabel.
| Eigenschap | Waarde |
|---|---|
| CAS-nummer | [50-81-7] |
| Formule | C6H8O6 |
| Moleculair gewicht | 176,13 g/mol |
| Smeltpunt | 190–192 °C (ontleding) |
| Dichtheid | 1,65 g/cm3 |
| Optische rotatie | [α]20H2O: +20,5° tot +21° (c = 1) |
| [α]20EtOH: +52° (c = 0,5) | |
| [α]20MeOH: +49,5° (c = 0,5) | |
| pH | 3 (5 g/L) 2 (50 g/L) |
| pK1 | 4,17 (3-OH) |
| pK2 | 11,57 (2-OH) |
| Redoxpotentiaal | E = +0,127 V (pH=5) |
2. Chemische eigenschappen van L-ascorbinezuur
L-ascorbinezuur bestaat in ten minste vijf tautomere vormen. De meest voorkomende vorm, tautomeer (1), vertegenwoordigt de kristalstructuur en domineert in zure waterige oplossingen (pH = 2). Zowel de 2-OH- als de 3-OH-groep zijn zuur en vormen monobasische zouten met basen; dibasische zouten zijn echter instabiel.
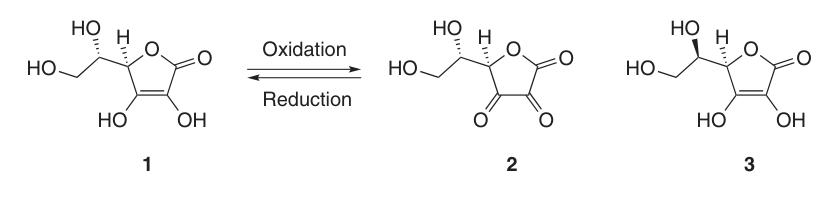
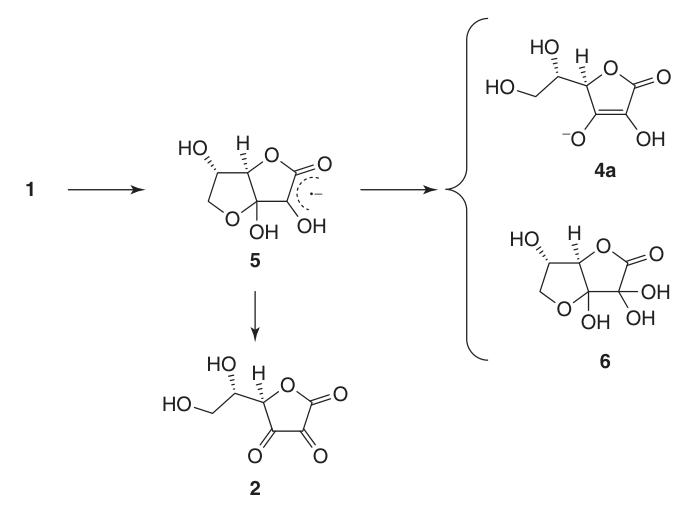
In natrium- en calciumascorbaat interageert het metaalion met het zuurstofatoom op positie 3 (4a). De negatieve lading op het ascorbaatmonoanion is gedelokaliseerd binnen het π-elektronensysteem, wat bijdraagt aan de stabiliteit van zijn lactonring in alkalische omgevingen.
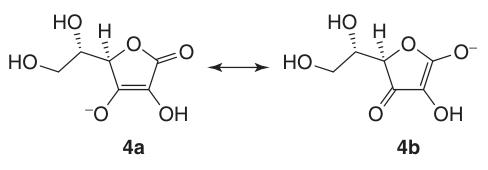
L-ascorbinezuur ondergaat gemakkelijk isomerisatie tot L-isoascorbinezuur bij koken in methanolische kaliumhydroxide.
Vanwege zijn enediolstructuur fungeert L-ascorbinezuur als een krachtig reductiemiddel. De oxidatie van ascorbinezuur (1) levert dehydroascorbinezuur (2) op, dat langs het radicale anionintermediair semidehydroascorbinezuur (5) gaat.
Semidehydroascorbinezuur is een sterk zuur (pKa = 0,45) en een radicalenvanger die met zichzelf kan reageren om ascorbinezuur en verbinding (6) te regenereren of met andere vrije radicalen te reageren.
Overgangsmetalen zoals Cu en Fe katalyseren de autoxidatie van ascorbinezuur naar dehydroascorbinezuur (2). Deze metalen vormen een ternair intermediair complex met zuurstof, dat dissocieert om dehydroascorbinezuur (2), waterstofperoxide en het metaalion op te leveren.
Het autoxidatieproces wordt versneld boven pH 7 en kan worden geremd door metaalionen te complexeren met chelerende middelen zoals EDTA, metafosforzuur, citroenzuur of oxaalzuur.
Behandeling van ascorbinezuur met zuurstof in methanol met actieve kool vormt een stroperig methanoladduct, dat bij verdere verwerking dehydroascorbinezuur (2) oplevert als een kristallijn dimeer met een opbrengst van 64%.
Bij pH 2,5–5,5 in een waterige oplossing en bij 4 °C is verbinding (2) enkele dagen stabiel; reductiemiddelen zoals waterstofsulfide, dithiothreitol of cysteïne kunnen het echter kwantitatief terug omzetten in ascorbinezuur.
Terwijl dehydroascorbinezuur (2) de activiteit van vitamine C behoudt, leidt onomkeerbare opening van de lactonring om 2,3-diketogulonzuur (8) te vormen tot volledig verlies van deze activiteit.
L-ascorbinezuur ondergaat afbraak in waterige oplossingen onder zowel aerobe als anaerobe omstandigheden. De snelheid van ontleding hangt af van factoren zoals pH, temperatuur, licht, concentratie en de aanwezigheid van zware metaalkatalysatoren.
De aanwezigheid van zuurstof versnelt het afbraakproces aanzienlijk vergeleken met anaërobe omstandigheden. De uiteindelijke oxidatieproducten omvatten L-threonzuur (9) en oxaalzuur. Onder anaërobe omstandigheden leidt afbraak tot furfural (10) en CO2.
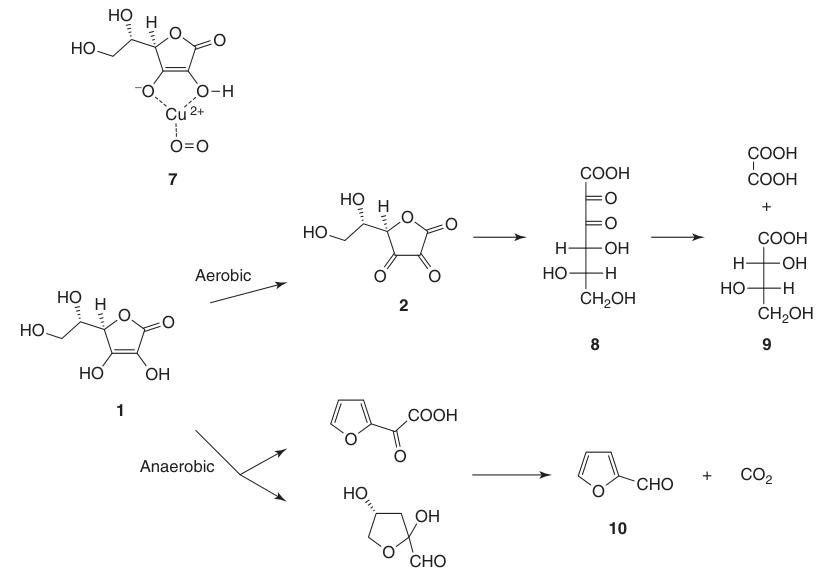
Vaste L-ascorbinezuur is zeer stabiel gedurende lange tijd bij afwezigheid van vocht en licht.
Bescherming tegen oxidatieve afbraak in waterige toepassingen kan worden bereikt door te coaten met vetten en polymeren of door chemische substitutie van de enediolhydroxylgroepen (L-ascorbaat 2-sulfaat, L-ascorbaat 2-fosfaat en 2-O-methylascorbinezuur).
3. Natuurlijke bronnen van vitamine C
Ascorbinezuur (vitamine C) is een wijdverspreide verbinding die wordt aangetroffen in planten en sommige dieren. Het komt vooral veel voor in groene planten, met de hoogste concentraties waargenomen in tropische vruchten en gladiolenbladeren. De aanwezigheid ervan in gist en niet-cyanobacteriële prokaryoten blijft onduidelijk.
Historisch gezien was de inname van vitamine C tijdens de wintermaanden sterk afhankelijk van wortelgroenten zoals aardappelen en kool. Tegenwoordig, met het hele jaar door toegang tot verse groenten en fruit, zijn de voedingsbronnen van vitamine C diverser. Opslag- en kookprocessen kunnen echter bijdragen aan de afbraak van vitamine C.
De distributie van vitamine C binnen plantenweefsels varieert. Opvallend is dat sommige planten, zoals Brassica-soorten en Elaeocarpus-soorten, vitamine C opslaan in gebonden vormen, respectievelijk bekend als ascorbigen en elaeocarpusine.
Vitamine C wordt ook aangetroffen bij dieren, maar in lagere concentraties vergeleken met planten. De hoogste concentraties worden aangetroffen in de endocriene organen van zoogdieren zoals koeien (hypofyse en bijnieren).
Bepaalde diersoorten, waaronder mensen, primaten, cavia’s, vliegende zoogdieren, sommige vogels, vissen en insecten, hebben niet het vermogen om vitamine C te synthetiseren en zijn afhankelijk van voedselinname.
4. Industriële productie van L-ascorbinezuur
De eerste succesvolle synthese van L-ascorbinezuur vond plaats nog voordat de volledige chemische structuur ervan was bepaald. In dit proces reageerde L-xylosone (11) met kaliumcyanide om l-xylonitril (12) te vormen, dat na lactonisatie en enolisatie L-ascorbinezuur opleverde in ongeveer 40%.
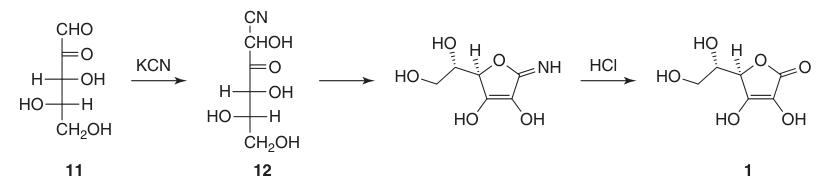
Een groot nadeel van deze eerste synthese was echter de moeilijkheid en de kosten die gepaard gingen met het verkrijgen van L-xyloson (11).
Gelukkig publiceerden Reichstein en Grüssner ongeveer een jaar later een praktischer methode voor het synthetiseren van L-ascorbinezuur, waarbij gebruik werd gemaakt van direct beschikbare D-glucose (13) (een C6-suiker) als uitgangsmateriaal. Het werd meer dan 60 jaar lang de dominante commerciële productieroute, met kleine verbeteringen onderweg.
Sinds de jaren 80 heeft het productieproces een aanzienlijke verschuiving ondergaan. Sorbitol is het favoriete uitgangsmateriaal geworden, waarbij een tweestaps fermentatieve oxidatie wordt gebruikt om 2-ketogulonzuur te produceren.
Hoewel glucosehydrogenering een methode blijft voor de productie van sorbitol, wordt deze niet altijd uitgevoerd door de uiteindelijke fabrikant van ascorbinezuur.
Ondanks de verschuiving naar fermentatie, behoudt het algemene concept achter het moderne proces zijn verbinding met de oorspronkelijke Reichstein-synthese. Het belangrijkste verschil ligt in het gebruik van microbiële oxidatie in plaats van chemische methoden.
4.1. Productie van L-ascorbinezuur door Reichstein-synthese
De Reichstein-synthese van L-ascorbinezuur is een reeks eenvoudige, hoogproductieve chemische reacties die het splitsen of vormen van koolstof-koolstofbindingen vermijden.
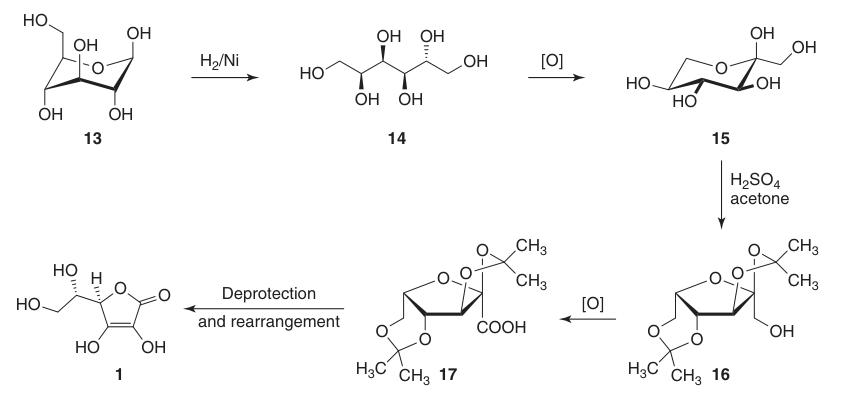
Het reduceert de C-1 positie van D-glucose (13) en oxideert posities 5 en 6, terwijl de chiraliteit op C-2 en C-3 behouden blijft. Dit leidt uiteindelijk tot de gewenste L-threo configuratie op C-4 en C-5 in het eindproduct.
De klassieke Reichstein-Grussner synthese begint met het reduceren van D-glucose (13) tot D-sorbitol (14) met behulp van hydrogenering over een nikkel katalysator. D-sorbitol wordt microbiologisch geoxideerd tot L-sorbose (15) door de bacterie Acetobacter xylinum.
L-sorbose (15) wordt behandeld met aceton en zwavelzuur bij lage temperaturen om het beschermde tussenproduct 2,3:4,6-di-O-isopropylideen-α-L-sorbofuranose (16) te vormen.
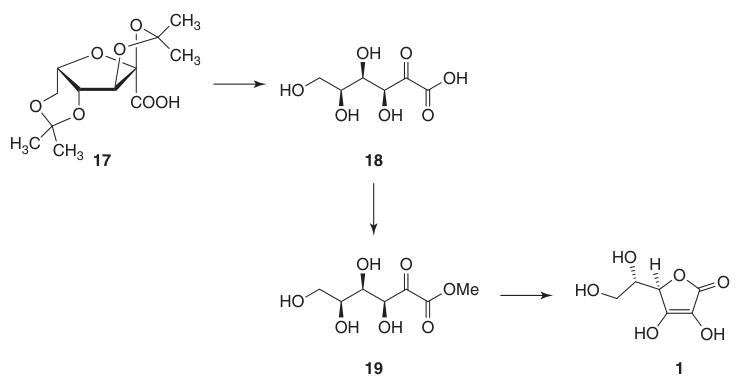
Deze bescherming van hydroxylgroepen op C-2, C-3, C-4 en C-6 maakt oxidatie met hoge opbrengst tot di-O-isopropylideen-2-ketogulonzuur mogelijk met behulp van kaliumpermanganaat in een alkalische oplossing. De deprotectie met heet water levert 2-keto-L-gulonzuur (18) op.
L-ascorbinezuur wordt geproduceerd door verhitting van 2-keto-L-gulonzuur (18) in water bij 100 °C om een opbrengst van 20% te verkrijgen of door verestering gevolgd door verzuring om een opbrengst van 70% te verkrijgen.
De totale opbrengst van L-ascorbinezuur uit D-glucose (13) met behulp van deze methode is ongeveer 15–18%.
4.2. Industriële productie van L-ascorbinezuur via de Reichstein-route
De transformatie van Reichsteins klassieke proces naar een commercieel levensvatbare methode vereiste een aanzienlijke optimalisatie van elke reactiestap. Deze ontwikkelingen omvatten zowel technische als chemische modificaties en resulteerden in individuele stapopbrengsten van meer dan 90%, wat leidde tot een totale opbrengst van L-ascorbinezuur uit D-glucose (13) van ongeveer 60%.
Belangrijke stappen en optimalisaties zijn:
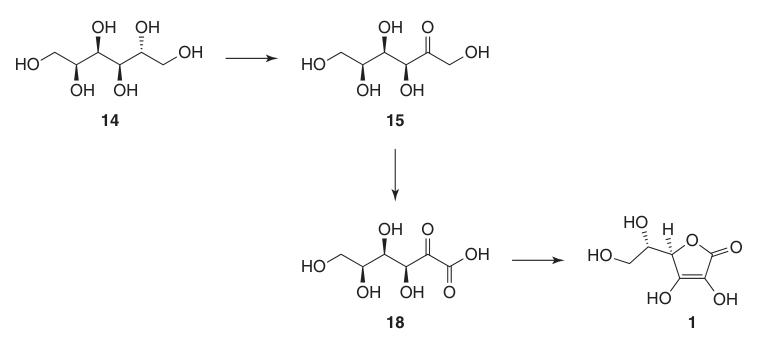
1. D-Sorbitol (14)
Hogedrukhydrogenering van D-glucose (13) met een Raney-nikkelkatalysator bij verhoogde temperaturen bereikt bijna kwantitatieve opbrengsten van D-sorbitol (14) met minimale vorming van bijproducten zoals D-mannitol en L-iditol.
De sorbitoloplossing wordt direct gebruikt in fermentatie zonder verdere zuivering, dus hoogwaardige startglucose is nodig.
2. L-Sorbose (15)
Microbiële oxidatie van steriele D-sorbitol (14)-oplossingen met behulp van stammen zoals Gluconobacter oxydans levert efficiënt L-sorbose (15) op met meer dan 90% conversie.
Fermentaties op grote schaal vereisen strikte controle van pH (4-6), temperatuur (30-35 °C) en steriele omstandigheden om productverlies tijdens oxidatie en opwerking door filtratie en kristallisatie te minimaliseren.
3. 2,3:4,6-Di-O-isopropylideen-α-L-sorbofuranose (16)
Bescherming van 2,3- en 4,6-hydroxylgroepen in L-sorbose (15) wordt bereikt door cyclische ketalvorming met aceton en overtollig zwavelzuur als katalysatoren of dehydraterende middelen bij lage temperaturen (bijv. 4 °C).
Het hoofdproduct is 2,3:4,6-di-O-isopropylideen-α-L-sorbofuranose (16), met mono-isopropylideenderivaten als winbare bijproducten.
4. 2,3:4,6-Di-O-isopropylideen-2-keto-L-gulonzuur (17)
Oorspronkelijk werd bij de oxidatie van 2,3:4,6-di-O-isopropylideen-α-L-sorbofuranose (16) tot 2,3:4,6-di-O-isopropylideen-2-keto-L-gulonzuur (17) KMnO4 gebruikt bij verhoogde temperaturen in verdund natriumhydroxide om ongeveer 90% product op te leveren.
Er zijn meer kosteneffectieve alternatieven ontwikkeld voor continue processen zoals hypochlorietoxidatie met katalytische nikkelchloride/sulfaat bij 60 °C, wat een opbrengst van meer dan 93% oplevert, en elektrochemische oxidatie met behulp van nikkel/nikkeloxide-elektroden in alkalische oplossing.
Metaalkatalysator (palladium of platina op koolstof) oxidatie met lucht of zuurstof in een alkalische oplossing is een andere methode die goede opbrengsten biedt.
5. L-ascorbinezuur (1)
Omzetting van 2,3:4,6-di-O-isopropylideen-2-keto-L-gulonzuur (17) naar L-ascorbinezuur kan op twee manieren worden bereikt:
- Deprotectie tot 2-keto-L-gulonzuur (18), gevolgd door verestering met methanol en base-gekatalyseerde cyclisatie.
- Directe zuur-gekatalyseerde cyclisatie van ascorbinezuur van het beschermde of gedeprotecteerde 2-keto-L-gulonzuur (18).
De base-gekatalyseerde methode gebruikt methyl 2-keto-L-gulonaat (19), bereid uit 2-keto-L-gulonzuur (18) door reactie met methanol in de aanwezigheid van een zuur. Latere reacties met basen zoals natriumwaterstofcarbonaat produceren natriumascorbaat in hoge opbrengst.
De eerste zuurgekatalyseerde route naar ascorbinezuur ontstond kort na de ontdekking van het Reichstein-proces.
4.3. Moderne productie van ascorbinezuur: chemische oxidatie vervangen door fermentatie
De directe omzetting van L-sorbose (15) in 2-keto-L-gulonzuur (18) (2-KGA), een cruciaal tussenproduct in de synthese van vitamine C, is een belangrijk doelwit voor verbetering geweest. Hoewel chemische oxidatie met behulp van platina- of goud-platinakatalysatoren enig succes boekte, bleek fermentatie een schaalbaardere en efficiëntere aanpak.
Vroege pogingen onderzochten het gebruik van Gluconobacter voor fermentatieve oxidatie. Een doorbraak kwam echter in de jaren 80 met de ontdekking van Ketogulonicigenium vulgare door de Chinese Academie van Wetenschappen.
Dit micro-organisme bood de potentie om de chemische oxidatiestappen in het Reichstein-proces volledig te vervangen. Tegenwoordig is vrijwel alle wereldwijde productie van vitamine C afhankelijk van 2-KGA (18)-fermentatie van L-sorbose (15) door Ketogulonicigenium vulgare.
De eerste conversiestappen van D-glucose naar L-sorbose (15) zijn grotendeels ongewijzigd gebleven ten opzichte van de Reichstein-methode die in de jaren 30 werd ontwikkeld. De daaropvolgende omzetting van L-sorbose naar L-ascorbinezuur maakt nu gebruik van een tweestaps fermentatieproces dat wereldwijd domineert:
- Commercieel verkregen D-sorbitol (14) wordt gefermenteerd met Gluconobacter oxydans om L-sorbose (15) te produceren.
- De gesteriliseerde L-sorbose (15) bouillon ondergaat verdere oxidatie tot 2-KGA (18) door een gemengde fermentatie met Ketogulonicigenium vulgare en Bacillus megaterium. Bacillus megaterium speelt een ondersteunende rol, waardoor Ketogulonicigenium, dat beperkte voedingsbehoeften heeft, kan gedijen op een eenvoudig en goedkoop medium.
Dit tweestaps fermentatieproces bereikt een snelle en efficiënte oxidatie van L-sorbose (15) tot 2-KGA (18), met gerapporteerde titers van meer dan 100 g/L en opbrengsten van ongeveer 90% van L-sorbose binnen 40 uur.
Recente ontwikkelingen hebben de noodzaak van tussentijdse L-sorbose-sterilisatie in sommige processen geëlimineerd.
Het combineren van beide fermentatiestappen in één tank is onderzocht. Gluconobacter oxideert eerst D-sorbitol (14) tot L-sorbose (15), gevolgd door Ketogulonicigenium-groei en L-sorbose-oxidatie tot 2-KGA (18).
Deze aanpak vereist zorgvuldige timing om ongewenste C-1-oxidatie van D-sorbitol door het enzym van Ketogulonicigenium te voorkomen. Ondanks veelbelovende resultaten met 2-KGA (18) titers van 140 g/L en hoge conversieopbrengsten, blijft de commerciële levensvatbaarheid van dit single-tankproces onduidelijk.
De verschuiving van chemische oxidatie naar fermentatie heeft de productie van vitamine C gerevolutioneerd en biedt een efficiënter, schaalbaarder en potentieel eenvoudiger proces.
4.4. Andere methoden voor de productie van ascorbinezuur
Alle productieprocessen voor l-ascorbinezuur zijn gedeeltelijke syntheses waarbij de chiraliteit bij C-4 en C-5 afkomstig is van natuurlijk voorkomende suikers, voornamelijk D-glucose. De omzetting van D-glucose naar L-ascorbinezuur wordt bereikt door de stereochemie bij C-4 en C-5 te manipuleren met behulp van koolstofketeninversie of C-5-configuratie-inversie.
Historisch gezien domineerde het Reichstein-proces de industriële productie van L-ascorbinezuur. Deze meerstaps chemische en fermentatiebenadering is sindsdien grotendeels vervangen door het efficiëntere 2-KGA (18) fermentatieproces.
Hoewel er talloze alternatieve benaderingen zijn onderzocht, heeft geen enkele het economische belang van het 2-KGA (18) fermentatieproces overtroffen. Deze alternatieven omvatten:
- Alternatieve 2-KGA (18) fermentatie met behulp van micro-organismen zoals Pseudomonas en gemanipuleerde Gluconobacter-stammen.
- L-ascorbinezuur produceren via oxidatie- en reductiestappen op D-gluconzuur.
- Directe L-ascorbinezuurfermentatie met behulp van l-sorbosondehydrogenase of gemanipuleerde gist/microalgen.
- Goedkopere opties verkennen zoals pectine uit afvalstromen van fruitverwerking of zetmeel.
- Chemische omzettingen naar L-ascorbinezuur-tussenproducten, zoals zetmeel naar L-gulono-1,4-lacton, voor mogelijke combinatie met biokatalyse.
De focus voor toekomstige ontwikkelingen ligt op fermentatieve en biokatalytische processen voor eenvoudigere en efficiëntere L-ascorbinezuurproductie. Veelbelovende gebieden zijn onder meer:
- Directe biokatalytische conversie met enzymen die 2-KGA (18) of L-sorboson direct omzetten in L-ascorbinezuur.
- Genetisch gemodificeerde micro-organismen zoals gemodificeerde gist of microalgen.
- Alternatieve grondstoffen gebruiken goedkopere en overvloedigere grondstoffen zoals zetmeel of pectine-afvalstromen.
Ondanks de dominantie van het 2-KGA (18)-fermentatieproces streeft continu onderzoek ernaar om duurzamere, kosteneffectievere en gestroomlijnde methoden te ontwikkelen voor industriële L-ascorbinezuurproductie.
4.5. Vitamine C uit natuurlijke bronnen
Hoewel synthetische vitamine C de markt domineert vanwege betaalbaarheid en grootschalige productie, is sinds 2010 natuurlijke vitamine C uit acerola- en rosa roxburghii-vruchten beschikbaar, zij het tegen een hogere prijs en lagere productiecapaciteit.
Deze vruchten bevatten van nature uitzonderlijk hoge niveaus vitamine C, ongeveer 2-3 g per 100 g vruchtvlees.
Extractieprocessen leveren producten op met een vitamine C-gehalte van 10-25%, afhankelijk van de toegevoegde hulpstoffen. Natuurlijke vitamine C wordt voornamelijk op de markt gebracht voor menselijke voeding en persoonlijke verzorgingstoepassingen.
5. Industriële toepassingen van L-ascorbinezuur
5.1. Gebruik van L-ascorbinezuur in farmaceutica en voeding
Ongeveer een derde van de totale productie wordt gebruikt voor vitaminesupplementen in de farmaceutische industrie. Het resterende deel dient voornamelijk als een voedings- en veevoeradditief om de productkwaliteit en stabiliteit te verbeteren.
L-ascorbinezuur is een veelvoorkomend bestanddeel in verschillende farmaceutische formuleringen, waaronder multivitaminen, tabletten, siropen, elixers en bruistabletten. Vaste doseringsvormen zijn zeer stabiel, terwijl vloeibare formuleringen gevoelig zijn voor afbraak en interactie met andere ingrediënten.
De voedingsindustrie vertegenwoordigt de grootste toepassingssector, met name in de verwerking van vlees, fruit en meel. L-ascorbinezuur fungeert als een antioxidant en essentiële vitamine en draagt bij aan:
- Remming van nitrosaminevorming in vleeswaren.
- Voorkomen van enzymatische bruinkleuring in bewerkte groenten en fruit.
- Herstel en versterking van de voedingswaarde van voedsel en dranken.
- Verbetering van de kwaliteit van bloem en deeg.
- Vertraging van oxidatieve ranzigheid in vetten en oliën.
- Verbetering van de helderheid in wijn en bier.
- Synergistische effecten in combinatie met andere antioxidanten (bijv. tocoferolen).
L-ascorbinezuur, de zouten ervan en ascorbylpalmitaat of -stearaat zijn goedgekeurde levensmiddelenadditieven in de Europese Gemeenschap (E300 ff–304b) en door de FDA geclassificeerd als GRAS (Generally Recognized As Safe).
5.2. Toepassingen van L-ascorbinezuur in diervoeding
Hoewel het niet essentieel is voor vleeskuikens, kalkoenen en leghennen vanwege hun endogene productie, kan vitamine C-suppletie een positieve invloed hebben op de prestaties van pluimvee door gewichtstoename, voederconversie, eiproductie en eierschaalsterkte te verbeteren.
L-ascorbinezuur draagt ook bij aan een verbeterde gezondheid en immuuncompetentie, met name onder stressvolle omstandigheden (bijv. hittestress), en het heeft synergetische effecten in combinatie met vitamine E.
Vitamine C verbetert de morfologie van het darmslijmvlies en beschermt spermatozoa tegen oxidatieve schade bij mannelijke fokdieren, wat leidt tot een verhoogde vruchtbaarheid.
Varkens kunnen vitamine C synthetiseren, maar de efficiëntie is leeftijdsafhankelijk. Biggen hebben een beperkte productie tot 4-6 weken, wat mogelijk baat heeft bij suppletie voor prestaties en immuunrespons.
Vissen kunnen geen vitamine C synthetiseren en hebben voedselinname nodig. Ascorbinezuur, of de stabielere vorm, 2-fosfaat ascorbinezuur, wordt gebruikt in de viskwekerij om scheurbuik te voorkomen en de immuunfunctie te versterken.
Voedersupplementen met vitamine C kunnen worden gemaakt met kristallijn ascorbinezuur, dat ook kan worden gebruikt in drinkwater.
Speciale vormen zoals ethylcellulose-gecoat ascorbinezuur of Na/Ca-zouten worden gebruikt voor hitte- en vochtbehandelde voeders (pellets of extrusie).
Raadpleeg Tabel 3 voor gedetailleerde vitamine C-behoeften bij verschillende dieren.
| Voedselgroep | Vis C (mg/100 g) |
|---|---|
| Vis | 0–4 |
| Asperges | 7–25 |
| Vlees (rundvlees, varkensvlees) | 0–10 |
| Bonen | 5–30 |
| Melk (koe) | 1–2 |
| Broccoli | 20–100 |
| Fruit (appels, kersen, kiwi's, sinaasappels) | 4–180 |
| Groenten (broccoli, spruitjes, bloemkool, spinazie, rapen) | 20–90 |
| Wortelgroenten (wortels, aardappelen) | 2–20 |
| Granen (haver, rogge, tarwe) | <1 |
| Rijst | 0 |
| Dier | Aanbevolen supplementen |
|---|---|
| Leghennen | 100-200 |
| Vleeskuikens voor de mesterij (van begin tot eind) | 100-200 |
| Vleeskuikenouderdieren | 100-150 |
| Kalkoenen voor de mesterij (van begin tot eind) | 100-200 |
| Kalkoenfokkers | 100-200 |
| Biggen (prestarter en starter) | 100-200 |
| Varkensfokkers | |
| Zeugen en gelten | 200-300 |
| Beren | 200-500 |
| Kalf | 200-500 |
| Paarden (mg/hoofd/dag) | |
| Veulens | 500-750 |
| Race- en fokpaarden | 1000-2000 |
| Zalm en forel | 150-250 |
| Warmwatervissen (karper en tilapia) | 150-250 |
| Zeebrasem en zeebaars | 150-250 |
| Garnalen | 250-500 |
| Honden | 100-200 |
| Katten | 100-200 |
5.3. Andere toepassingen
Economische factoren beperken de toepassing van ascorbinezuur in de plantkunde voor zaadontkieming, ozonbescherming, oogsthulp, ziekteresistentie en groeiregulatie.
Kleinere toepassingen bestaan in de polymeer-, fotografische en cosmetische industrie.
Referentie
- Vitamins, 14. Vitamin C (l-Ascorbic Acid); Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.o27_o10.pub2




