Wat is ethyleendiaminetetraazijnzuur?
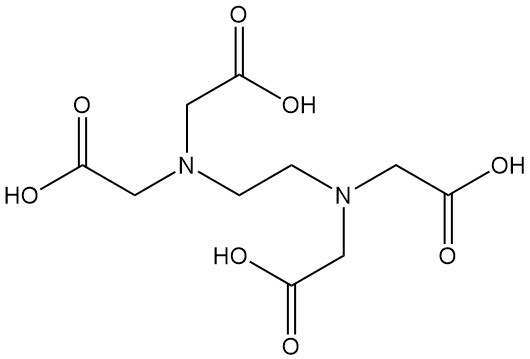
Ethyleendiaminetetraazijnzuur, beter bekend als EDTA, is een aminopolycarbonzuur met de formule C10H16N2O8. Het is een witte vaste stof die onoplosbaar is in water en een van de meest gebruikte chelerende middelen in diverse industrieën is.
Ethyleendiaminetetraazijnzuur (EDTA), nitrilotriazijnzuur (NTA) en hun respectievelijke zouten werden voor het eerst gesynthetiseerd in de jaren 1930 door Ferdinand Munz van de laboratoria van I.G. Farbenindustrie. Sindsdien hebben ze aanzienlijk aan belang gewonnen als industriële chelerende middelen.
Aminopolycarbonzuren (zoals EDTA), vergelijkbaar met aminozuren, kunnen zouten vormen met sterke zuren en basen. Daarnaast bezitten ze het vermogen om sterke, in water oplosbare complexen te vormen met divalente en trivalente kationen. Deze complexen veranderen de reactiviteit van het metaalion aanzienlijk, waardoor ze waardevolle verbindingen zijn in verschillende industriële processen.
De primaire industriële toepassing van EDTA is het voorkomen of verwijderen van kalkaanslag en onoplosbare afzettingen die calcium, barium, ijzer en andere kationen bevatten.
Inhoudsopgave
1. Fysieke eigenschappen van ethyleendiaminetetraazijnzuur (EDTA)
Ethyleendiaminetetraazijnzuur is een kleurloze, kristallijne vaste stof die licht oplosbaar is in water. Belangrijke fysieke eigenschappen van EDTA worden in de volgende tabel vermeld.
| Eigenschap | Waarde |
|---|---|
| CAS-nummer | [60-00-4] |
| Chemische formule | C10H16N2O8 |
| Moleculair gewicht | 292,24 g/mol |
| Smeltpunt | 245 °C (ontleding) |
| Relatieve dichtheid | 0,86 g/cm3 |
| Oplosbaarheid in water bij 20 °C | 0,1 g/L |
| pKa1 | 2 |
| pKa2 | 2,7 |
| pKa3 | 6,16 |
| pKa4 | 10,26 |
| Vlampunt | > 100 °C |
2. Chemische eigenschappen van ethyleendiaminetetraazijnzuur
EDTA vormt in water oplosbare complexen met twee- en driewaardige metaalkationen. Deze complexen hebben een ringstructuur die een chelaat wordt genoemd (van het Griekse “chele”, wat klauw betekent), waarbij het metaalion stevig is gebonden door de gedissocieerde ligand EDTA4-.
De sterkte van dit complex wordt gekwantificeerd door de stabiliteitsconstante, die de evenwichtsconcentraties van het metaalion (M) en het chelerende middel (EDTA4-) weerspiegelt.
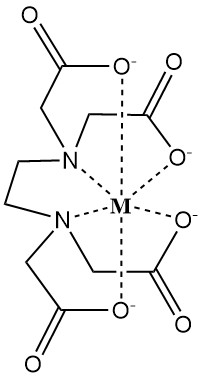
Factoren die de chelatiesterkte beïnvloeden zijn pH, concurrerende anionen en neerslaande anionen.
Een hogere pH bevordert chelatie omdat het de concentratie van volledig gedissocieerde chelaatanionen (bijv. EDTA4-) verhoogt, waardoor hun bindingscapaciteit wordt vergroot. Dit effect kan echter worden tegengegaan door hydroxyl-ionen (OH–) bij een hoge pH, die metaalchelaten kunnen verstoren als het metaal onoplosbare hydroxiden vormt (bijv. Fe3+-neerslag boven pH 5,5).
Anionen zoals carbonaat, fosfaat en oxalaat kunnen concurreren met het chelatiemiddel, waardoor de effectieve sterkte van het metaal-chelatiemiddelcomplex afneemt.
Over het algemeen vormen chelatiemiddelen zoals EDTA 1:1-complexen met metaalionen. Het verhogen van de concentratie van het chelatiemiddel boven 1:1 kan de stabiliteit echter verder verbeteren.
Het omzetten van metaalkationen in anionische metaalcomplexen verandert hun interactie met andere soorten. Het negatief geladen [Fe(III)(EDTA)]–-complex kan bijvoorbeeld gemakkelijker door de grond bewegen in vergelijking met het geabsorbeerde Fe3+-kation.
Chelatie verlaagt de concentratie van vrije metaalionen (M) door complexvorming, waardoor het effectieve oxidatiepotentieel effectief wordt verhoogd. Dit principe is de basis voor verschillende belangrijke industriële processen.
3. Productie van ethyleendiaminetetraazijnzuur (EDTA)
Ethyleendiaminetetraazijnzuur (EDTA) werd commercieel geproduceerd door de reactie van ethyleendiamine, chloorazijnzuur en natriumhydroxide. Dit proces resulteerde in een product dat verontreinigd was met natriumchloride en is verlaten vanwege zuiveringsproblemen.
Andere methoden, zoals de katalytische oxidatie van specifieke uitgangsmaterialen, werden onderzocht maar nooit commercieel aangenomen.
Tegenwoordig domineren twee hoofdprocessen de productie van EDTA en gerelateerde chelerende middelen, beide met betrekking tot de cyanomethylering van de oorspronkelijke polyamine.
3.1. De alkalische cyanomethylering van ethyleendiamine
De alkalische cyanomethylering van ethyleendiamine is het meest gebruikte proces voor het synthetiseren van ethyleendiaminetetraazijnzuur.
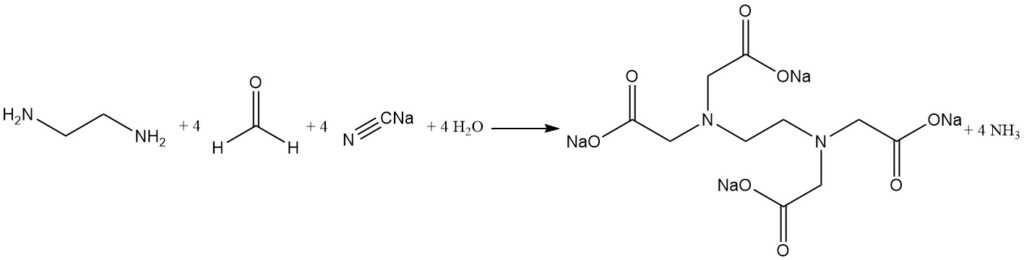
Natriumcyanide en formaldehyde reageren met ethyleendiamine om EDTA te produceren met hoge opbrengsten (meer dan 90%). Ammoniak is het primaire bijproduct en wordt continu verwijderd tijdens de reactie. Kleine hoeveelheden ammoniak reageren echter om zouten van ongewenste bijproducten te vormen, zoals nitrilotriazijnzuur en glycine.
Glycolzuurzouten kunnen ook worden gevormd uit de reactie tussen startmaterialen. Deze onzuiverheden hebben minimale impact op de meeste chelaterende agentiatoepassingen.
3.2. De tweestaps Singer-synthese
De tweestaps Singer-synthese scheidt de cyanomethyleringsstap van de hydrolysereactie. Hier reageren waterstofcyanide en formaldehyde met ethyleendiamine om een tussenproduct met hoge opbrengst (meer dan 96%) te vormen, (ethyleendinitrilo)tetraacetonitril.
Dit onoplosbare tussenproduct wordt geïsoleerd, gewassen en vervolgens gehydrolyseerd met natriumhydroxide om zuiver tetranatrium-EDTA te verkrijgen met ammoniak als bijproduct. Door de reactie in twee stappen te splitsen, wordt de vorming van onzuiverheden geminimaliseerd en ontstaat een zeer zuivere chelator.
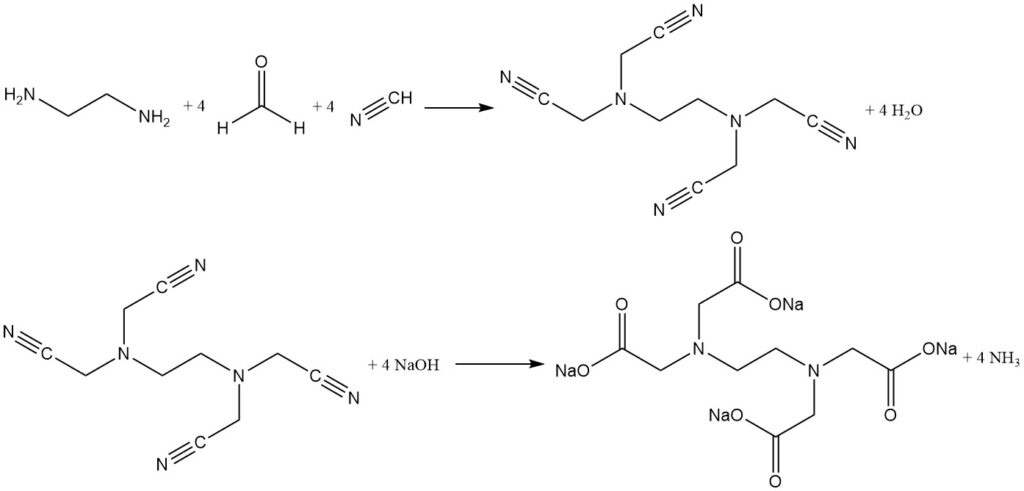
Deze tweestapsaanpak wordt ook gebruikt voor efficiënte productie van zuiver nitrilotriazijnzuur met behulp van ammoniak.
4. Toepassingen van ethyleendiaminetetraazijnzuur (EDTA)
Chelaatvormers zoals EDTA, met hun unieke vermogen om metaalionen te binden en te inactiveren, vinden toepassingen in verschillende industrieën.
Chelaatvormers van het type EDTA voorkomen ongewenste kleurveranderingen in kleurstoffen door sporenmetaalverontreinigingen uit vezels, chemicaliën en water te complexeren.
EDTA verbetert de helderheid van papierpulp die is gebleekt met waterstofperoxide of dithioniet. Het fungeert als een stabilisator en metaalionencontrolemiddel tijdens de pulp- en bleekfasen.
EDTA wordt gebruikt om kalkaanslag uit boilers te verwijderen en de vorming van calcium- en magnesiumaanslag te voorkomen door deze metaalionen te complexeren. Een juiste doseringscontrole is echter belangrijk om te voorkomen dat overmatige cheleermiddelen corrosie veroorzaken.
Polymeren worden soms gebruikt in combinatie met cheleermiddelen om hun corrosieve potentieel te minimaliseren.
EDTA kan worden gebruikt om metalen oppervlakken te helpen reinigen door aanhechtende oxidefilms op te lossen, waardoor grondig kan worden gespoeld. Metaalplateringsoplossingen voegen vaak chelerende middelen zoals EDTA toe om complexe metaalionen te vormen, wat resulteert in gladdere en meer uniforme metaalcoatings.
Wasmiddelen, reinigers voor harde oppervlakken en badkamerreinigers voegen EDTA toe, wat hun reinigingskracht verbetert.
EDTA verstoort de buitenste celwand van bepaalde bacteriën, met name gramnegatieve bacteriën, waardoor de effectiviteit van ontsmettingsmiddelen wordt vergroot. Het fungeert ook als een conserveringsversterker in cosmetica, shampoos en oogheelkundige producten door hun bacteriedodende activiteit te verhogen.
Ethyleendiaminetetra-azijnzuur voorkomt oxidatieve ranzigheid in vette emulsies zoals mayonaise en saladedressings door metaalionen te complexeren die bederf kunnen versnellen. Het voorkomt ook verkleuring veroorzaakt door ijzer in voedingsmiddelen zoals aardappelen.
Chelatie met EDTA wordt commercieel gebruikt bij de emulsiepolymerisatie van styreen-butadieenrubber en het bleken van fotografische film. IJzerchelaten worden gebruikt om industriële emissies van waterstofsulfide te beheersen en als reversibele absorbentia voor stikstofoxiden.
Sporenmetaalionen kunnen chemische processen verstoren. Chelaatvormers zoals EDTA verwijderen deze ongewenste metalen om de procesefficiëntie te waarborgen en aan de productspecificaties te voldoen.
Micronutriënten zoals ijzer, zink, mangaan en koper worden in gechelateerde vorm aan meststoffen toegevoegd. Dit voorkomt dat ze interacteren met fosfaten en andere bodemcomponenten die neerslag kunnen veroorzaken en hun opname door planten kunnen verminderen.
De chelatie zorgt ervoor dat deze micronutriënten gemakkelijker door de bodem naar de wortelzone kunnen bewegen voor absorptie door planten.
EDTA wordt veel gebruikt in titrimetrische methoden vanwege de snelle verandering in vrije metaalionconcentratie op het equivalentiepunt. Het wordt ook gebruikt als maskeringsmiddel in sommige spectrofotometrische methoden om interferentie van metaalionen te elimineren.
EDTA is het dominante chelerende middel en is goed voor bijna de helft van de totale consumptie in West-Europa (78.000 ton in 2004). Belangrijke producenten zijn Dow Chemical, BASF en AkZO.
5. Toxicologie van EDTA
EDTA en zijn zouten hebben een lange geschiedenis van veilig gebruik in verschillende toepassingen, waaronder voedseladditieven, farmaceutische producten en cosmetica. Vroege toxicologische studies suggereren een relatief lage toxiciteit.
Studies op ratten duiden op een hoge dodelijke dosis (LD50) voor Na2EDTA (dinatriumzout), variërend van 2,0 tot 2,2 gram per kilogram lichaamsgewicht.
Studies met Na2EDTA van 0,5% tot 5,0% in het dieet lieten geen significante bijwerkingen zien, behalve diarree en verminderde voedselinname bij de hoogste dosering. Trinatrium EDTA lijkt geen huidsensibiliserend middel te zijn.
Hoewel EDTA kan interacteren met genetisch materiaal, lijkt de relevantie ervan voor menselijke genotoxiciteit (het veroorzaken van genetische schade) minimaal. Studies naar Na3EDTA (trinatriumzout) hebben geen carcinogeniciteit aangetoond die verband houdt met de verbinding.
Referentie
- Ethylenediaminetetraacetic Acid and Related Chelating Agents; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a10_095.pub2