Sorbinsäure: Eigenschaften, Reaktionen, Herstellung und Verwendung
Was ist Sorbinsäure?
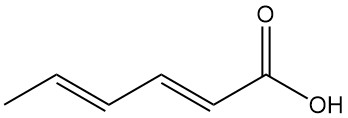
Das trans, trans-Isomer der 2,4-Hexadiensäure, allgemein bekannt als Sorbinsäure, ist eine kurzkettige ungesättigte Fettsäure mit der chemischen Formel C6H8O2. Es ist eine natürlich vorkommende organische Säure, die als farbloser Feststoff mit schwachem Geruch erscheint.
Der Name Sorbinsäure leitet sich von „Sorbus aucuparia Linnaeus“ ab, der wissenschaftlichen Bezeichnung der Eberesche. 1859 isolierte Hofmann durch Destillation aus unreifen Vogelbeeren ein Öl mit einem charakteristischen Geruch.
Der Hauptbestandteil dieses Öls war Parasorbinsäure, die als d-Lacton der Sorbinsäure identifiziert wurde. Starke Säuren oder Basen katalysieren die Umwandlung von Parasorbinsäure in isomere Sorbinsäure. Unreife Vogelbeeren enthalten etwa 0,1 % Parasorbinsäure.
Sorbinsäure kommt in den Fettablagerungen bestimmter Blattläuse als 2-Sorboyl-1,3-Dimyristin vor. Doebner stellte 1890 die Struktur der Sorbinsäure fest und sie wurde 1900 erstmals synthetisiert.
Müller (Deutschland) und Gooding (USA) entdeckten 1939–1940 unabhängig voneinander die antimikrobiellen Eigenschaften der Sorbinsäure. Die industrielle Produktion von Sorbinsäure und Kaliumsorbat begann in den 1950er Jahren, zunächst in den USA, später in Deutschland und Japan.
Sorbinsäure wird aufgrund ihrer Sicherheit und günstigen sensorischen Eigenschaften als primäres Lebensmittelkonservierungsmittel verwendet.
Inhaltsverzeichnis
1. Physikalische Eigenschaften von Sorbinsäure
Sorbinsäure bildet nadel- oder plattenförmige Kristalle mit einem milden, charakteristischen Geruch und einem leicht säuerlichen Geschmack. Ihre Löslichkeit in Wasser ist begrenzt und beträgt bei 20 °C, 50 °C und 100 °C jeweils 0,16 g, 0,58 g und 3,9 g pro 100 ml.
Die Löslichkeit von Sorbinsäure in wasserfreien niedermolekularen Alkoholen und wasserfreier Essigsäure beträgt etwa 11–12 g pro 100 ml. Flüssige Fette können 0,5–1 g Sorbinsäure pro 100 ml lösen.
Sorbinsäure ist in Wasserdampf unzersetzt flüchtig. Diese Eigenschaft wird für ihre analytische Isolierung aus Lebensmitteln genutzt.
Die wichtigen physikalischen Eigenschaften von Sorbinsäure sind in der folgenden Tabelle aufgeführt.
| Eigenschaft | Wert |
|---|---|
| CAS-Nummer | [110-44-1] |
| Formel | C6H8O2 |
| Molekularmasse | 112,13 g/mol |
| Schmelzpunkt | 132–135 °C |
| Siedepunkt | 228 °C (Zersetzung) |
| Sublimationstemperatur | über 60 °C |
| Brechungsindex | 1,4248 |
| Dichte | 1,204 g/cm3 |
| Dissoziationskonstante | 1,73×10-5 bei 25 °C |
| pKa | 4,76 |
| Dampfdruck bei 20 °C | <0,001 kPa |
| Dampfdruck bei 100 °C | 0,25 kPa |
| Dampfdruck bei 120 °C | 1,3 kPa |
2. Chemische Reaktionen von Sorbinsäure
Die Reaktivität von Sorbinsäure ist durch das Vorhandensein einer Carboxylgruppe und eines konjugierten Doppelbindungssystems gekennzeichnet.
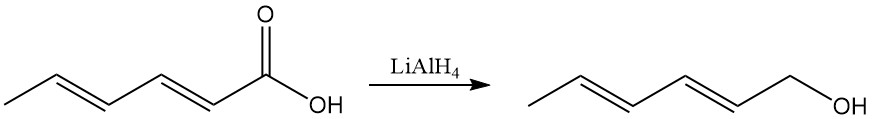
Zu den typischen Reaktionen von Carboxylsäuren gehören die Bildung von Salzen, Estern und anderen Derivaten. Lithiumaluminiumhydrid reduziert die Carboxylgruppe selektiv zu Sorbinsäurealkohol (2,4-Hexadien-1-ol).
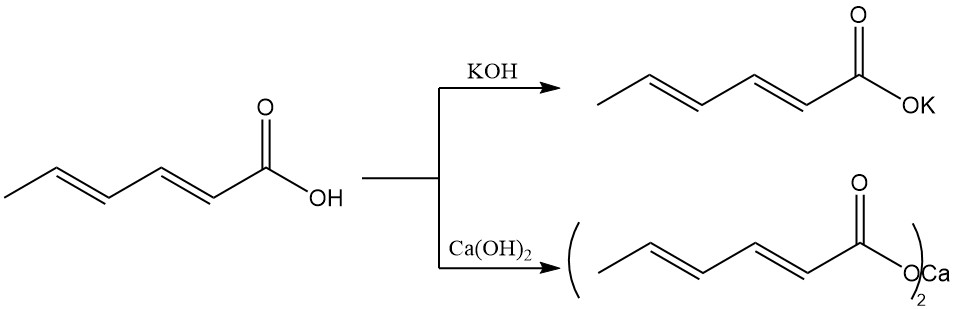
Im Gegensatz zu Sorbinsäure haben Alkalisalze eine höhere Wasserlöslichkeit und werden daher bevorzugt für wässrige Konservierungssysteme eingesetzt. Kaliumsorbat wird aus Sorbinsäure und Kaliumhydroxid hergestellt und ist gut wasserlöslich.
Calciumsorbat wird aus Sorbinsäure und Calciumhydroxid gebildet und zeichnet sich durch eine geringe Wasserlöslichkeit aus.
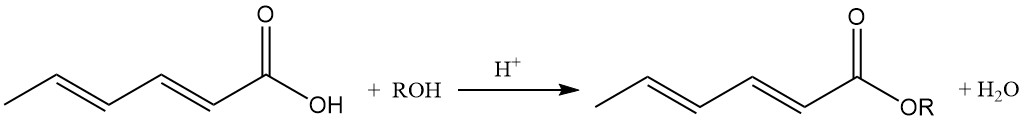
Niederalkylsorbatester besitzen antimikrobielle Eigenschaften und sind im Gegensatz zur Sorbinsäure in neutralen und schwach alkalischen Umgebungen aktiv.
Reaktionen mit Doppelbindungssystemen führen aufgrund unterschiedlicher Doppelbindungsreaktivitäten und möglicher Isomerisierungen, Umlagerungen, Migrationen und Polymerisationen häufig zu komplexen Produktgemischen.
Additionsreaktionen und partielle Hydrierung zielen bevorzugt auf die 4,5-Doppelbindung ab.
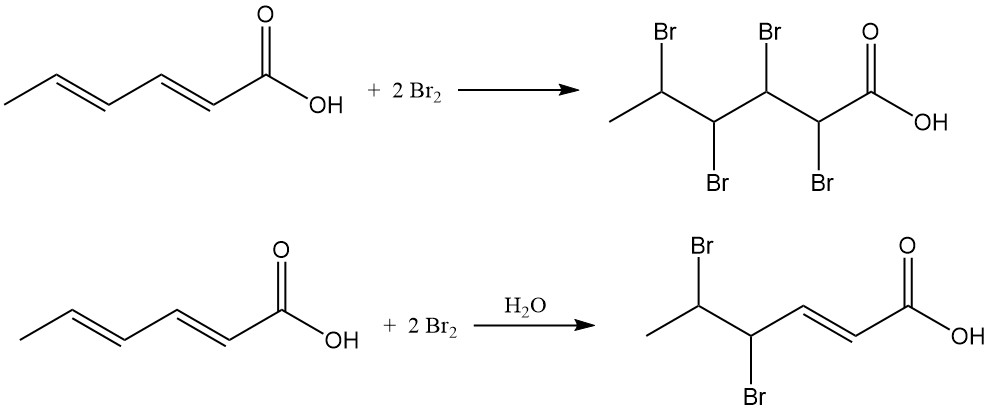
Chloraddition führt zu Chlorhexensäuregemischen mit einem durchschnittlichen Chlorgehalt von 38–48 Gew.-%. Die Reaktion von Brom mit Sorbinsäure in organischen Lösungsmitteln erzeugt 2,3,4,5-Tetrabromhexansäure, während wässrige Bromierung hauptsächlich 4,5-Dibrom-2-hexensäure ergibt.
Trotz ihrer doppelten Ungesättigtheit ist reine kristalline Sorbinsäure sehr widerstandsfähig gegen Luftoxidation und bleibt bei Raumtemperatur über Jahre stabil. Verunreinigungen wie Lösungsmittel, Schwermetalle oder isomere Hexadiensäuren verringern ihre Stabilität jedoch erheblich.
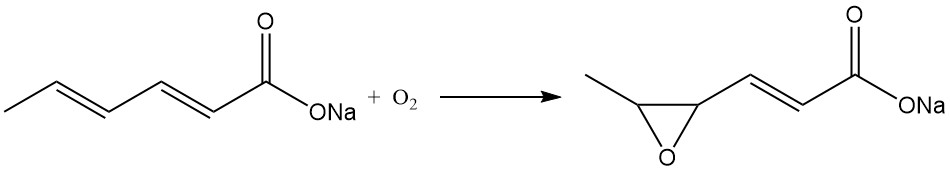
Ähnliche Überlegungen gelten für Kaliumsorbat, während Natriumsorbat in fester Form instabil ist und nicht kommerziell hergestellt wird. Natriumsorbat wandelt sich in Gegenwart von Luft schnell in das Natriumsalz der 4,5-Epoxy-2-hexensäure um.
Die Oxidation von wässrigen Sorbaten oder Sorbinsäure in organischen Lösungsmitteln erzeugt zahlreiche Carbonylverbindungen, obwohl diese Reaktion von der Anwesenheit einer großen Menge Sauerstoff abhängt und durch Sonneneinstrahlung stark verstärkt wird.
Sauerstofffreie Lösungen bleiben auch bei Lichteinwirkung stabil. Sorbinsäure in Lebensmitteln mit mittlerem Feuchtigkeitsgehalt zersetzt sich in Gegenwart von Luft über Monate hinweg allmählich.
Die Oxidation saurer wässriger Sorbinsäurelösungen mit Kaliumdichromat erzeugt Malonaldehyd. Die Reaktion von Malonaldehyd mit 2-Thiobarbitursäure erzeugt ein rotes, fluoreszierendes 1:2-Addukt (Malonaldehyd:2-Thiobarbitursäure), das als Farbindikator bei der Sorbinsäureanalyse verwendet wird.
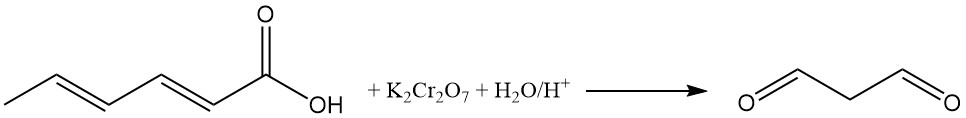
Wenn Sorbinsäure in Lebensmittel eingearbeitet wird, entspricht ihre Stabilität im Allgemeinen der von essentiellen Lebensmittelbestandteilen wie Vitaminen, Geschmacks- und Aromastoffen. Daher stellt das theoretische Autoxidationspotenzial von Sorbinsäure nur minimale praktische Herausforderungen für die Konservierung dar.
3. Herstellung von Sorbinsäure
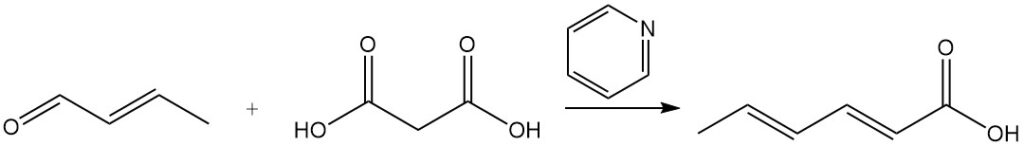
Sorbinsäure wurde ursprünglich nach dem Doebner-Verfahren synthetisiert, das eine Kondensationsreaktion zwischen Crotonaldehyd und Malonsäure in Pyridin beinhaltete. Während viele andere Synthesen ähnliche Prinzipien verwenden, sind die meisten aufgrund niedriger Erträge, teurer Ausgangsmaterialien oder hoher Produktionskosten kommerziell unpraktisch.
Dies gilt auch für ein Verfahren von Union Carbide aus den 1950er-1960er-Jahren, bei dem 2,4-Hexadienal mit Katalysatoren zu Sorbinsäure oxidiert wurde. Das Verfahren wurde jedoch aufgegeben, da bis zu 20 % isomere Hexadiensäuren entstanden, die weniger stabil als Sorbinsäure sind und aufwändig gereinigt werden müssen. Auch Mikroorganismen können 2,4-Hexadienal zu Sorbinsäure oxidieren.
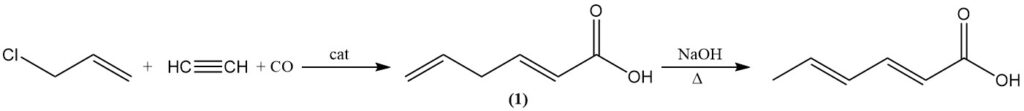
Alternativ kann Sorbinsäure auch durch Isomerisierung von 2,5-Hexadiensäure (1) durch Kochen mit wässriger Lauge hergestellt werden. 2,5-Hexadiensäure entsteht durch die Reaktion von Allylchlorid mit Acetylen, Kohlenmonoxid und Wasser unter Verwendung eines Tetracarbonylnickel-Katalysators.
Die saure Spaltung von 5-Vinyl-γ-butyrolacton, das aus 1,3-Butadien und Essigsäure mit Redoxkatalysatoren gewonnen wird, ist nicht von industrieller Bedeutung. Eine weitere mögliche Synthese ist die Addition von Kohlendioxid an 1,3-Pentadien in Gegenwart von Nickelkomplexen.
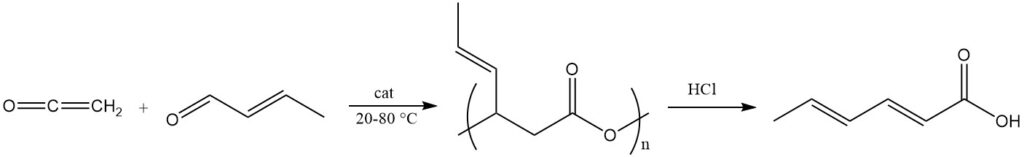
Ein gängiges Verfahren verwendet Keten und Crotonaldehyd in Gegenwart von zweiwertigen Übergangsmetallsalzen als Katalysatoren bei einer Temperatur von 20–80 °C, um einen polymeren Ester der 3-Hydroxy-4-hexensäure mit einer ungefähren Molekülmasse von 2000 zu erhalten.
Dieser Polyester wird durch Basen- oder Säurebehandlung (z. B. Salzsäure) oder Metallkomplexkatalysatoren gespalten, um Sorbinsäure zu erhalten. Dieser Polyester wird auch als Vorläufer für die Synthese von Sorbatestern durch Reaktionen mit Alkoholen in Gegenwart von sauren Veresterungskatalysatoren verwendet.
Rohe Sorbinsäure wird durch Umkristallisation aus einer wässrigen Lösung, Wasser-Alkohol- oder Aceton-Mischungen oder mit Wasser nicht mischbaren organischen Lösungsmitteln wie Methylacetat gereinigt. Auch die Behandlung mit organischen Lösungsmitteln und die Wasserdampfdestillation wurden beschrieben.
4. Verwendung von Sorbinsäure
Sorbinsäure und ihre Salze (hauptsächlich Kalium- und Calciumsorbate) werden aufgrund ihres geringen Toxizitätsprofils überwiegend als Konservierungsmittel verwendet. Sie wirken gegen Schimmel und Hefen. Die wichtigsten Anwendungsgebiete sind:
- Lebensmittel: Käse (verschiedene Sorten), Backwaren, Obstprodukte (Pflaumen, Fruchtmark, Marmeladen, Konfitüren, Säfte, Gelees und Bonbons), Wein, fermentiertes Gemüse, Margarine, Butter und Wurst
- Tierfutter
- Tabak
- Kosmetika
- Pharmazeutika
- Verpackungsmaterialien für Lebensmittel, Tierfutter, Kosmetika und Pharmazeutika
- Andere Produkte, die mit der Haut von Menschen oder Tieren in Berührung kommen
Es ist erwähnenswert, dass potenzielle Verwendungsmöglichkeiten von Sorbinsäure in chemischen Reaktionen und Polymerisationen zwar in der Patentliteratur untersucht wurden, diese Anwendungen jedoch aufgrund ihrer relativ hohen Kosten kommerziell unbedeutend bleiben.
Sorbinsäure kann auch als Zusatzstoff bei der Kaltgummiproduktion und als Zwischenprodukt im Herstellungsprozess bestimmter Weichmacher und Schmiermittel verwendet werden.
5. Toxikologie von Sorbinsäure
Sorbinsäure weist eine geringe akute Toxizität auf, mit einer LD50 von etwa 10 g/kg Körpergewicht bei Ratten. Studien berichten von ähnlichen Werten im Bereich von 7,4 bis 8,7 g/kg. Während Sorbinsäure aufgrund ihrer säurehaltigen Natur Schleimhäute reizen kann, sind Hautreizungen selten.
Aufgrund ihrer frühen Einführung als Lebensmittelkonservierungsmittel und der obligatorischen Testanforderungen wurden umfangreiche toxikologische Untersuchungen an Sorbinsäure durchgeführt. Akute, subakute, subchronische und chronische Studien zeigen durchweg ein hohes Sicherheitsprofil.
Sorbinsäure hat aufgrund ihrer geringen Molekülgröße ein geringes allergenes Potenzial, was die Antikörperbildung und kovalente Proteinbindung verhindert, die typischerweise mit sofortiger Überempfindlichkeit verbunden sind. Fälle von pseudoallergischen Reaktionen auf Sorbinsäure als Lebensmittelzusatzstoff sind selten.
Subchronische Studien an Ratten zeigen bei hohen Sorbinsäuredosen (10 % im Futter) erhöhtes Wachstum und Lebergewicht, was als Hypertrophie aufgrund erhöhter Stoffwechselarbeitslast und nicht als Toxizität interpretiert wurde.
Langzeit-Fütterungsstudien (zwei Jahre) an Ratten und Mäusen zeigen keine karzinogenen Wirkungen bei niedrigen Sorbinsäurekonzentrationen (1,5–10 % im Futter). Höhere Dosen (10 %) führen zu verringerter Gewichtszunahme und einer Vergrößerung von Schilddrüse, Leber und Nieren.
Sorbinsäure ist weder teratogen noch mutagen oder genotoxisch und nicht karzinogen.
Stoffwechselmäßig unterliegt Sorbinsäure einer β-Oxidation ähnlich wie andere Fettsäuren.
Sowohl Sorbinsäure als auch Kaliumsorbat weisen ein geringes allergenes und phototoxisches Potenzial auf. Trotz weit verbreiteter Verwendung seit über 40 Jahren wurde ein einziger Fall einer allergischen Reaktion vom Typ 4 gemeldet. Das Expertengremium der Cosmetic Ingredient Review (CIR) stuft beide Substanzen als „sicher“ für Kosmetika ein.
Natriumsorbat, das aufgrund seiner Oxidationsanfälligkeit nicht häufig in Lebensmitteln verwendet wird, weist im Gegensatz zu Sorbinsäure und Kaliumsorbat in vitro eine geringe genetische Toxizität auf.
Referenzen
- Sorbic Acid; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a24_507.pub2
- https://pubmed.ncbi.nlm.nih.gov/2079232/
