Dioxan: Eigenschaften, Reaktionen, Produktion und Verwendung
Dioxan oder 1,4-Dioxan ist ein heterozyklischer Diether mit der Formel C4H8O2. Es ist eine brennbare, farblose Flüssigkeit mit einem schwachen, süßlichen Geruch, ähnlich wie Diethylether. Es ist unter anderen Namen wie p-Dioxan, Diethylenoxid, Diethylendioxid, Diethylenether, 1,4-Dioxacyclohexan, Dioxyethylenether und Dioxan bekannt.
Dioxan wurde erstmals 1863 von A. V. Lourenço durch Reaktion von Ethylenglykol mit 1,2-Dibromethan hergestellt. Die kommerzielle Produktion erfolgte jedoch erst 1929.
Inhaltsverzeichnis
1. Physikalische Eigenschaften von Dioxan
Dioxan ist ein gutes Lösungsmittel mit außergewöhnlichen Eigenschaften. Es löst problemlos eine Vielzahl organischer Verbindungen, darunter aliphatische und aromatische Kohlenwasserstoffe, Ether, Alkohole, Ketone und chlorierte Kohlenwasserstoffe, insbesondere solche mit niedrigeren Molekulargewichten.
1,4-Dioxan ist in jedem Verhältnis mit Wasser mischbar und löst außerdem verschiedene anorganische Verbindungen und Elemente, darunter Eisenchloride, Quecksilberchlorid, Mineralsäuren (Salzsäure, Schwefelsäure und Phosphorsäure), Halogene (Brom, Chlor und Jod) sowie tierische und Pflanzenöle, Paraffinöle sowie synthetische und natürliche Harze.
Bei Raumtemperatur erscheint 1,4-Dioxan als klare Flüssigkeit mit ätherischem Geruch. Seine chemische Stabilität ist vergleichbar mit der anderer aliphatischer Ether. Ähnlich wie diese Ether bildet Dioxan an der Luft Peroxide.
Die wichtigsten physikalischen Eigenschaften von Dioxan sind in Tabelle 1 aufgeführt.
| Eigenschaft | Wert |
|---|---|
| Molekulargewicht | 88,11 g/mol |
| Siedepunkt | 101,3 °C |
| Gefrierpunkt | 11,8 °C |
| Dichte | 1,0356 g/cm3 |
| Latente Verdampfungswärme | 413 kJ/kg |
| Fusionswärme | 141 kJ/kg |
| Spezifische Wärme (20 °C) | 1,76 kJ kg-1 K-1 |
| Brechungsindex | 1.4224 |
| Dampfdruck (20 °C) | 4,13 kPa (41,3 mbar) |
| Dielektrizitätskonstante (20 °C) | 2.23 |
| Oberflächenspannung (20 °C) | 36,9 mN/m |
| Kritische Temperatur | 312 °C |
| Kritischer Druck | 5,14 MPa |
| Flammpunkt (geschlossener Tiegel) | 11 °C |
| Entzündungsgrenzen (in der Luft) |
Unterer Teil: 2 Vol. % Obermaterial: 22 Vol % |
| Verbrennungswärme | 27.600 kJ/kg |
| Selbstentzündungstemperatur | 180 °C |
Dioxan bildet mit vielen Lösungsmitteln azeotrope Gemische. Gängige Beispiele sind in Tabelle 2 aufgeführt.
| Komponente | Komponente bp, °C | Dioxan, Gew.-% | Azeotroper Siedepunkt, °C |
|---|---|---|---|
| Ameisensäure | 100,7 | 57 | 113,35 |
| Nitromethan | 100,8 | 43,5 | 100,55 |
| Essigsäure | 117,9 | 20,5 – 23 | 119,4 |
| Ethanol | 78,5 | 9.3 | 78,1 |
| 3-Iod-1-propen | 103 | 44 | 98,5 |
| 1-Propanol | 97,4 | 45 | 95,3 |
| tert-Amylalkohol | 102,5* | 20 | 100,65 |
| Cyclohexan | 80,7 | 24,6 | 79,5 |
| Heptan | 98,4 | 44 | 91,85 |
| Wasser | 100 | 82 | 87,8 |
| * Bei 8 kPa | |||
2. Chemische Reaktionen von Dioxan
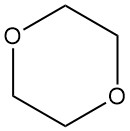
Ähnlich wie andere Ether bildet Dioxan an der Luft leicht Peroxide. Diese Peroxide sind oft hochexplosiv und instabil. Das gebildete primäre Peroxid ist 2-Hydroperoxy-1,4-dioxan (1), das sich zu Dioxanon (2) und Wasser zersetzt.
Die anschließende Hydrolyse führt zur Bildung von 2-(2-Hydroxyethoxy)essigsäure (3). Glücklicherweise begünstigt der Reaktionsweg die Bildung des Endprodukts und begrenzt die Peroxidkonzentration.
Dennoch erfordert der Umgang mit Dioxan die gleichen Vorsichtsmaßnahmen wie bei anderen Ethern, um die Bildung von Peroxiden zu verhindern. Das Durchblasen von Inertgas, typischerweise mit Stickstoff, wird empfohlen. Außerdem sollten Peroxide niemals konzentriert oder bis zur Trockne destilliert werden.
Etablierte Methoden zu ihrer Entfernung nutzen Reduktionsmittel wie Eisen(II)- oder Zinn(II)-chloride, Natriumbisulfit oder adsorbierende Materialien wie Aktivkohle, Aluminiumoxid oder Anionenaustauscherharze.
1,4-Dioxan ist in der Lage, sich mit verschiedenen Halogenen (Cl2, Br2, und I2) und Halogensäuren zu lösen und Komplexe zu bilden. Diese Komplexe können die Reaktivität der Halogene oder Halogensäuren während Reaktionen abschwächen. Beispielsweise kann der Dioxan-Dibromid-Komplex zur kontrollierten Bromierung von Phenolen, aromatischen Aldehyden/Aminen und Ketonen verwendet werden.
Durch die Chlorierung von Dioxan können chlorierte Derivate mit 1 bis 8 Chloratomen entstehen. Die spezifische Isomerenverteilung hängt von den verwendeten Reaktionsbedingungen (Temperatur, Katalysatoren) ab.
Dioxane mit weniger Chloratomen werden als Vorläufer für Additionsverbindungen wie Ethoxy- oder Ethylgruppen unter Verwendung geeigneter Reagenzien wie NaOCH2CH3 bzw. CH3CH2MgBr verwendet.
2,3-Dichlor-1,4-dioxan ist hochreaktiv und kondensiert leicht mit anderen funktionellen Gruppen wie Carbonsäuren, Alkoholen und Glykolen, um die entsprechenden Diester und Ether zu bilden.
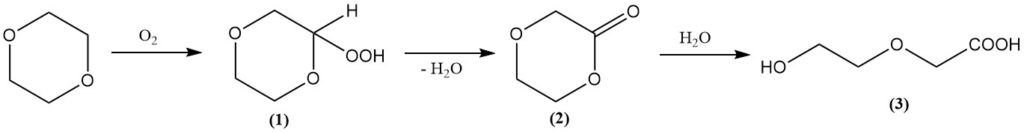
Während der Dioxanring stabil ist, können ihn starke Säuren bei erhöhter Temperatur und erhöhtem Druck spalten. Unter solchen Bedingungen ergeben Reaktionen mit Essigsäureanhydrid Ethylenglykoldiacetat und Diethylenglykoldiacetat.
Dioxan kann durch Wasserstoffperoxid bei 25 °C unter Verwendung von FeSO4 als Katalysator zersetzt werden.
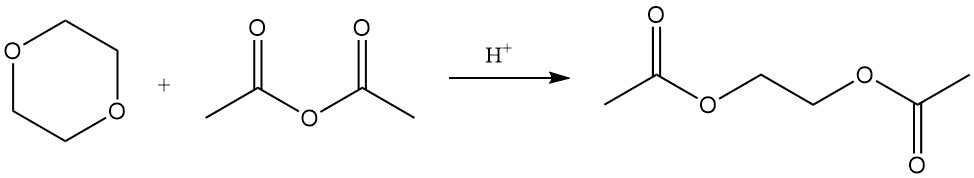
Lewis-Säure-katalysierte Reaktionen von 1,4-Dioxan mit Benzoylchlorid oder Acetylchlorid erzeugen die 2-Chlorethylester von Benzoesäure bzw. Essigsäure.
Unter Verwendung von Benzoylperoxid als Katalysator reagiert Dioxan mit α-Olefinen bei einer Temperatur von 80–140 °C für 5–10 Stunden und erzeugt eine Vielzahl von Polymeren, die als Schmiermittel verwendet werden.
Ähnliche Reaktionen können mit Tetrafluorethylen auftreten, wo Peroxid-katalysierte Reaktionen bei hohen Temperaturen und hohem Druck zu analogen Polymeren führen.
Für diese Polymerisationen wurden zahlreiche alternative Katalysatoren beschrieben, darunter Peroxide (organisch und anorganisch), Basen (Borax, Dinatriumphosphat, Hydrazin) und Lewis-Säuren (Zinkchlorid, Phosphorsäure).
Anders als Halogene bildet 1,4-Dioxan Komplexe mit verschiedenen funktionellen Gruppen, wie AlBr3, AlCl3, AuCl3, BBr3, BCl3, BF3, CuCl2, CoCl2, FeCl3, HgCl2, LiBr, LiCl, LiI, ZnCl2, PtCl4, HCl, H2SO4, H3PO4, SO2, SO3 und Trinitrophenol.
Diese Komplexe werden als Katalysatoren, Moderatormittel bei Reaktionen wie Bromierung oder Sulfonierung oder als Reaktionsmedien für wasserfreie Säuresysteme verwendet.
3. Herstellung von Dioxan
Dioxan wird hauptsächlich durch einen geschlossenen Kreislauf hergestellt, der die Dehydratisierung und den anschließenden Ringschluss von Diethylenglykol umfasst. Als Katalysator für diese Reaktion wird konzentrierte Schwefelsäure (ca. 5 %) verwendet. Es können jedoch auch alternative Katalysatoren wie Phosphorsäure, p-Toluolsulfonsäure und stark saure Ionenaustauscherharze eingesetzt werden.
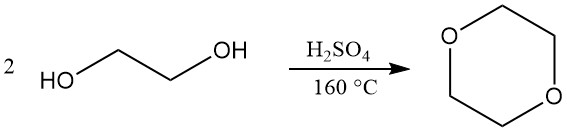
Die Betriebsbedingungen für diesen Prozess können variieren. Die Reaktionstemperaturen liegen typischerweise zwischen 130 und 200 °C, während der Druck von leicht über Atmosphärendruck bis zu einem Teilvakuum (25–110 kPa) variieren kann. Eine Reaktionstemperatur von 160 °C wird oft als optimal angesehen.
Der Reaktionsaufbau ermöglicht eine kontinuierliche Produktion, wobei das gebildete Dioxan direkt aus dem Reaktionsgefäß verdampft wird. Diese Dämpfe werden dann durch eine Säurefalle und eine Reihe von Destillationskolonnen geleitet, um Wasser zu entfernen und das Endprodukt zu reinigen. Es sind Ausbeuten von ca. 90 % erreichbar.
Es ist wichtig zu beachten, dass bei diesem Prozess unerwünschte Nebenprodukte wie 2-Methyl-1,3-dioxolan entstehen, Acetaldehyd, Crotonaldehyd und Polyglykol.
Während die Dehydratisierung von Diethylenglykol der vorherrschende kommerzielle Weg ist, gibt es andere Methoden zur Synthese von 1,4-Dioxan. Zu diesen weniger gebräuchlichen Methoden gehören:
- Dehydrohalogenierung von 2-Chlor-2′-hydroxyethylether
- Reaktion von Ethylenglykol mit 1,2-Dibromethan
- Dimerisierung von Ethylenoxid mit Katalysatoren wie NaHSO4, SiF4 oder BF3, oder durch Hochtemperaturreaktionen mit sauren Kationenaustauscherharzen
4. Verwendung von Dioxan
Die wichtigste industrielle Anwendung von 1,4-Dioxan ist die Stabilisierung von 1,1,1-Trichlorethan gegen Reaktion mit Aluminium. Auf der Metalloberfläche bildet sich ein Aluminiumoxidfilm, der den direkten Kontakt mit 1,1,1-Trichlorethan verhindert.
Wenn diese Schutzschicht jedoch gestört wird, reagiert 1,1,1-Trichlorethan mit dem freiliegenden Aluminium, extrahiert Chlor und bildet Aluminiumchlorid, das dann die Dehydrohalogenierung von 1,1,1-Trichlorethan fördert, um Salzsäure und Vinylidenchlorid zu erzeugen.
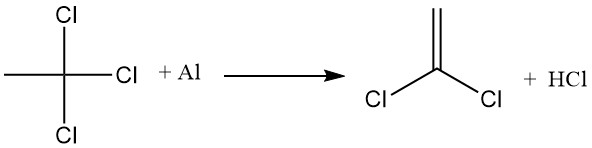
1,4-Dioxan hemmt diese Reaktionen, indem es einen unlöslichen Komplex zwischen Dioxan und Aluminiumchlorid bildet. Dieser Komplex deaktiviert den AlCl3-Katalysator und versiegelt alle Öffnungen im Aluminiumoxidfilm, wodurch ein direkter Kontakt zwischen dem Metall und 1,1,1-Trichlorethan verhindert wird.
Dioxan wird als Netz- und Dispergiermittel in Textilverarbeitungs-, Färbebädern, Färbe- und Druckzusammensetzungen eingesetzt. Darüber hinaus hilft es bei der Vorbereitung histologischer Objektträger.
Dioxan wird in anderen Bereichen eingesetzt, darunter:
- Lösungsmittel: Es wird als Lösungsmittel bei der Formulierung von Tinten, Beschichtungen, Klebstoffen, Szintillationszählern und zur Extraktion tierischer und pflanzlicher Öle verwendet.
- Chemisches Zwischenprodukt: Aus Dioxan gewonnene Produkte sind als Insektizide, Herbizide, Weichmacher und Monomere wertvoll.
- Katalyse und Reagenzien: Von Dioxan mit Salzen, Mineralsäuren, Halogenen und Schwefeltrioxid gebildete Oxoniumkomplexe fungieren als Katalysatoren und Reagenzien bei wasserfreien Säurereaktionen, Bromierungen und Sulfonierungen.
- Laboranwendungen: In Laboratorien wird 1,4-Dioxan als kryoskopisches Lösungsmittel zur Bestimmung von Molekülmassen verwendet und ist aufgrund seiner Stabilität ein geeignetes Reaktionsmedium für verschiedene chemische Umwandlungen.
- Traditionell wurde Dioxan bei der Polymerherstellung und als Lösungsmittel für natürliche und synthetische Harze verwendet, darunter Cellulosederivate, Polyvinylacetalharze und Acrylnitril-Methylvinylpyridin-Copolymere.
5. Toxikologie von Dioxan
Dioxan hat eine relativ geringe akute Toxizität. Die oralen und dermalen LD50-Werte bei Ratten und Kaninchen betragen 5170 mg/kg bzw. 7600 mg/kg. Eine 4-stündige inhalative Exposition bei 14.260 ppm (51.880 mg/m³) ist für 50 % der exponierten Rattenpopulation tödlich (LC50).
Arbeitsplatzgrenzwerte:
- Grenzwert der American Conference of Governmental Industrial Hygienists (ACGIH) – Zeitgewichteter Durchschnitt (TLV-TWA): 25 ppm (90 mg/m³) mit der Bezeichnung „Haut“.
- US-amerikanische Arbeitsschutzbehörde (OSHA): 100 ppm (360 mg/m³)
- Deutsche Forschungsgemeinschaft (MAK): >50 ppm (180 mg/m³) mit IIIB-Kennzeichnung (verdächtig krebserregend)
Maßnahmen zur Expositionskontrolle
Da bei hohen Konzentrationen Haut- und Augenreizungen sowie Schäden an den Atemwegen auftreten können, sollten Arbeitsplätze, an denen 1,4-Dioxan verwendet wird, Kontrollmaßnahmen ergreifen, um die Exposition der Arbeitnehmer zu minimieren. Dazu gehören technische Kontrollen zur Minimierung der Dampfkonzentration in der Luft und bei Bedarf die Verwendung persönlicher Schutzausrüstung wie Handschuhe, Augenschutz und Atemschutzmasken.
Karzinogenität
Frühe Tierversuche mit hohen oralen Dosen Dioxan (7–18.000 mg/kg) führten zu Nasen- und Lebertumoren. Nachfolgende Studien mit niedrigeren Dosen (1000 mg/kg und weniger) zeigten jedoch keine Tumorbildung, was auf einen möglichen Schwelleneffekt hindeutet. Darüber hinaus ergaben Mutagenitätstests keine direkten Wechselwirkungen von Dioxan mit DNA.
Diese Ergebnisse legen nahe, dass Tumore bei Nagetieren eher durch wiederholte Gewebeschäden als durch direkte Genotoxizität entstehen können.
Stoffwechsel und Ausscheidung
Studien mit radioaktiv markiertem Dioxan zeigen, dass niedrige Dosen schnell in 2-Hydroxyethoxyessigsäure umgewandelt und im Urin ausgeschieden werden. Dieser Umwandlungsprozess wird bei hohen Dosen weniger effizient, was zu einer langsameren Ausscheidung führt.
Risikobewertung von menschlicher Exposition und Karzinogenität
Zwischenfälle mit der Exposition von Menschen bei geschätzten Konzentrationen von 470 ppm Dioxan haben zu Todesfällen geführt. Epidemiologische Studien an Arbeitern, die Konzentrationen von bis zu 51 ppm ausgesetzt waren, haben jedoch keine gesundheitsschädlichen Auswirkungen gezeigt.
Die potenzielle Karzinogenität von 1,4-Dioxan hat verschiedene internationale Regulierungsbehörden dazu veranlasst, Richtlinien für seine Präsenz im Trinkwasser und in der Umwelt festzulegen.
Die Internationale Agentur für Krebsforschung (IARC) stuft 1,4-Dioxan als Karzinogen der Gruppe 2B (wahrscheinlich Karzinogen für den Menschen) ein, basierend auf Tierstudien, die eine erhöhte Inzidenz von Nasenhöhlen-, Leber- und Gallenblasenkarzinomen bei Ratten, Mäusen und Meerschweinchen zeigen , jeweils.
Dioxan im Trinkwasser
Die Weltgesundheitsorganisation (WHO) empfiehlt einen Richtwert von 50 μg/L für 1,4-Dioxan im Trinkwasser.
Die US-Umweltschutzbehörde (EPA) und das National Center for Environmental Assessment haben einen gesundheitsbezogenen Richtwert von 3 μg/L im Trinkwasser vorgeschlagen.
Das integrierte Risikoinformationssystem der EPA geht von einem potenziellen Krebsrisiko von 1 zu 1.000.000 bei einer lebenslangen Exposition von 0,35 μg/L aus. Folglich legt die Unregulierte Kontaminantenüberwachungsregel (UCMR3) einen Mindestmeldewert von 0,07 μg/L fest.
Das deutsche Umweltbundesamt empfiehlt einen vorsorglichen Richtwert von 0,1 μg/L für nicht genotoxische Karzinogene wie 1,4-Dioxan im Trinkwasser.
Japan hat einen Umweltstandard von 50 μg/L für 1,4-Dioxan festgelegt.
In den Vereinigten Staaten haben mehrere Einzelstaaten ihre eigenen Grenzwerte für 1,4-Dioxan im Trinkwasser festgelegt, was einen Flickenteppich an Vorschriften im ganzen Land widerspiegelt.
Verweise
- Dioxane; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a08_545.pub2
- 1,4-Dioxane; https://onlinelibrary.wiley.com/doi/10.1002/9781119407621.ch4
