Bernsteinsäure: Eigenschaften, Herstellung und Verwendung
Was ist Bernsteinsäure?
Bernsteinsäure, auch bekannt als Butandisäure, ist eine Dicarbonsäure mit der chemischen Formel C4H6O4. Es ist ein farbloser kristalliner Feststoff, der in Bernstein, in zahlreichen Pflanzen (z. B. Algen, Flechten, Rhabarber und Tomaten) und in vielen Braunkohlen vorkommt.
Inhaltsverzeichnis
1. Physikalische Eigenschaften von Bernsteinsäure
Bernsteinsäure ist ein farbloser, kristalliner Feststoff mit einem sehr sauren Geschmack. Sie ist wasserlöslich; ihre Löslichkeit nimmt mit der Temperatur zu; sie ist leicht löslich in Ethanol, Ether, Aceton und Glycerin; und sie ist unlöslich in Benzol, Kohlenstoffdisulfid und Kohlenstofftetrachlorid.
Eine wässrige Lösung von Bernsteinsäure mit einer Konzentration von 0,1 M hat einen pH-Wert von 2,7.
Die physikalischen Eigenschaften von Bernsteinsäure sind in der folgenden Tabelle aufgeführt.
| Eigenschaft | Wert |
|---|---|
| CAS-Nummer | [110-15-6] |
| Formel | HOOC-(CH2)2-COOH |
| Molekularmasse | 118,08 g/mol |
| Schmelzpunkt | 188 °C |
| Siedepunkt | 235 °C |
| Dichte | 1,57 g/cm3 |
| Brechungsindex | 1,450 |
| Decarboxylierungstemperatur | 290-310 °C |
| pKa1 bei 25 °C | 4,21 |
| pKa2 bei 25 °C | 5,64 |
| Verbrennungswärme | -356,32 Kcal/mol |
| Flammpunkt | 160 °C (offener Tiegel) |
2. Reaktionen der Bernsteinsäure
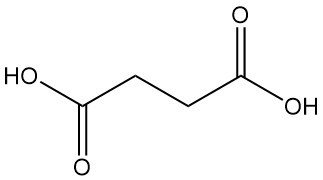
Bernsteinsäure ist eine Dicarbonsäure und unterliegt einer Reihe von Reaktionen, die für Carbonsäuren charakteristisch sind. Beim Erhitzen wird Bernsteinsäure in ein zyklisches Anhydrid umgewandelt.
Es kann mit Basen sowohl Mono- als auch Disalze bilden. So kann beispielsweise die Reaktion mit Natriumhydroxid Natriumhydrogensuccinat oder Natriumsuccinat ergeben.
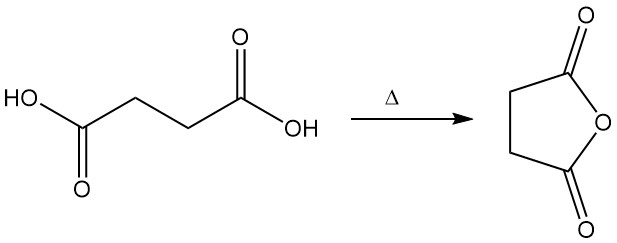
Wenn das Ammoniumsalz der Bernsteinsäure schnell destilliert wird, entsteht Succinimid unter Freisetzung von Wasser und Ammoniak.
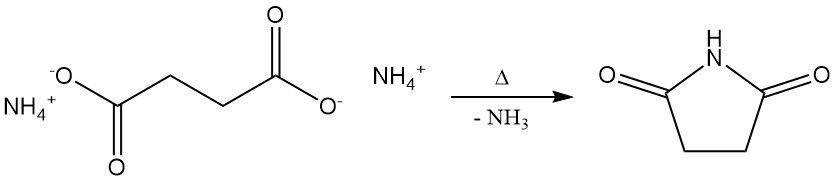
Bernsteinsäure reagiert mit Dialkoholen zu Polyestern und mit Diaminen zu Polyamiden. Die Reaktion mit Monoalkoholen ergibt Bernsteinsäureester. Alle diese Reaktionen sind kommerziell wichtig.
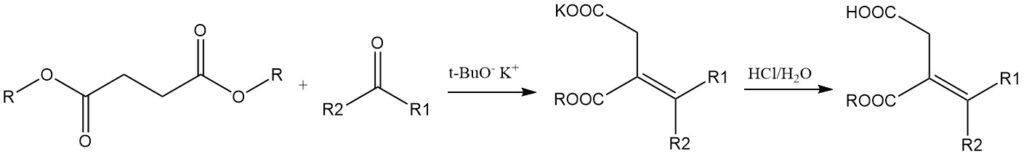
Bernsteinsäureester reagieren mit Aldehyden oder Ketonen in Gegenwart von Natriumethoxid oder Kalium-tert-butoxid zu Alkylidenbernsteinsäuremonoestern (Stobbe-Kondensation), die anschließend durch Hydrolyse, Decarboxylierung und Hydrierung in Monocarbonsäuren umgewandelt werden können.
Bernsteinsäure kann mit Reduktionsmitteln wie Lithiumaluminiumhydrid zu 1,4-Butandiol reduziert werden.
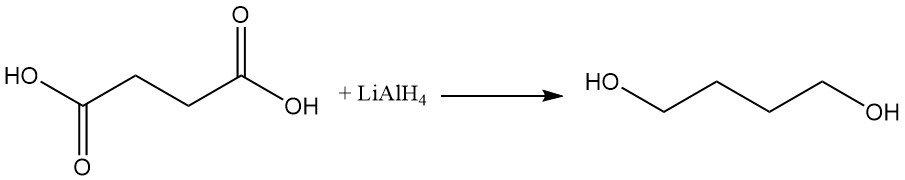
Durch Erhitzen auf Temperaturen über 310 °C kann Bernsteinsäure decarboxyliert werden, wobei Propionsäure und Kohlendioxid entstehen.
3. Herstellung von Bernsteinsäure
Bernsteinsäure wird auf verschiedenen synthetischen Wegen hergestellt.
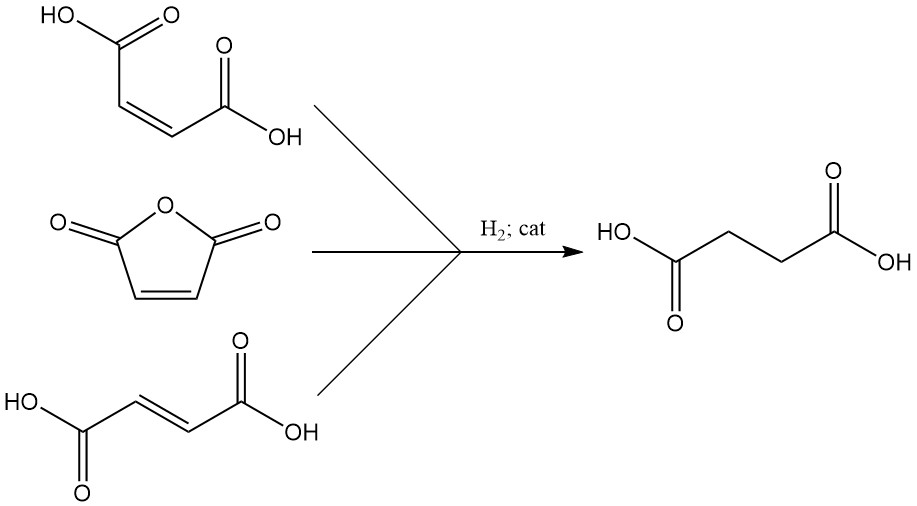
Durch Hydrierung ungesättigter Vorläufer wie Maleinsäure, Maleinsäureanhydrid oder Fumarsäure wird Bernsteinsäure effizient gewonnen. Katalysatoren für diesen Prozess sind üblicherweise Raney-Nickel, Kupfer, Nickeloxid, Kupfer-Zink-Chrom, Palladium-Aluminiumoxid, Palladium-Calciumcarbonat oder Nickel-Diatomeensalz.
Alternativ wird Bernsteinsäure durch Oxidation von 1,4-Butandiol hergestellt. Oxidationsmittel sind Sauerstoff in Erdalkalihydroxidlösung mit Palladium-Kohlenstoff-Katalysator bei 90–110 °C, Ozon in wässriger Essigsäure oder Stickstofftetroxid bei niedriger Temperatur.
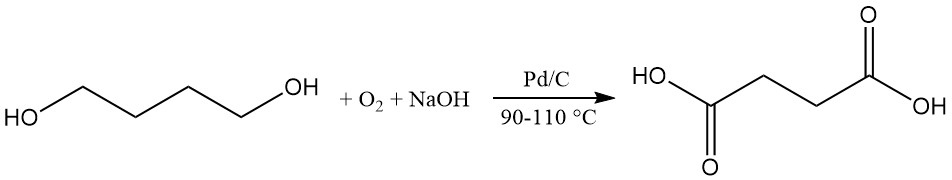
Auch die Reppe-Carbonylierung von Ethylenglykol, katalysiert durch Rhodiumtrichlorid-Pentachlorthiophenol, oder die Palladium-katalysierte Methoxycarbonylierung von Ethylen führen zu Bernsteinsäure oder ihren Estern. Weitere Carbonylierungsprozesse unter Verwendung von Acetylen, Acrylsäure, Dioxan oder β-Propiolacton führen zu ähnlichen Ergebnissen.
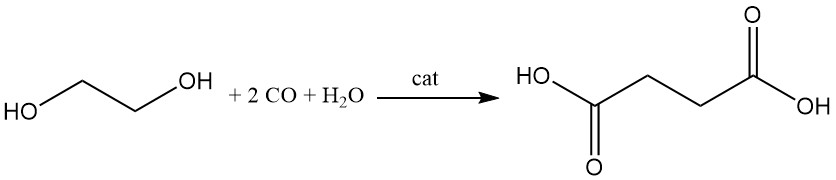
Bernsteinsäure ist ein Nebenprodukt bestimmter Oxidationsprozesse, wie beispielsweise der Herstellung von Adipinsäure, der Oxidation von Önanthsäure und der Ozonolyse von Palmitinsäure.
Auch eine biobasierte Produktion von Bernsteinsäure ist möglich. BioAmber hat einen Fermentationsprozess unter Verwendung von Glucose aus der Hydrolyse von Weizenstärke kommerzialisiert. Das Unternehmen betreibt eine Anlage mit einer Kapazität von 2000 Tonnen pro Jahr in Frankreich und plant eine weitere in Kanada.
Andere synthetische Wege zur Herstellung von Bernsteinsäure umfassen phasentransferkatalysierte Reaktionen von 2-Halogenacetaten, die elektrolytische Dimerisierung von Bromessigsäure oder deren Ester, die Oxidation von 3-Cyanopropanal und die Fermentation von n-Alkanen.
4. Verwendung von Bernsteinsäure
Bernsteinsäure wird als Rohstoff bei der Herstellung von Alkydharzen, Farbstoffen, Arzneimitteln und Pestiziden verwendet.
Es wird auch bei der Synthese von Polyestern durch Reaktion mit Glykolen verwendet, und Ester, die durch Reaktion mit Monoalkoholen gebildet werden, sind wichtige Weichmacher und Schmiermittel.
Bernsteinsäure wird in der Lebensmittel- und Getränkeindustrie als Säureregulator und Geschmacksverstärker verwendet und in der Pharmazie als Hilfsstoff und Wirkstoff in einigen Medikamenten wie Metoprololsuccinat, Sumatriptansuccinat und Doxylaminsuccinat.
5. Toxikologie der Bernsteinsäure
Bernsteinsäure weist eine geringe akute Toxizität auf. Sie kann Haut, Augen und Lungen reizen. Bei Verschlucken kann sie schädlich sein. Die akute orale Toxizität bei Ratten (LD50) betrug 2260 mg/kg
Die orale LD50 wird mit >6740 mg/kg Körpergewicht bestimmt, extrapoliert aus Mononatriumsuccinat-Daten. Die dermale LD50 wird als identisch mit der oralen LD50 angenommen, was konservativen Schätzpraktiken entspricht.
Die LC50 bei Inhalation wird auf Grundlage von Fumarsäure-Read-Across- und Partikelgrößenüberlegungen mit >1284 mg/m³ Luft berechnet.
Fumarsäure und Bernsteinsäure weisen strukturelle Ähnlichkeiten auf, da beide natürlich vorkommende Zwischenprodukte des Zitronensäurezyklus sind. Die physikochemischen Eigenschaften und Toxizitätsprofile sind vergleichbar. Die Derek-Analyse, ein Tool zur Toxizitätsvorhersage, zeigt für keine der beiden Verbindungen Toxizitätswarnungen.
Angesichts der hohen LD50-Werte bei oraler und dermaler Exposition und der geschätzten LC50, die die maximal mögliche Konzentration überschreitet, ist keine Einstufung gerechtfertigt.
Referenzen
- Dicarboxylic Acids, Aliphatic; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a08_523.pub3
- https://pubchem.ncbi.nlm.nih.gov/compound/Succinic-Acid
- https://echa.europa.eu/registration-dossier/-/registered-dossier/15265/7/3/1
- https://www.flinnsci.com/sds_788-succinic-acid/sds_788/
