2-Chlorethanol

2-Chlorethanol, auch bekannt als Ethylenchlorhydrin, ist eine organische chemische Verbindung mit der Formel HOCH2CH2Cl. Es handelt sich um eine farblose Flüssigkeit mit angenehmem Geruch, die früher ein wichtiges Zwischenprodukt zur Herstellung von Ethylenoxid war, aber das ist nicht mehr der Fall.
Inhaltsverzeichnis
1. Physikalische Eigenschaften von 2-Chlorethanol
Verdünnte Lösungen von 2-Chlorethanol in Wasser haben einen etwas süßlichen, angenehmen Geruch. Es ist eine brennbare Flüssigkeit, die mit Wasser ein Azeotrop bilden kann, das bei 97,8 siedet und 42 Gew. % H2O enthält. Ethylenchlorhydrin ist mischbar mit Wasser, Ethanol, Aceton und Benzol.
Die allgemeinen physikalischen Eigenschaften von 2-Chlorethanol sind in Tabelle 1 aufgeführt.
| Eigenschaft | Wert |
|---|---|
| CAS-Registrierungsnummer | [107-07-3] |
| Molekulargewicht | 80,52 g/mol |
| Schmelzpunkt (mp) | -69 °C |
| Siedepunkt (BP) | 129 °C |
| Dichte bei 20 °C | 1,2133 g/ml |
| Brechungsindex | 1,44 |
| Viskosität (η) | 3,43 mPa.s |
| Dampfdruck | 700 Pa (bei 20 °C) |
| Flammpunkt | 57 °C |
| Selbstentzündungstemperatur | 425 °C |
| Explosionsgrenze | 5–16 % |
2. Chemische Reaktionen von 2-Chlorethanol
2-Chlorethanol unterliegt Reaktionen, die sowohl für Alkohole als auch für Alkylchloride charakteristisch sind. Die häufigste Reaktion von 2-Chlorethanol ist die Dehydrochlorierung zur Bildung von Ethylenoxid, das industriell genutzt wurde, aber aufgrund alternativer Methoden an Bedeutung verlor.
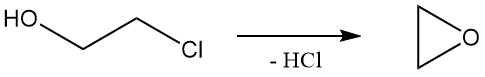
Die relative Solvolysegeschwindigkeit von Ethylenchlorhydrin in Wasser bei 97 °C beträgt 1,0.
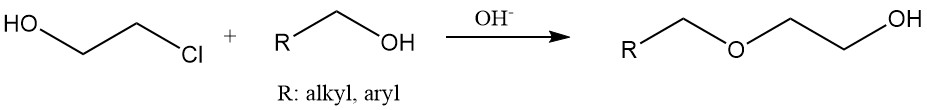
Hydroxyethylether werden durch Reaktion von 2-Chlorethanol mit Alkoholen oder Phenolen unter basischen Bedingungen hergestellt. Hydroxyethylcellulose und modifizierte Stärke werden durch Behandlung dieser Materialien mit Ethylenchlorhydrin hergestellt.
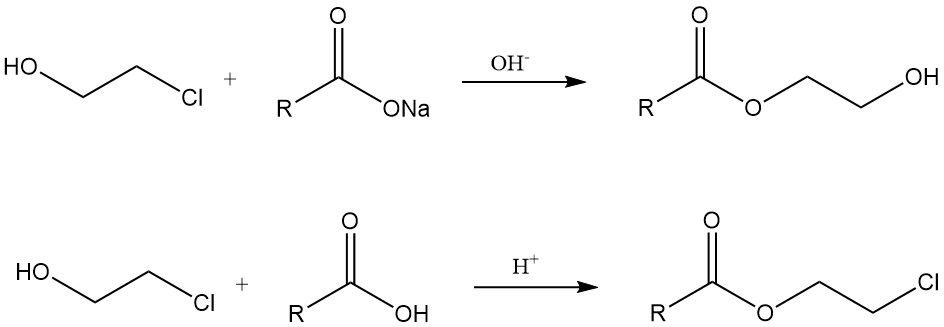
Chlorhydrine reagieren mit Metallcarboxylaten in Gegenwart einer Base zu Hydroxyethylestern. Andererseits entstehen β-Chlorester durch Reaktionen mit Carbonsäuren unter sauren Bedingungen oder aus Säurechloriden.
Zyklisches Carbonat kann durch die Reaktion von 2-Chlorethanol mit Kohlendioxid in Gegenwart eines Amins hergestellt werden.
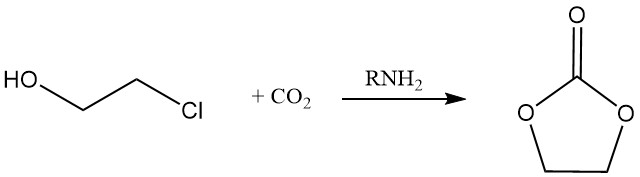
Ein Vergleich der Reaktionsgeschwindigkeit von Ethylenchlorhydrin mit verschiedenen Aminen ergibt die folgende Reihenfolge: n-Amylamin > Cyclohexylamin > Anilin. Die Reaktion von Ethylenchlorhydrin mit Ammoniak ergibt Monoethanolamin. Quartäre Ammoniumverbindungen entstehen aus Ethylenchlorhydrin und tertiären Aminen.
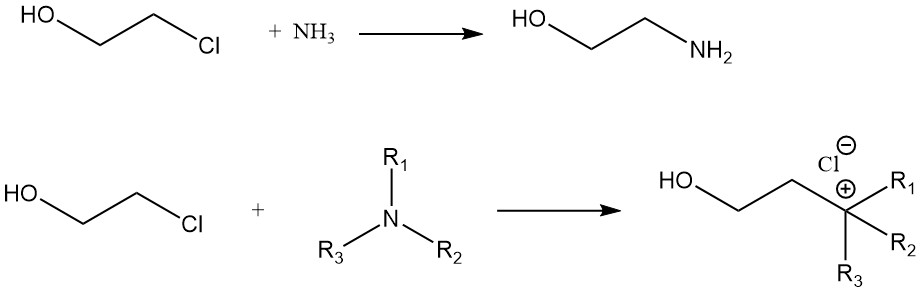
Weitere 2-Chlorethanol-Reaktionen umfassen die Bildung von Nitrilen aus Cyaniden, Acetalen aus Aldehyden, Oxazolidinonen aus Cyanaten und die Oxidation von Ethylenchlorhydrin zu Monochloressigsäure.
Bei der Reaktion von 2-Chlorethanol mit Phosgen entsteht 2-Chlorethylchlorformiat.
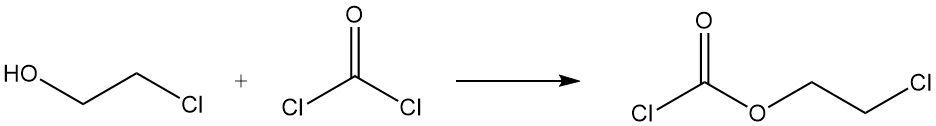
3. Herstellung von 2-Chlorethanol
Bereits 1904 stellte die BASF 2-Chlorethanol durch die Reaktion von Ethylen und CO2 in einer wässrigen Bleichpulverlösung her.
Heutzutage wird 2-Chlorethanol durch Hypochlorierung von Ethylen mit hypochloriger Säure hergestellt, die durch die reversible Reaktion von Chlor und Wasser entsteht, was zu einer begrenzten Effizienz führt.
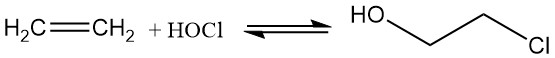
Cl2 + H2O ⇌ HOCl + HCl ; K = 4.2 x 10-4
Die Reaktion zwischen Ethylen und hypochloriger Säure ist schneller als die Reaktion von Ethylen und Chlor unter Bildung von Dichlorethan, sodass bei der Zugabe von Ethylen zum wässrigen System bevorzugt Chlorhydrin entsteht.
Bei gutem Rühren in der Gasphase entsteht eine minimale Menge Dichlorethan, wenn die 2-Chlorethanol-Konzentration 6–8 % nicht überschreitet. Allerdings verringert eine steigende HCl-Konzentration das verfügbare HOCl, was zu einer erheblichen Dichlorethanbildung führt, wenn die HCl-Konzentration mehr als 3 % beträgt.
Aufgrund der geringen Wasserlöslichkeit von Dichlorethan (0,869 g/100 ml bei 20 °C) bildet es eine separate Phase, in der sowohl Chlor als auch Ethylen zur weiteren Bildung von Dichlorethan gelöst werden.
Laborstudien und Reaktoroptimierung
In einer Laborstudie wurden Hypochlorierungsparameter mithilfe von Einzelsäulen- und Umlaufreaktoraufbauten untersucht. Die Ergebnisse zeigen, dass Temperaturen von 35–50 °C und ein 50 %iger Ethylenüberschuss für eine effiziente Dichlorethan-Strippung bevorzugt wurden.
Bei kontinuierlichem Betrieb bei einer Ethylen-Chlorhydrin-Konzentration von 6,4 %, einer Temperatur von 35 °C, einem Ethylen:Chlor-Verhältnis von 1,42 und einer Chlorbeschickung von 71 g/h wurde eine Ausbeute von 88 % an 2-Chlorethanol erreicht.
Die Herstellung von 2-Chlorethanol für Ethylenoxid wurde durch die direkte Ethylenoxidation mit Silberkatalysatoren ersetzt. Propylenoxid und Epichlorhydrin werden jedoch immer noch durch direkte Oxidation des Ausgangsolefins hergestellt.
Bei der industriellen Produktion von Ethylenchlorhydrin wurden Chlor, Ethylen und Wasser gleichzeitig durch Füllkörpertürme nach oben eingeführt. Diese Reaktoren minimieren den Kontakt zwischen Ethylen und Chlor und maximieren den Kontakt zwischen Kohlenwasserstoff und flüssiger Phase.
Die Zufuhrleitungen sind strategisch positioniert, um eine vollständige Chlorauflösung vor der Ethyleneinführung sicherzustellen. Einige Anlagen verwenden vor dem Ethylen-Reaktionsturm separate Mischkolonnen für Chlor und Wasser.
Der resultierende Produktstrom enthält eine 4,5–5,0 %ige 2-Chlorethanollösung mit einer Ausbeute von 85–89 % umgewandeltem Ethylen. Dichlorethan und Bis(2-chlorethyl)ether sind kleinere Nebenprodukte.
4. Verwendung von 2-Chlorethanol
2-Chlorethanol wurde hauptsächlich für die Synthese von Ethylenoxid verwendet, findet aber immer noch vielfältige Anwendungen in verschiedenen Branchen.
2-Chlorethanol wird als Katalysator für den Olefinstoffwechsel und die Cycloalkenerierungs-öffnende Polymerisation in Form von Addukten mit Wolfram- oder Molybdänhalogeniden und Organoaluminiumverbindungen verwendet.
Es wird zur Herstellung von Farbstoffen, Pharmazeutika, Bioziden, Weichmachern und Thiodiglykol verwendet.
Es wird als Rohstoff bei der Herstellung von modifizierter Zellulose (Hydroxyethylzellulose) und Strach sowie zum Auflösen verschiedener Materialien verwendet, darunter Celluloseacetat und Ethylcellulose, die in Beschichtungen und Filmen verwendet werden.
Es findet Anwendung im Textildruck zum Auflösen von Farbstoffen und in Prozessen wie der Entparaffinierung von Ölen, der Raffinierung von Kolophonium, der Extraktion von Kiefernlignin und sogar der Reinigung von Maschinen.
5. Toxikologie von 2-Chlorethanol
Ethylenchlorhydrin birgt erhebliche Gesundheitsrisiken. Aufgrund der hohen dermalen Toxizität und der mäßigen oralen und inhalativen Toxizität ist für eine sichere Handhabung Haut-, Augen- und Atemschutz erforderlich.
2-Chlorethanol kann über die Haut, durch Einatmen und Verschlucken aufgenommen werden. Akute Expositionen können bei Hautkontakt oder Einatmen tödlich sein. Zu den Symptomen gehören Augenschäden, Atemnot, Magen-Darm-Beschwerden und Organschäden.
Toxizitätsdaten:
- Oral: mäßig giftig, mit LD50-Werten um 60–95 mg/kg bei Ratten.
- Haut: kann über die Haut aufgenommen werden und möglicherweise schädliche Mengen erreichen. Lokale Reizungen sind minimal.
- Auge: Kontakt kann schwere Schäden oder sogar Blindheit verursachen. Eine sofortige Spülung ist entscheidend.
- Das Einatmen ist bei gesättigten Dampfkonzentrationen tödlich. Der geschätzte LC50-Wert liegt zwischen 16 und 62 ppm.
- In Tierversuchen gibt es keine Hinweise auf Auswirkungen auf die Fortpflanzung oder die Entwicklung.
- Mutagenität: Positive und negative Ergebnisse in verschiedenen Tests deuten auf die Möglichkeit von Basenpaarsubstitutionsmutationen hin.
- Karzinogenität: Es gibt keine Hinweise auf Karzinogenität in Tierversuchen. Menschliche Daten sind nicht schlüssig.
2-Chlorethanol wird als brennbar, auf verschiedene Weise akut toxisch eingestuft und verursacht schwere Augenschäden. Die Grenzwerte für die berufsbedingte Exposition variieren je nach Behörde und liegen zwischen 1 und 5 ppm.
Referenz
- Chlorohydrins; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a06_565.pub2
