Cumeno: Propiedades, Reacciones, Producción, Usos y Toxicología
¿Qué es el cumeno?
El cumeno, también conocido como isopropilbenceno o 2-fenilpropano, es un hidrocarburo aromático con la fórmula química C9H12. Es un líquido incoloro e inflamable con un olor característico similar al de la gasolina.
El cumeno es un componente menor del petróleo crudo y de los combustibles derivados del petróleo. Se utiliza principalmente como intermediario en la industria química, en particular en la producción de fenol y acetona.
Tabla de contenido
1. Propiedades físicas del cumeno
El cumeno es un líquido incoloro y volátil con un olor aromático característico. Es miscible con numerosos disolventes orgánicos, como etanol, éter dietílico, acetona, benceno, éter de petróleo y tetracloruro de carbono. Su solubilidad en agua es baja, aproximadamente 61,3 mg/L a 25 °C.
El cumeno forma azeótropos con agua, ácidos carboxílicos alifáticos, éteres de etilenglicol, ciclohexanol y ciclohexanona.
El cumeno tiene un umbral de olor variable, con valores reportados que oscilan entre 0,008 y 0,13 ppm. Si bien algunos estudios indican una percepción humana del olor tan baja como 0,0032 ppm, otros citan valores cercanos a 0,012 ppm. La detección de olores no es un método fiable para evaluar la exposición peligrosa al cumeno.
Los límites de explosividad para las mezclas de cumeno y aire se sitúan entre el 0,8 % y el 6,0 % en volumen. Esto corresponde a una concentración de cumeno de 40 a 300 g/m³.
La Tabla 1 enumera todas las propiedades físicas importantes del cumeno.
| Propiedad | Valor |
|---|---|
| Número CAS | 98-82-8 |
| Fórmula química | C9H12 |
| Masa molar | 120,2 |
| Punto de congelación, °C | −96,03 |
| Punto de ebullición, °C | 152,39 |
| Densidad, g/cm3 (0 °C) | 0,8797 |
| Densidad, g/cm3 (20 °C) | 0,8633 |
| Densidad, g/cm3 (40 °C) | 0,8465 |
| Índice de refracción, n20D | 1,4915 |
| Conductividad térmica a 25 °C, W/(m·K) | 0,124 |
| Viscosidad, mPa·s (0 °C) | 1,073 |
| Viscosidad, mPa·s (20 °C) | 0,790 |
| Viscosidad, mPa·s (40 °C) | 0,610 |
| Tensión superficial a 20 °C, mN/m | 28,2 |
| Presión de vapor a 35 °C, kPa | 1 |
| Presión de vapor a 100 °C, kPa | 21 |
| Presión de vapor a 120 °C, kPa | 40 |
| Presión de vapor a 140 °C, kPa | 73 |
| Presión de vapor a 180 °C, kPa | 196 |
| Punto de inflamación, °C | 33 |
| Temperatura de autoignición, °C | 425 |
| Límites de inflamabilidad en el aire, % vol. (inferior) | 0,9 |
| Límites de inflamabilidad en el aire, % vol. (superior) | 6,5 |
| Temperatura crítica, °C | 358,0 |
| Presión crítica, kPa | 3220 |
| Densidad crítica, g/cm3 | 0,280 |
| Calor de vaporización en el punto de ebullición, J/g | 312 |
| Calor de vaporización a 25 °C, J/g | 367 |
| Calor de formación (líquido) a 25 °C, J/mol | −44.150 |
| Energía libre (vapor) a 25 °C, J/mol | 137.000 |
| Calor de combustión (bruto, agua líquida), J/g | 43.370 |
| Calor de combustión (neto, vapor de agua), J/g | 41,170 |
| Capacidad calorífica (líquido) a 25 °C, J/(mol·K) | 197 |
| Capacidad calorífica (vapor ideal) a 25 °C, J/(mol·K) | 153 |
2. Reacciones químicas del cumeno
La oxidación del cumeno a hidroperóxido de cumeno es la reacción industrial más importante del cumeno. Otras reacciones incluyen la sustitución aromática típica (nitración, sulfonación, halogenación, alquilación y acilación), la halogenación de cadena lateral, la hidrogenación y la combustión.
2.1. El proceso del cumeno
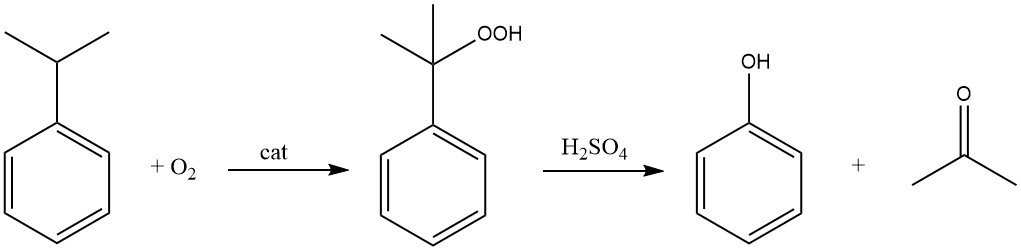
El proceso del cumeno, también conocido como proceso de Hock, comienza con la síntesis del propio cumeno, seguida de una conversión en dos etapas a fenol y acetona.
El cumeno se oxida con aire (oxígeno) en presencia de un iniciador radical para formar hidroperóxido de cumeno. Esta reacción se dirige al átomo de hidrógeno terciario del carbono unido al anillo de benceno.
Utilizando un catalizador ácido como el ácido sulfúrico, el hidroperóxido de cumeno se escinde para producir fenol y acetona.
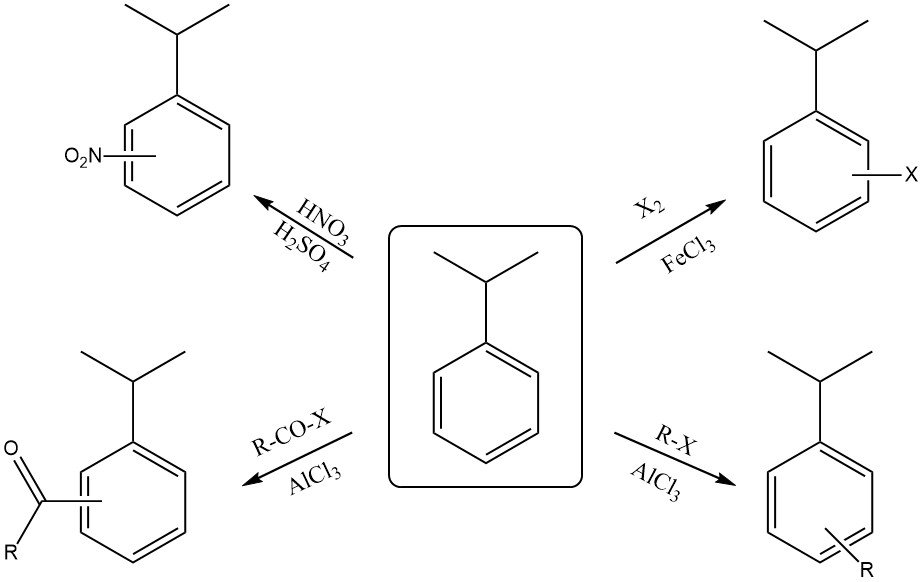
2.2. Reacciones en el anillo aromático
El cumeno reacciona con una mezcla de ácido nítrico concentrado y ácido sulfúrico para formar una mezcla de orto-nitrocumeno y para-nitrocumeno. El isómero para suele ser el producto mayoritario debido al impedimento estérico del voluminoso grupo isopropilo.
La halogenación del anillo con reactivos como el cloro o el bromo en presencia de un catalizador ácido de Lewis (FeCl3 o FeBr3) también produce sustitución orto y para.
La reacción con ácido sulfúrico fumante produce ácido cumenosulfónico.
El cumeno puede reaccionar con un haluro de alquilo y un catalizador ácido de Lewis (AlCl3 ) para formar alquilcumeno.
La reacción del cumeno con un haluro de acilo en presencia de un catalizador ácido de Lewis (AlCl3) produce un orto- y un para-acilcumeno.
2.3. Reacciones en la cadena lateral alquílica
El hidrógeno bencílico (el hidrógeno del carbono directamente unido al anillo de benceno) es particularmente susceptible a reacciones radicalarias debido a la estabilidad del radical bencílico resultante.
El cumeno puede oxidarse con agentes oxidantes fuertes como el permanganato de potasio o el ácido crómico. Esta reacción oxida completamente el carbono bencílico a un grupo ácido carboxílico para producir ácido benzoico y no fenol.
En condiciones de alta temperatura, luz ultravioleta o en presencia de iniciadores radicalarios, halógenos como el cloro o el bromo reaccionarán exclusivamente en la posición bencílico para reemplazar el átomo de hidrógeno.
La hidrogenación del anillo aromático produce isopropilciclohexano utilizando catalizadores como Ni, Pt o Pd.
Al igual que otros hidrocarburos, el cumeno se quema en presencia de oxígeno para producir dióxido de carbono y agua.
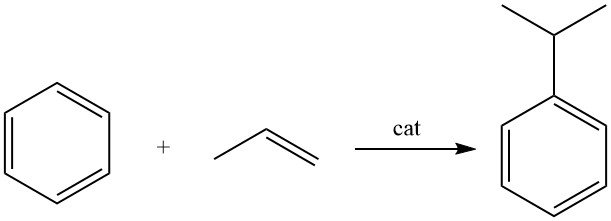
3. Producción industrial de cumeno
El cumeno se produce mediante la alquilación de benceno con propeno en presencia de un catalizador ácido.
Históricamente, el cumeno se sintetizaba en grandes cantidades para su uso como componente de la gasolina de aviación durante la Segunda Guerra Mundial. Si bien posee un alto poder calorífico y un índice de octano elevados, ya no es competitivo como combustible. Su presencia en la gasolina moderna es un subproducto menor de procesos de refinería como el reformado catalítico y el craqueo a vapor.
La producción de cumeno ha experimentado avances significativos gracias al desarrollo de nuevas tecnologías de catalizadores, en particular los sistemas basados en zeolitas, que han sustituido a los métodos antiguos que utilizaban ácido fosfórico sólido y cloruro de aluminio. Este cambio tecnológico, iniciado a mediados de la década de 1990, ha revolucionado la industria.
Además de la producción sintética, el cumeno está presente de forma natural en el petróleo crudo y los productos refinados del petróleo.
3.1. Reacciones de alquilación y transalquilación
El cumeno se produce mediante la alquilación de benceno con propileno en fase líquida utilizando un catalizador ácido.
Esta reacción directa es termodinámicamente favorable. Sin embargo, la conversión de propileno puede verse limitada por la actividad del catalizador y la transferencia de masa. Si bien el n-propilbenceno es termodinámicamente más estable que el cumeno, se produce solo en cantidades menores debido a que el carbono secundario de la molécula de propileno es más reactivo.
El carbono secundario se convierte en un carbocatión en el sitio ácido del catalizador, que luego reacciona con el benceno para formar cumeno. Una alta selectividad para el cumeno sobre el n-propilbenceno, con una proporción de hasta 10 000:1, es importante, ya que estos isómeros no se separan fácilmente por destilación.
También puede producirse una alquilación adicional, donde el cumeno reacciona con más propileno para producir poliisopropilbencenos, incluyendo diisopropilbencenos, triisopropilbencenos y tetraisopropilbencenos.
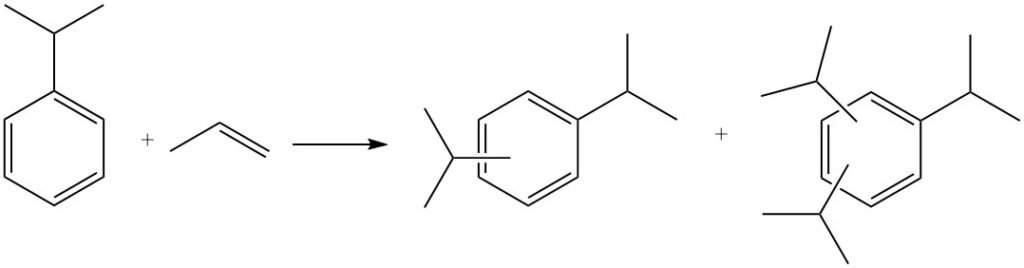
Los poliisopropilbencenos pueden revertirse a cumeno al reaccionar con benceno en un proceso denominado transalquilación.
La alquilación es una reacción exotérmica, mientras que la transalquilación es esencialmente isotérmica. Durante la alquilación, se suele utilizar un exceso de benceno para controlar la temperatura, minimizar la formación de poliisopropilbencenos y evitar la oligomerización del propileno.
Si bien una alta relación benceno-propileno promueve la selectividad del cumeno, también incrementa el coste y la energía necesarios para recuperar el exceso de benceno por destilación.
3.2. Producción de cumeno mediante el proceso de ácido fosfórico sólido (SPA)
Antes de 1996, el proceso SPA era el método más común para producir cumeno, representando más del 80 % de la producción mundial. Este proceso utilizaba ácido fosfórico soportado sobre alúmina como catalizador.
En este método, autorizado a nivel mundial por UOP, se precalentó una mezcla de propileno líquido (a menudo una mezcla de propano y propileno) y benceno, junto con una pequeña cantidad de agua para mantener la actividad del catalizador, y se alimentó a un reactor de lecho fijo que operaba a 180-200 °C y aproximadamente 550 psig.
La relación molar típica de benceno a propileno oscilaba entre 5:1 y 8:1. Los reactores operaban adiabáticamente y el calor liberado por la reacción se aprovechaba parcialmente para vaporizar el propano reciclado.
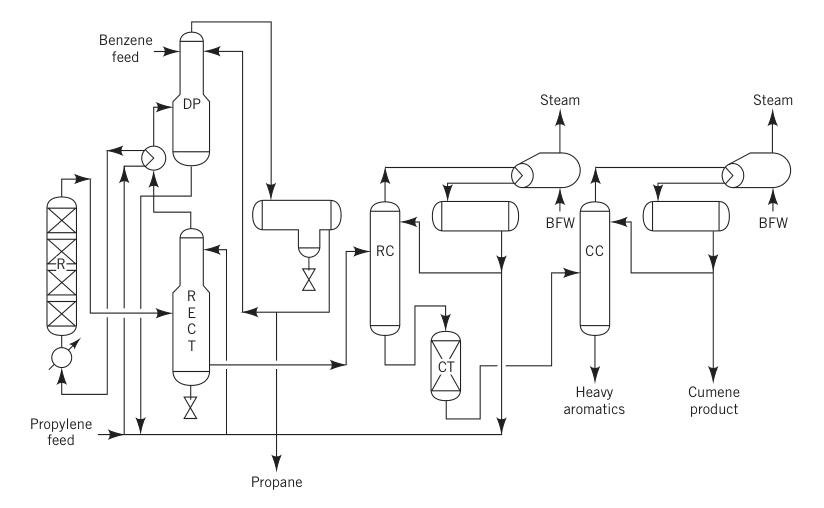
R = reactor; RECT = rectificador; DP = despropanizador; RC = columna de reciclaje; CT = tratador de arcilla; CC = columna de cumeno; y BFW = agua de alimentación de la caldera.
El proceso SPA fue popular debido a su menor inversión inicial y la flexibilidad de la materia prima, ya que permitía utilizar propileno de grado de refinería y benceno de baja pureza. Subproductos como los aromáticos pesados podían utilizarse para la mezcla de gasolina, lo cual representaba una ventaja clave para las refinerías.
Sin embargo, este proceso tenía un rendimiento relativamente bajo (pérdida de aproximadamente el 5%) y producía impurezas. Los esfuerzos para recuperar y transalquilar los aromáticos pesados resultaron infructuosos debido a las altas concentraciones de impurezas como los hexilbencenos.
3.3. Producción de cumeno mediante el proceso de cloruro de aluminio
Otro método más antiguo para la producción de cumeno utilizaba un complejo de cloruro de aluminio como catalizador y operaba a temperaturas inferiores a 100 °C y a baja presión. Este proceso requería materias primas de mayor pureza y una deshidratación cuidadosa del benceno para mantener la actividad del catalizador y reducir la corrosión.
El proceso con cloruro de aluminio ofrecía la ventaja de poder transalquilar poliisopropilbencenos a cumeno, lo que resultaba en mayores rendimientos. Sin embargo, requería reactores costosos y resistentes a la corrosión, como los de Hastelloy o con revestimiento de vidrio, un lavado exhaustivo de efluentes y generaba problemas ambientales asociados con la eliminación del catalizador.
3.4. Producción de cumeno mediante procesos modernos basados en zeolitas
Desde mediados de la década de 1990, la industria del cumeno ha migrado rápidamente a tecnologías de alquilación basadas en zeolitas. Estos catalizadores eliminaron los problemas de corrosión y eliminación de residuos asociados con los procesos anteriores, a la vez que proporcionaban altos rendimientos, alta selectividad y una pureza de producto muy alta.
Los catalizadores modernos de zeolitas pueden regenerarse repetidamente, lo que reduce los residuos y los costos operativos. También permiten menores proporciones de alimentación de benceno a propileno, lo que reduce el tamaño del sistema de destilación y el consumo de energía.
Un ejemplo notable es el proceso ExxonMobil/Badger, que utiliza un catalizador patentado MCM-22. En este proceso en fase líquida, el propileno y el benceno se premezclan y se introducen en un reactor de alquilación de lecho fijo, donde el propileno se consume por completo. El efluente se purifica posteriormente mediante una serie de columnas de destilación.
El exceso de benceno se recicla y los poliisopropilbencenos se recuperan y se envían a un reactor de transalquilación independiente, donde reaccionan con el benceno para formar más cumeno.
Este proceso alcanza rendimientos casi estequiométricos y un producto de alta pureza. Las plantas existentes de SPA o de cloruro de aluminio pueden convertirse a esta tecnología, con aumentos de capacidad que van desde el 30 % hasta más del 100 %, con una inversión relativamente modesta.
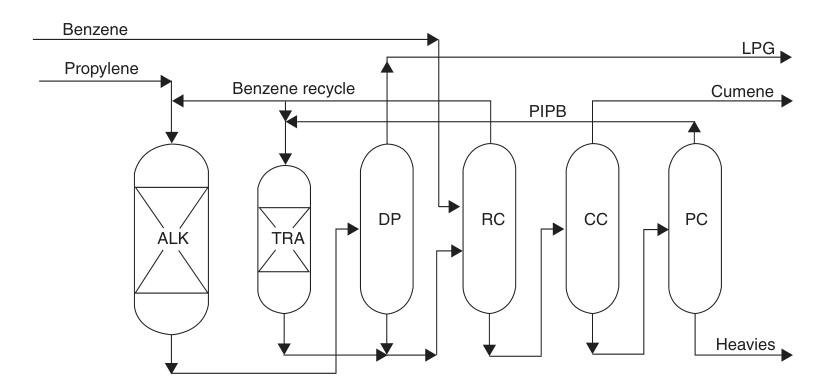
ALK = reactor de alquilación; TRA = reactor de transalquilación; DP = propanizador; RC = columna de reciclaje; CC = columna de cumeno; y PC = columna de poliisopropilbencenos.
Otras empresas, como CDTech, Dow/Kellogg y UOP, también han desarrollado sus propias tecnologías basadas en zeolitas. Por ejemplo, el proceso Q-Max de UOP utiliza una nueva generación de catalizadores que pueden regenerarse repetidamente, eliminando la necesidad de desecharlos.
Esta tecnología también puede ampliar la capacidad de las plantas existentes con una mínima inversión de capital. La transición a estos procesos avanzados ha permitido que muchas plantas de cumeno aumenten significativamente su capacidad de producción.
4. Usos del cumeno
El cumeno tiene un octanaje de 109, comparable al del tolueno. Durante la década de 1940, esta propiedad lo convirtió en un valioso aditivo para la gasolina de aviación.
El cumeno se utiliza actualmente casi en su totalidad (95 % de la producción total) como intermediario para la producción de fenol y acetona. En presencia de oxígeno, el cumeno se oxida a hidroperóxido de cumeno, que, tras una escisión catalizada por ácido, produce fenol y acetona.
La producción mundial de cumeno alcanzó aproximadamente 18 millones de toneladas en 2020 y se proyectaba un aumento, impulsado principalmente por la creciente demanda de bisfenol A en la fabricación de policarbonato y resinas epoxi.
Los subproductos menores que se forman durante el proceso de oxidación del cumeno incluyen α-metilestireno, acetofenona, alcoholes cumílicos y diisopropilbenceno.
El α-metilestireno se utiliza en la producción de resinas de acrilonitrilo-butadieno-estireno (ABS), p-cumilfenol y otros intermedios.
El hidroperóxido de cumeno también se utiliza como iniciador de radicales en la copolimerización de estireno con butadieno y acrilatos, y en la reticulación de resinas de poliéster insaturado. La reacción del hidroperóxido de cumeno con α-metilestireno produce peróxido de dicumilo, un iniciador para la reticulación radical de poliolefinas.
La hidrogenación del cumeno produce isopropilciclohexano (hidrocumeno), un disolvente cicloalifático de alto punto de ebullición (154,5 °C) y bajo punto de congelación (–90 °C).
El cumeno también se utiliza en pequeñas cantidades como diluyente para pinturas, esmaltes y lacas, y como disolvente para grasas y resinas, sustituyendo en ocasiones al benceno en aplicaciones industriales.
Según la Base de Datos de Información sobre Productos de Consumo (2022), el cumeno se encuentra en más de cien productos de consumo y domésticos, incluyendo pesticidas y productos de limpieza.
5. Toxicología del cumeno
La exposición al cumeno se produce principalmente por la inhalación de aire contaminado en entornos laborales y por la evaporación de productos derivados del petróleo. Otras fuentes incluyen el humo del cigarrillo, los alimentos y el agua contaminados, y la ingestión accidental o la absorción dérmica.
La inhalación es la vía más importante, ya que el cumeno se absorbe fácilmente a través de los pulmones, se metaboliza en el hígado a compuestos hidrosolubles y se excreta eficazmente, principalmente en la orina, sin evidencia de acumulación a largo plazo.
Estudios toxicocinéticos en humanos confirman que el cumeno y su metabolito, el 2-fenil-2-propanol, se eliminan en un plazo de 40 horas tras la exposición.
La exposición aguda a altas concentraciones de cumeno induce depresión del sistema nervioso central, que se manifiesta con cefalea, mareos, narcosis, náuseas y pérdida de consciencia a niveles muy superiores a los límites de exposición ocupacional.
El cumeno también es un irritante primario para la piel, los ojos y las vías respiratorias. El contacto repetido o prolongado con la piel puede causar dermatitis y erupciones cutáneas, mientras que la ingestión conlleva un alto riesgo de neumonitis por aspiración.
En estudios con animales, la inhalación a corto plazo a concentraciones superiores a 1000 ppm indujo efectos neurotóxicos reversibles, mientras que la exposición a dosis muy altas provocó toxicidad grave del sistema nervioso central y la muerte.
La LD50 oral en ratas es de aproximadamente 1400 mg/kg y los valores de LC50 por inhalación varían entre 2000 y 8000 ppm dependiendo de la especie.
| Vía de exposición | Síntomas | Primeros auxilios |
|---|---|---|
| Inhalación y olfato |
Mareos Incoordinación Somnolencia Dolor de cabeza |
Salir al aire libre y descansar Solicitar atención médica si es necesario |
| Contacto con la piel |
Piel seca Erupciones Picazón Piel enrojecida |
Retirar la ropa contaminada inmediatamente y lavar la piel con agua. Algunas referencias sugieren lavar la piel con agua y jabón después de enjuagar. Si la irritación persiste después del lavado, consulte a un médico. |
| Contacto con los ojos |
Irritación ocular Enrojecimiento |
Enjuague inmediatamente los ojos con abundante agua, levantando ocasionalmente los párpados superior e inferior, si el producto químico entra en contacto con los ojos. Busque atención médica inmediata. |
| Ingestión |
Mareos Descoordinación Somnolencia Dolor de cabeza |
Existe riesgo de aspiración Se recomienda usar enjuague bucal. Evite provocar el vómito. Consulte a un profesional médico de inmediato. |
Los datos sobre la exposición crónica en humanos son limitados, pero estudios en animales indican efectos hematológicos y orgánicos leves tras la exposición subcrónica por inhalación, como congestión pasiva de pulmones, hígado, riñones y bazo. No se han reportado efectos inmunotóxicos consistentes.
La evidencia de toxicidad reproductiva y del desarrollo es débil, y los estudios sugieren un metabolismo y una excreción rápidos sin efectos significativos sobre la fertilidad ni el desarrollo de la descendencia.
Las pruebas de genotoxicidad han arrojado resultados mayoritariamente negativos en sistemas bacterianos, in vitro e in vivo, aunque algunos estudios en animales con dosis altas reportaron efectos citogenéticos débiles.
Los datos de carcinogenicidad en humanos son insuficientes, pero estudios de inhalación a largo plazo en roedores demostraron una mayor incidencia de tumores hepáticos, renales y pulmonares, lo que llevó al Programa Nacional de Toxicología de EE. UU. a clasificar el cumeno como «razonablemente previsible como carcinógeno humano».
La Agencia Internacional para la Investigación del Cáncer (IARC) también ha clasificado el cumeno como posible carcinógeno humano (Grupo 2B).
La Administración de Seguridad y Salud Ocupacional (OSHA) y la Conferencia Americana de Higienistas Industriales Gubernamentales (ACGIH) han establecido un límite de exposición permisible promedio ponderado en el tiempo de 8 h y un valor límite umbral de 50 ppm (245 mg/m³).
Si bien los efectos agudos son generalmente reversibles, la lenta inducción y eliminación de su acción depresora del sistema nervioso central sugiere posibles riesgos acumulativos.
Referencias
1. Hwang, S.Y. and Chen, S.S. (2010). Cumene. In Kirk-Othmer Encyclopedia of Chemical Technology, (Ed.). https://doi.org/10.1002/0471238961.0321130519030821.a01.pub3
2. Abdolmaleki, G.; Bayrami, Z. Cumene. In Encyclopedia of Toxicology, 4th ed.; Wexler, P., Ed.; Academic Press, 2024; pp 337–343. DOI: 10.1016/B978-0-12-824315-2.00295-5
3. Dimian, A.C. and Bildea, C.S. (2008). Alkylation of Benzene by Propylene to Cumene. In Chemical Process Design (eds A.C. Dimian and C.S. Bildea). https://doi.org/10.1002/9783527621583.ch6
4. Gollapudi, B. B.; Williams, A. L.; Bus, J. S. «A review of the genotoxicity of the industrial chemical cumene.» Mutat. Res./Rev. Mutat. Res., 2021, 787, 108364. DOI: 10.1016/j.mrrev.2021.108364
5. Schmidt, R., Griesbaum, K., Behr, A., Biedenkapp, D., Voges, H.-W., Garbe, D., Paetz, C., Collin, G., Mayer, D. and Höke, H. (2014). Hydrocarbons. In Ullmann’s Encyclopedia of Industrial Chemistry, (Ed.). https://doi.org/10.1002/14356007.a13_227.pub3
