Acetylchlorid: Eigenschaften, Reaktionen, Herstellung und Verwendung
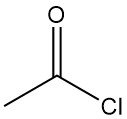
Was ist Acetylchlorid?
Acetylchlorid, auch bekannt als Ethanoylchlorid, ist eine organische Verbindung mit der Summenformel CH3COCl. Es ist eine farblose, ätzende und stark reizende Flüssigkeit mit erstickendem Geruch.
Acetylchloridkonzentrationen von nur 0,5 ppm führen zu Tränenfluss und Brennen in Augen, Nase und Rachen. Acetylchlorid ist toxisch, da es leicht mit Hydroxy-, Sulfhydryl- und Aminogruppen reagiert und dabei Veränderungen hervorruft, die die Aktivität wichtiger Enzyme in lebendem Gewebe hemmen.
Inhaltsverzeichnis
1. Physikalische Eigenschaften von Acetylchlorid
Acetylchlorid ist eine farblose, ätzende Flüssigkeit. Die wichtigsten physikalischen Eigenschaften von Acetylchlorid sind in Tabelle 1 zusammengefasst.
| Eigenschaft | Wert |
|---|---|
| CAS-Registrierungsnummer | 75-36-5 |
| Molekularformel | C2H3OCl |
| Molmasse (g/mol) | 78,50 |
| Gefrierpunkt (°C) | -112,0 |
| Siedepunkt (°C, 101,3 kPa) | 50,2 |
| Dichte (g/ml) bei 4 °C | 1,1358 |
| Dichte (g/ml) bei 20 °C | 1,1051 |
| Dichte (g/ml) bei 25 °C | 1,0982 |
| Standardbildungsenthalpie (ΔHf, kJ/mol) | -243,93 |
| Verdampfungsenthalpie am Siedepunkt (ΔHv, kJ/g) | 0,36459 |
| Brechungsindex (nD20) | 1,38976 |
2. Chemische Reaktionen von Acetylchlorid
Acetylchlorid unterliegt einer Vielzahl chemischer Reaktionen und wird in der organischen Synthese eingesetzt für:
- Elektrophile Acetylierung von Arenen, Alkenen, Alkinen, gesättigten Alkanen, Organometallverbindungen und Enolaten (an C oder O)
- Spaltung von Ethern
- Veresterung von sterisch ungehinderten oder säureempfindlichen Alkoholen
- Erzeugung von Lösungen von wasserfreiem Chlorwasserstoff in Methanol
- Als Dehydratisierungsmittel
- Als Lösungsmittel für Organometallverbindungen Reaktionen
- Zur Desoxygenierung von Sulfoxiden
- Als Chlor- und Bromfänger
- Als Ketenquelle
- Für die nukleophile Acetylierung
In inerten Lösungsmitteln wie Schwefelkohlenstoff oder Petrolether reagiert Acetylchlorid mit aromatischen Kohlenwasserstoffen und Olefinen zu Ketonen. Diese Reaktionen werden durch Lewis-Säuren katalysiert, wobei die katalytische Aktivität in der folgenden Reihenfolge zunimmt:
ZnCl2 < BiCl3 < TeCl4 < TiCl4 < SnCl4 < TeCl2 < FeCl3 < SbCl5 < AlCl3
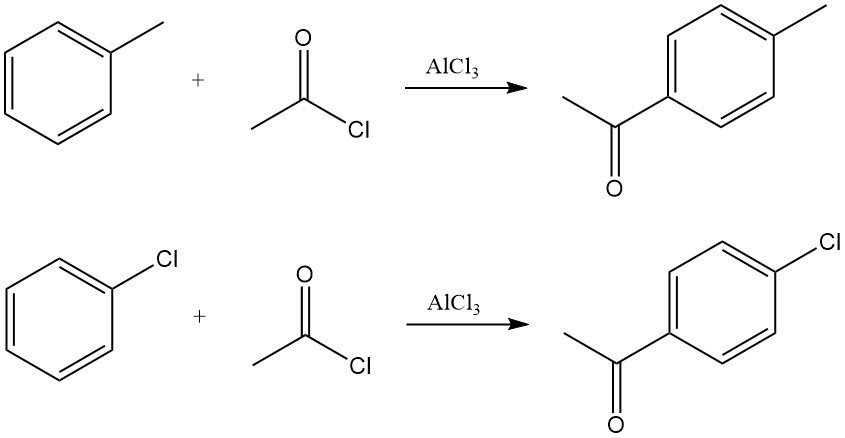
Arene reagieren mit Acetylchlorid in Gegenwart von Lewis-Säuren, typischerweise Aluminiumchlorid, zu Arylmethylketonen. Die Reaktion verläuft über die Bildung des Acyliumions, das eine elektrophile aromatische Substitution durchläuft.
Beispielsweise ergibt die Acetylierung von Toluol überwiegend p-Methylacetophenon, während die Acetylierung von Chlorbenzol mit hoher Selektivität p-Chloracetophenon liefert.
Alkene reagieren unter Friedel-Crafts-Bedingungen mit Acetylchlorid zu Gemischen aus Chloralkylmethylketonen und verwandten Produkten. Elektronenarme Alkene wie Ethylen und Allylchlorid liefern gute Ausbeuten, während höhere Alkene häufig Umlagerungen eingehen.
Beispielsweise ergibt die Reaktion von Acetylchlorid mit Cyclohexen unter Verwendung von AlCl3 als Katalysator 2-Chlorcyclohexylmethylketon und 4-Chlorcyclohexylmethylketon.

Alkine unterliegen unter ähnlichen Bedingungen einer elektrophilen Acetylierung. Acetylen, das mit Acetylchlorid und Aluminiumchlorid behandelt wird, erzeugt β-Chlorvinylmethylketon, während höhere Alkine ketonische Produkte in mittleren bis hohen Ausbeuten ergeben.
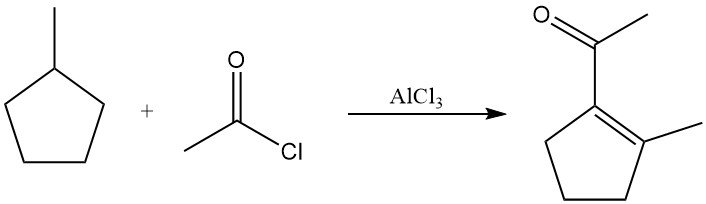
In Gegenwart von Acetylchlorid und Aluminiumchlorid bei erhöhter Temperatur werden gesättigte Alkane zu Alkenen dehydriert und anschließend acetyliert. Die Produkte sind typischerweise Vinylmethylketone oder gesättigte Alkylmethylketone. Methylcyclopentan beispielsweise liefert 1-Acetyl-2-methylcyclopenten in signifikanter Ausbeute.
Acetylchlorid reagiert mit einer Vielzahl organometallischer Verbindungen, darunter Grignard-, Organolithium-, Organozink- und Organocuprat-Reagenzien, zu Methylketonen. Übergangsmetallkatalysatoren wie Palladium- oder Kupfersalze werden häufig eingesetzt, um Selektivität und Ausbeute zu verbessern.
Metallenolate reagieren mit Acetylchlorid zu β-Diketonen. Je nach Metallgegenion kann die Reaktion auch konkurrierende O-acetylierte Produkte liefern. Die Verwendung von Zink- oder Kupferenolaten verbessert die Selektivität für die C-Acetylierung. Verwandte Transformationen umfassen die Acetylierung von Silylketenacetalen und Enaminen, die den Zugang zu funktionalisierten Estern und Ketonen ermöglicht.
Ketone und β-Ketoester können mit Acetylchlorid in Enolacetate umgewandelt werden. Die Reaktion kann über vorgebildete Enolate oder Silylenolether verlaufen. Beispielsweise können Steroidketone durch Behandlung mit Acetylchlorid in Gegenwart von Aminbasen in konjugierte Enolacetate umgewandelt werden.
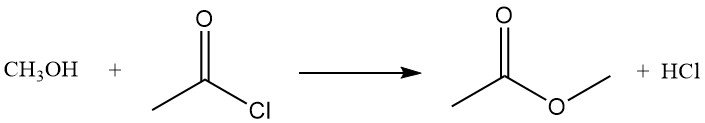
Acetylchlorid reagiert mit Alkoholen zu Estern oder Alkylchloriden. Primäre Alkohole bilden üblicherweise Ester, während sekundäre und tertiäre Alkohole häufig durch Substitution Chloride ergeben. Die Reaktion von Methanol mit Acetylchlorid erzeugt Methylacetat und Chlorwasserstoff und wird zur Herstellung von Lösungen von wasserfreiem Chlorwasserstoff in Methanol verwendet.
Cyclische und acyclische Ether können durch Acetylchlorid in Gegenwart von Halogenidsalzen oder Lewis-Säuren gespalten werden. Beispielsweise reagiert Tetrahydrofuran mit Acetylchlorid und Natriumiodid zu 4-Iodbutylacetat und in Gegenwart einer Lewis-Säure wie ZnCl2 zu Chlorbutylacetat in etwa 76 % Ausbeute.
Diese Eigenschaft macht Acetylchlorid nützlich zur Entschützung von Ether-Schutzgruppen.

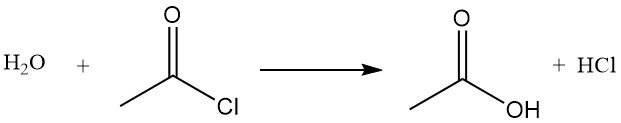
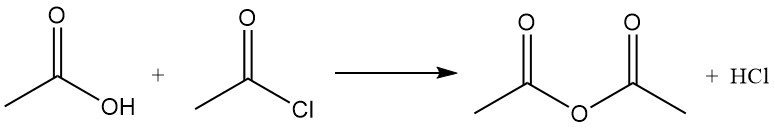
Acetylchlorid wirkt als Dehydratisierungsmittel, indem es mit Wasser zu Essigsäure und Chlorwasserstoff reagiert. Es fördert die Cyclisierung von Dicarbonsäuren zu Anhydriden, von Ketosäuren zu Lactonen und von Nitroverbindungen zu Nitriloxiden. Es wird auch bei der Umwandlung von Hydroperoxiden in ungesättigte Ketone verwendet. Beispielsweise reagiert es mit Essigsäure zu Essigsäureanhydrid.
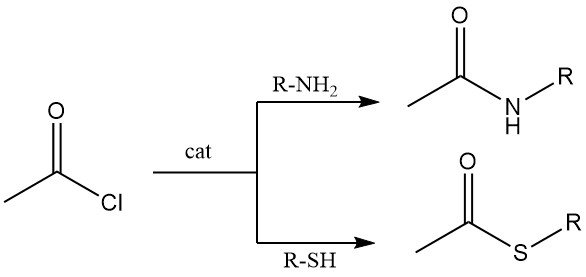
Primäre und sekundäre Amine reagieren mit Acetylchlorid zu Acetamiden. Unter Schotten-Baumann-Bedingungen (wässrige Base) ist die N-Acetylierung effizient, obwohl die Hydrolyse von Acetylchlorid konkurrieren kann.
Tertiäre Amine ergeben Acetylammoniumsalze, die sich zu Ketenen zersetzen oder eine Von-Braun-Fragmentierung eingehen können. Verwandte Reaktionen sind die N-Acetylierung von Iminen zu Enamiden und die Umwandlung von Urethanen in Imide.
Thiole reagieren mit Acetylchlorid zu Thioestern. Sowohl aliphatische als auch aromatische Thiole durchlaufen diese Umwandlung, typischerweise in Gegenwart von Kobaltchlorid als Katalysator.
Acetylchlorid bildet in Gegenwart von Lewis-Säuren reversible Addukte mit Aldehyden und Ketonen zu α-Chloralkylacetaten. Beispielsweise reagiert Aceton bei niedriger Temperatur mit Acetylchlorid und Zinkchlorid und bildet das entsprechende Addukt in guter Ausbeute.
Sulfoxide werden durch Acetylchlorid in Gegenwart von Zinn(II)-chlorid zu Sulfiden reduziert. Die Reaktion verläuft unter milden Bedingungen und ist mit empfindlichen funktionellen Gruppen, einschließlich Cephalosporin-Derivaten, kompatibel.
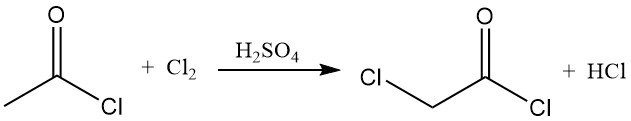
Acetylchlorid reagiert mit Chlor und Brom zu Halogenacetylchloriden. In Gegenwart von Schwefelsäure wird Chlor effizient zu Chloracetylchlorid umgewandelt, einem wichtigen synthetischen Zwischenprodukt.
Reaktionen von Acetylchlorid mit tertiären Aminen wie Triethylamin erzeugen in situ Keten. Das Keten kann durch Enolate, Enamine oder Imine abgefangen werden und bildet Acetessigester, Cyclobutanone oder Diketenaddukte.
In Gegenwart von Samarium(II)-iodid verhält sich Acetylchlorid wie ein nukleophiles Acetylanionenäquivalent und ergibt Acyloinprodukte aus Ketonen.
Die Reaktion von Acetylchlorid mit Wasserstoffperoxid erzeugt Peressigsäure und Acetylperoxid, eine hochexplosive Verbindung.
In Gegenwart von Fettsäuren bildet es gemischte Essigsäure-Alkylcarbonsäureanhydride oder Acylchloride, die beide in Veresterungsreaktionen eingesetzt werden können. Beispielsweise reagiert Laurinsäure mit Acetylchlorid zu den entsprechenden Derivaten.
Acetylchlorid wird mit organometallischen Reagenzien wie Lithiumaluminiumhydrid (LiAlH4) reduziert. In Gegenwart von tert-Butylalkohol wird LiAlH4 zu Lithiumtri-tert-butoxyaluminiumhydrid umgewandelt, das Acetylchlorid selektiv zu Acetaldehyd reduziert. Auch Triphenylzinnhydrid reduziert Acetylchlorid.
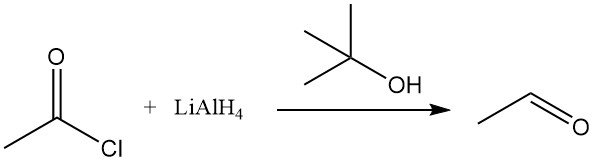
Die katalytische Hydrierung von Acetylchlorid nach der Rosenmund-Methode ist ineffizient, die Reduktion von Essigsäureanhydrid zu Ethylidendiacetat ist jedoch in Gegenwart von Acetylchlorid über Palladiumkomplexen möglich. Rhodiumtrichlorid, Methyliodid und Triphenylphosphin bilden einen Komplex, der Acetylchlorid aktiv reduzieren kann.
3. Herstellung von Acetylchlorid
Acetylchlorid wird in Europa und Fernost kommerziell hergestellt. In den USA ist die Produktion begrenzt und hauptsächlich auf den Einsatz vor Ort, insbesondere für die pharmazeutische Acetylierung, ausgerichtet.
Acetylchlorid wurde erstmals in den 1850er Jahren beschrieben. Es wurde durch Destillation von wasserfreiem Natriumacetat mit Phosphoroxychlorid gewonnen.
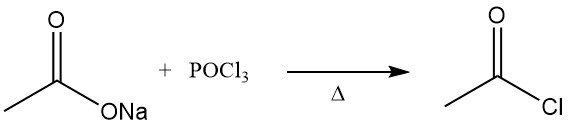
Die frühere Methode zur Herstellung von Acetylchlorid war die Reaktion von Thionylchlorid, SOCl2, mit grauem Kalkacetat. Dieses Verfahren wurde weitgehend durch die Reaktion von Natriumacetat oder Essigsäure mit Phosphortrichlorid, PCl3, ersetzt. Ein ähnliches Verfahren wurde auch in der Sowjetunion weiterverfolgt. Beide Methoden sind relativ teuer.
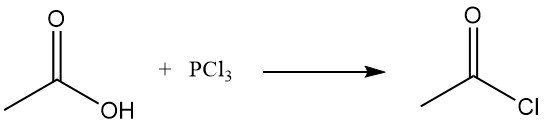
Die Carbonylierung von Methylchlorid mit Kohlenmonoxid zur Herstellung von Acetylchlorid wurde in mehreren Patenten beschrieben. Diese Verfahren verwenden Katalysatoren auf Basis von Rhodium-, Palladium- oder Iridiumkomplexen in Kombination mit Iodverbindungen und entweder Phosphoniumiodiden oder Phosphinoxiden.
So ergab eine berichtete Reaktion beispielsweise eine 56%ige Umwandlung in Acetylchlorid bei einer Temperatur von 453 K und einem Druck von 8360 kPa. Diese Reaktionen sind aufgrund der Verfügbarkeit korrosionsbeständiger Legierungen möglich. Eine industrielle Anwendung dieser Methode ist nicht bestätigt.
Alternative Herstellungsverfahren umfassen die Reaktion von Essigsäure mit chloriertem Ethylen in Gegenwart von Eisenchlorid, die Kombination von Benzylchlorid mit Essigsäure (85 % Ausbeute), die Umwandlung von Ethylidendichlorid (91 % Ausbeute) und die Zersetzung von Ethylacetat durch Phosgen zu Acetylchlorid und Ethylchlorid. Die hohen Kosten für Rohstoffe und Ausrüstung machen die Phosgen-Methode unrentabel.
Bei der Chlorierung von Essigsäure zu Monochloressigsäure entsteht ebenfalls Acetylchlorid als Nebenprodukt. Da die Rückgewinnung kostspielig ist, wird Acetylchlorid üblicherweise zu Monochloressigsäure recycelt. Ein patentiertes Verfahren beschreibt die Wäsche von Acetylchlorid- und Chlorwasserstoff-Gemischen mit Schwefelsäure zu Acetylsulfat.
Ein US-Patent berichtet über eine verbesserte Ausbeute an Acetylchlorid aus der Reaktion von Essigsäureanhydrid mit Chlorwasserstoff. Bei diesem Verfahren werden Acetylchlorid und ein Teil des Essigsäure-Nebenprodukts kontinuierlich aus der Mischung entfernt, während die verbleibenden Komponenten zur weiteren Reaktion in den Reaktor zurückgeführt werden.
4. Verwendung von Acetylchlorid
Bei der Chlorierung von Essigsäure zu Monochloressigsäure wird in der Anlaufphase eine geringe Menge Acetylchlorid verbraucht. Nach dem Start erhält das als Nebenprodukt gebildete Acetylchlorid die katalytische Wirkung.
Acetylchlorid ist ein wirksames Acetylierungsmittel. Es wird bei der Synthese von Aspirin, Paracetamol, Acetanilid und Acetophenon verwendet. Es wird auch zur Herstellung von Flüssigkristallzusammensetzungen für optische Anzeige- und Speichergeräte eingesetzt.
Acetylchlorid kann Essigsäureanhydrid oder Essigsäure als hochreaktives Acetylierungsreagenz ersetzen, wenn Reaktionen schwierig oder langsam sind. Dies macht Acetylchlorid besonders nützlich für die Herstellung spezieller Polymere, die mit Metallionen wie Kupfer chelatieren können, was zu verbesserten elektrischen und magnetischen Eigenschaften führt.
Anthralin wird mit Acetylchlorid in Toluol unter Verwendung von Pyridin als Katalysator acetyliert, um 1,8-Dihydroxy-10-acetylanthron zu bilden, ein Zwischenprodukt in Medikamenten gegen Hauterkrankungen wie Warzen, Psoriasis und Akne. Zuckerester können unter wasserfreien Bedingungen auf ähnliche Weise mit Acetylchlorid synthetisiert werden.
Acetylchlorid wurde in der analytischen Chemie zur Bestimmung von Hydroxygruppen verwendet, diese Methode wurde jedoch weitgehend durch spektroskopische Techniken ersetzt. Es wird weiterhin zur Herstellung von Phenolderivaten ohne starke Säurekatalysatoren sowie zur Acetylierung primärer und sekundärer Amine verwendet.
Acetylchlorid kann Essigsäureanhydrid in vielen Acetylierungsreaktionen ersetzen. Im Gegensatz zum Anhydrid benötigt es keinen Mineralsäurekatalysator. Trotz seiner höheren Kosten wird Acetylchlorid häufig dort eingesetzt, wo die Zweckmäßigkeit die Kosten überwiegt. Die Senkung der Produktionskosten würde Acetylchlorid zu einer starken Alternative zu Essigsäureanhydrid in großtechnischen Prozessen machen.
5. Toxikologie und Sicherheit
Acetylchlorid erzeugt erstickende Dämpfe mit scharfem, reizendem Geruch. Es ist hochgiftig. Seine Entflammbarkeit und seine starke Reaktion mit Wasser und Laugen erfordern strenge Vorsichtsmaßnahmen bei der Handhabung.
Ausreichende Belüftung ist erforderlich, um Dämpfe aus Arbeitsbereichen zu entfernen. Das Personal sollte undurchlässige Schutzkleidung tragen, um eine Exposition zu vermeiden. Großbehälter müssen kühl und trocken gelagert werden, getrennt von brennbaren und nicht ätzenden Stoffen.
Referenzen
1. Wagner, F.S., Jr. (2002). Acetyl Chloride. In Kirk-Othmer Encyclopedia of Chemical Technology, John Wiley & Sons, Inc (Ed.). https://doi.org/10.1002/0471238961.0103052023010714.a04.pub2
2. Pearlman, B.A. (2001). Acetyl Chloride. In Encyclopedia of Reagents for Organic Synthesis, (Ed.). https://doi.org/10.1002/047084289X.ra025
3. Le Berre, C., Serp, P., Kalck, P. and Torrence, G.P. (2014). Acetic Acid. In Ullmann’s Encyclopedia of Industrial Chemistry, (Ed.). https://doi.org/10.1002/14356007.a01_045.pub3
