Malonsäure: Eigenschaften, Reaktionen, Herstellung und Verwendung
Was ist Malonsäure?
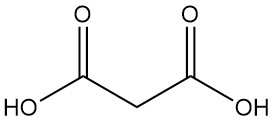
Malonsäure, auch bekannt als Propandisäure oder Methandicarbonsäure, ist eine Dicarbonsäure mit der chemischen Formel C3H4O4. Es ist ein farbloser, hygroskopischer Feststoff, der im Vakuum sublimiert. Die ionisierte Form der Malonsäure sowie ihre Ester und Salze werden als Malonate bezeichnet.
Inhaltsverzeichnis
1. Physikalische Eigenschaften von Malonsäure
Malonsäure ist ein weißer, hygroskopischer Feststoff, der sehr gut wasserlöslich (139 g in 100 g Wasser bei 22 °C) und gut pyridinlöslich (15 g in 100 g Pyridin bei 15 °C) ist. Sie ist leicht löslich in Ethanol und Diethylether und unlöslich in Benzol.
Die physikalischen Eigenschaften von Malonsäure sind in Tabelle 1 aufgeführt.
| Eigenschaft | Wert |
|---|---|
| CAS-Registriernummer | [141-82-2] |
| Molekularformel | C3H4O4 |
| Molekulargewicht | 104,06 g/mol |
| Schmelzpunkt | 134 – 138 °C |
| Siedepunkt | Zersetzung bei 140 °C |
| Dichte | 1,62 g/cm³ |
| pKa1 | 2,83 |
| pKa2 | 5,70 |
| Flammpunkt | 157 °C |
2. Reaktionen der Malonsäure
Malonsäure kommt in kleinen Mengen in Zuckerrüben und grünem Weizen vor und entsteht durch den oxidativen Abbau von Äpfelsäure.
Malonsäure zeigt typische Reaktionen von Carbonsäuren und eine hohe Reaktivität der zentralen Methylengruppe aufgrund der Säure der Wasserstoffatome an der 2-Position.
Malonsäure reagiert wie die meisten Carbonsäuren zu Amiden, Estern, Anhydriden und Säurechloriden.
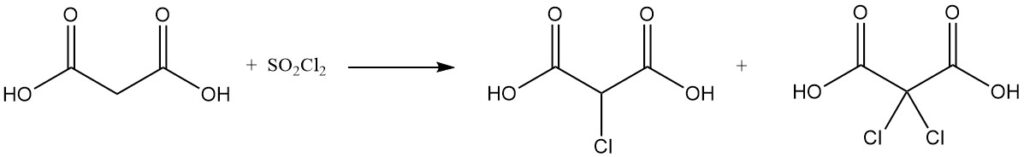
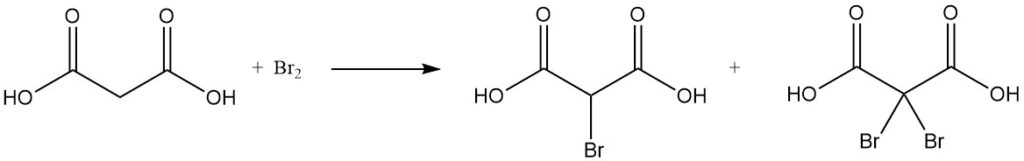
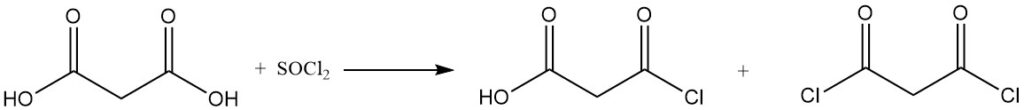
Die Reaktion von Malonsäure mit Sulfurylchlorid oder Brom ergibt mono- oder dihalogenierte Derivate, während Thionylchlorid oder Phosphorpentachlorid Mono- oder Diacylchloride bilden.
Malonsäure reagiert mit Harnstoff zu Barbitursäure, einem Vorläufer verschiedener Arzneimittel, und mit Aceton zu Meldrumsäure, einem wichtigen Zwischenprodukt der organischen Synthese.
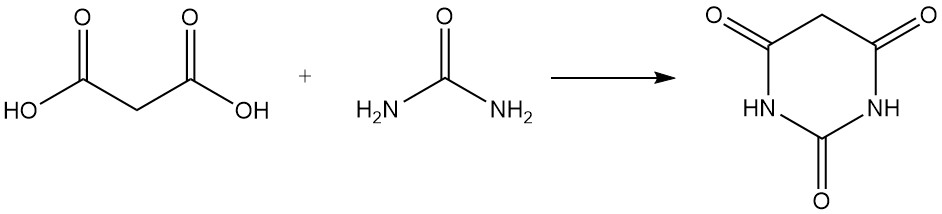
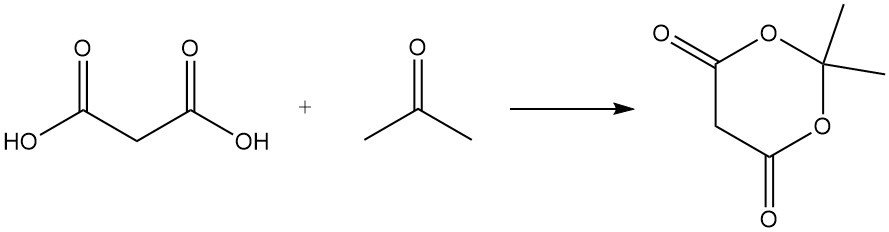
Im Gegensatz zu typischen Carbonsäuren entsteht beim Erhitzen von Malonsäure mit Phosphorpentoxid kein Anhydrid, sondern Kohlensuboxid, ein giftiges Gas, das bei Kontakt mit Wasser leicht Malonsäure zurückbildet.
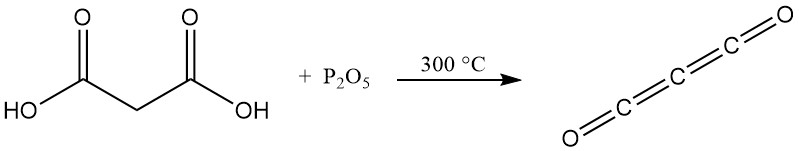
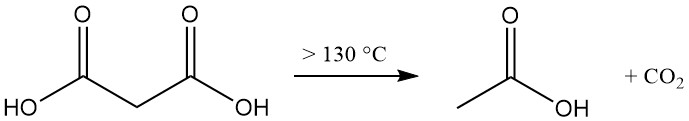
Bei der thermischen Zersetzung von Malonsäure über 130 °C (freie Säure) bzw. 70 °C (wässrige Lösung) entstehen Essigsäure und Kohlendioxid.
Die Mono- und Dianionen der Malonsäure sind im Vergleich zur freien Säure stabiler. In wässrigen Lösungen zersetzt sich Mononatriummalonat über 90 °C, während Dinatriummalonat über 130 °C zerfällt.
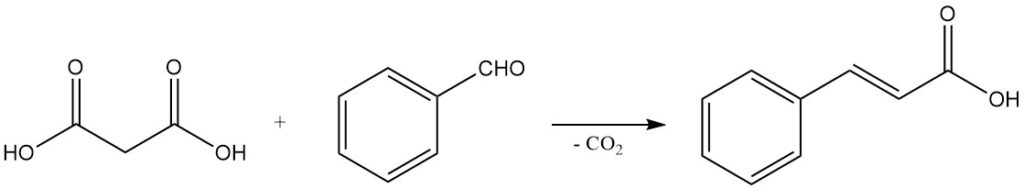
Das milde Decarboxylierungsverhalten, gepaart mit der Fähigkeit, Knoevenagel-Kondensationen einzugehen, macht Malonsäure zu einem wichtigen Reagenz für die Synthese von α,β-ungesättigten Carbonsäuren. So ergibt die Reaktion mit Benzaldehyd Zimtsäure und Reaktionen mit aliphatischen Aldehyden Acrylsäuren.
Die Forschung hat auch Platinkomplexe von Malonsäure und ihren Derivaten als potenzielle Antitumormittel untersucht.
3. Industrielle Produktion von Malonsäure
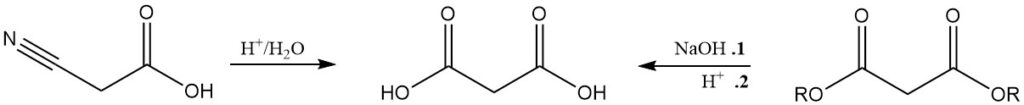
Obwohl weniger bedeutend als die Malonatproduktion, wird Malonsäure üblicherweise durch Hydrolyse von Cyanessigsäure oder durch Säureverseifung von Malonaten hergestellt.
Es wurden auch neue Methoden zur Herstellung von Malonsäure gemeldet, darunter die Ozonolyse von Cyclopentadien, die palladiumkatalysierte Luftoxidation von 1,3-Propandiol, die metallkatalysierte Oxidation von 3-Hydroxypropionaldehyd oder 3-Hydroxypropionsäure und die biokatalytische Umwandlung von Malonsäurenitril mithilfe eines Nitrilaseenzyms.
Die erste Laborsynthese von Malonsäure, die 1858 durchgeführt wurde, umfasste die oxidative Zersetzung von Apfelsäure mithilfe von Kaliumdichromat. Diese Methode wird heute nicht mehr häufig angewendet.
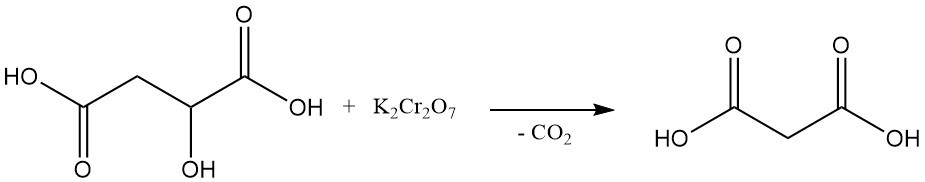
4. Verwendung von Malonsäure
Malonsäure wird als Baustein für verschiedene organische Verbindungen verwendet, da sie unter milden Bedingungen durch Knoevenagel-Kondensation und anschließende Decarboxylierung einen Essigsäurerest einführen kann. Beispiele für aus Malonsäure synthetisierte Verbindungen sind:
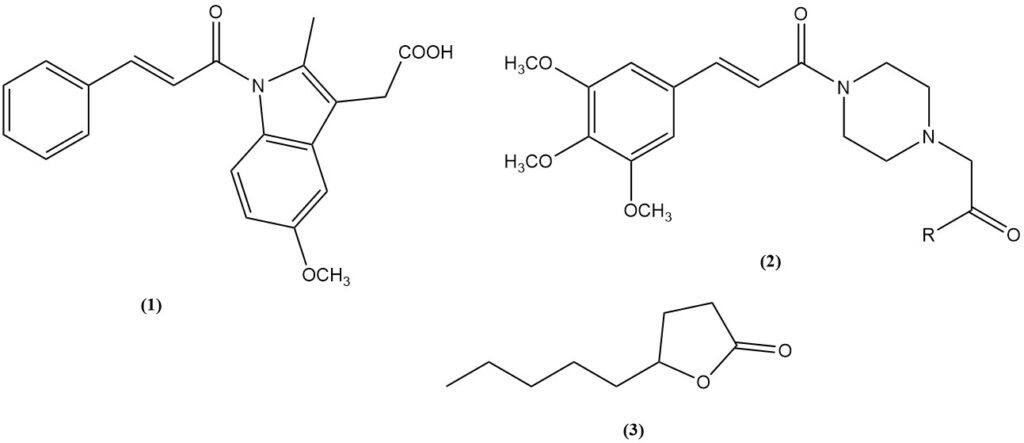
- Zimtsäure ist ein Vorläufer des entzündungshemmenden Arzneimittels Cinmetacin (1).
- 3,4,5-Trimethoxyzimtsäure: Ein Zwischenprodukt der Vasodilatatoren Cinepazet (2, R = OEt) und Cinepazid (2, R = 1-Pyrrolidinyl).
- γ-Nonanollacton (3): Eine wohlriechende Verbindung, die durch Knoevenagel-Kondensation von Malonsäure mit Heptaldehyd und anschließende Cyclisierung gewonnen wird.
Malonsäure wird auch bei der Herstellung von technischen Kunststoffen mit gewünschten Eigenschaften, biologisch abbaubaren Behältern, Barbituraten und Beschichtungen verwendet.
5. Toxikologie von Malonsäure
Malonsäure gilt als mäßig toxisch und wirkt sich hauptsächlich auf Augen und Haut aus. Folgende toxikologische Daten sind verfügbar:
Akute orale Toxizität: LD50 (oral, Ratte): 2750 mg/kg
Malonsäure kann die Haut reizen (leichte Hautreizung bei Kaninchen) und bei Kontakt schwere Augenschäden verursachen. In Sicherheitsdatenblättern (SDB) wird empfohlen, geeignete persönliche Schutzausrüstung (PSA) zu tragen, um den Kontakt zu vermeiden.
Es gibt keine leicht verfügbaren Daten zu chronischen gesundheitlichen Auswirkungen auf den Menschen.
Das Einatmen von Malonsäurestaub kann ebenfalls schädlich sein, obwohl spezifische Daten möglicherweise begrenzt sind.
Die spezifischen Auswirkungen einer Malonsäureexposition können je nach Faktoren wie Menge, Dauer der Exposition und Aufnahmeweg (Einatmen, Verschlucken, Hautkontakt) variieren.
Wie bei jeder Chemikalie ist es wichtig, Malonsäure gemäß den empfohlenen Sicherheitsprotokollen zu handhaben, die in den Sicherheitsdatenblättern (SDB) beschrieben sind.
Referenzen
- Malonic Acid and Derivatives; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/abs/10.1002/14356007.a16_063.pub2
- Malonic acid. – https://www.acs.org/molecule-of-the-week/archive/m/malonic-acid.html
- The Knoevenagel Reaction. – https://www.sciencedirect.com/science/article/abs/pii/B9780080523491000330
- https://beta-static.fishersci.com/content/dam/fishersci/en_US/documents/programs/education/regulatory-documents/sds/chemicals/chemicals-m/S25416.pdf
