Ácido Salicílico: Propiedades, Producción, Usos y Derivados
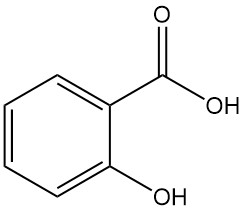
El ácido salicílico, también conocido como ácido 2-hidroxibenzoico o ácido o-hidroxibenzoico, es un compuesto aromático con la fórmula C7H6O3. Es un sólido cristalino incoloro e inodoro que se encuentra naturalmente en muchas plantas, principalmente en forma de ésteres.
La evidencia de su uso medicinal se remonta a la antigua Grecia. Hace unos 2.400 años, Hipócrates prescribía decocciones de corteza de sauce para tratar la fiebre y el dolor. Este efecto terapéutico se puede atribuir al ácido salicílico, el ingrediente activo de la corteza de sauce.
La biosíntesis del ácido salicílico en las plantas se produce mediante la desaminación de la fenilalanina a ácido transcinámico, que se hidroliza y oxida aún más en el carbono beta para producir ácido salicílico.
Los ésteres de salicilato abundan en varios géneros de plantas, incluidos Salix (sauce), Spiraea (reina de los prados) y Gaultheria (gaulteria). Por ejemplo, el salicilato de metilo, un derivado del ácido salicílico, está presente en altas concentraciones como glucósido en la corteza de abedul, ciertas especies de Spiraea y las hojas de gaulteria.
El ácido salicílico fue aislado por primera vez en 1838 por R. Piria tratando el salicilaldehído (derivado de la reina de los prados) con hidróxido de potasio. Seis años más tarde, C. Cahours, un químico francés, obtuvo ácido salicílico hidrolizando salicilato de metilo.
La producción de ácido salicílico fue lograda en 1874 por H. Kolbe, un químico alemán, mediante la carboxilación del fenóxido de sodio, un proceso que aún se emplea en la actualidad.
El ácido salicílico y sus derivados son importantes en diversas industrias. Sirven principalmente como precursores para la síntesis de productos farmacéuticos, colorantes, agroquímicos y productos de perfumería.
Tabla de contenido
1. Propiedades físicas del ácido salicílico
El ácido salicílico es un ácido o-hidroxicarboxílico aromático que presenta enlaces de hidrógeno intramoleculares. Esto, a diferencia de sus isómeros meta y para, mejora la volatilidad del vapor y su tendencia a la sublimación. Además, la acidez del ácido salicílico es significativamente mayor en comparación con el ácido 3-hidroxibenzoico (isómero meta) y el ácido 4-hidroxibenzoico (isómero para).
Las propiedades físicas importantes del ácido salicílico se enumeran en la Tabla 1.
| Propiedad | Valor |
|---|---|
| Número CAS | 69-72-7 |
| Fórmula | C7H6O3 |
| Masa molar | 138,12 g/mol |
| Estructura cristalina | Agujas incoloras (agua) o prismas monoclínicos (etanol) |
| Punto de fusión | 159°C |
| Sublimación | Comienza a 76 °C |
| Punto de inflamación (copa cerrada) | 157 °C |
| Calor de sublimación | 81,8 kJ/mol |
| Densidad | 1.443 |
| Constantes de disociación | K₁ = 1,05 × 10-3 K₂ = 4,0 × 10-14 (19 °C) |
| Presión de vapor | 1,66 mbar (110 °C) 19,3 mbar (150 °C) |
| Solubilidad | |
| Disolvente | Solubilidad |
| Metanol | 38,46 g/100 g (21 °C) |
| Etanol | 34,87 g/100 g (21 °C) |
| Cloroformo | 1,55 g/100 g (30 °C) |
| Benceno | 1,00 g/100 g (30 °C) |
| Éter dietílico | 23,4 g/100 ml (17 °C) |
| Acetona | 31,3 g/100 ml (23 °C) |
| Amoníaco | Extremadamente soluble |
| Dióxido de azufre líquido | Insoluble |
La solubilidad del ácido salicílico en agua depende de la temperatura, como se muestra en la Tabla 2.
| Temperatura (°C) | Solubilidad (g/L) |
|---|---|
| 0 | 0,8 |
| 10 | 1.2 |
| 20 | 1.8 |
| 40 | 3.7 |
| 60 | 8.2 |
| 80 | 20,5 |
2. Reacciones químicas del ácido salicílico
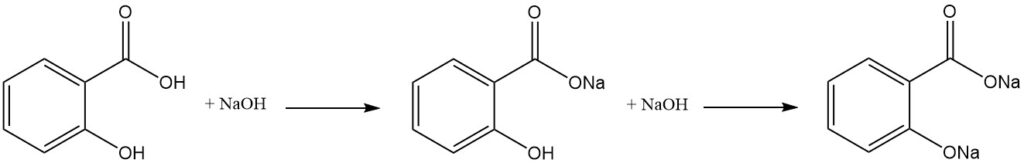
El ácido salicílico es una molécula difuncional que tiene propiedades características tanto de los fenoles como de los ácidos carboxílicos aromáticos. Debido a la diferencia de acidez entre los grupos hidroxilo y carboxílico, un equivalente de una base fuerte neutraliza selectivamente el grupo carboxilo.
La formación de la sal dialcalina requiere un exceso de base, mientras que la exposición posterior al dióxido de carbono da como resultado la reformación del grupo hidroxilo libre.
La quelación con ciertos iones metálicos, como el Fe(III), forma complejos de color violeta. Esta propiedad permite utilizar el ácido salicílico como indicador en valoraciones con EDTA para Fe (III).
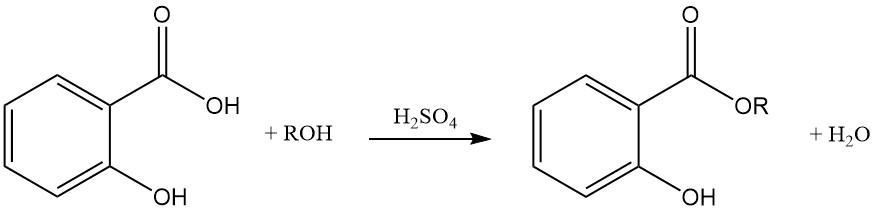
La reacción del ácido salicílico con alcoholes utilizando ácidos fuertes como catalizadores produce ésteres con una formación mínima de éter como producto secundario. La esterificación también se puede lograr con haluros de acilo o anhídridos de ácido.
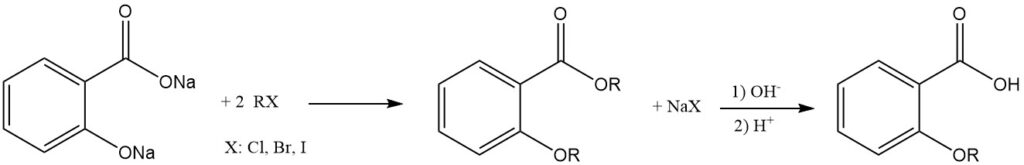
El salicilato dialcalino reacciona con haluros de alquilo para producir ésteres de éter combinados. El tratamiento de estos productos con una base los hidroliza a los correspondientes ácidos alcoxibenzoicos.
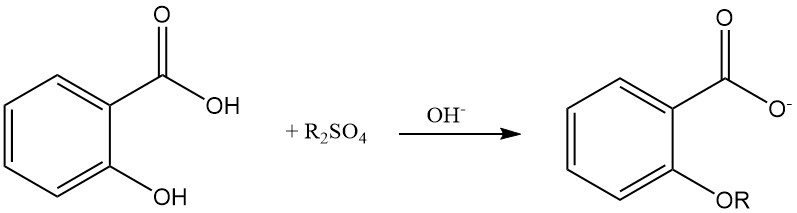
La eterificación del grupo hidroxilo fenólico del ácido salicílico es posible utilizando sulfato de dialquilo en una solución acuosa alcalina.
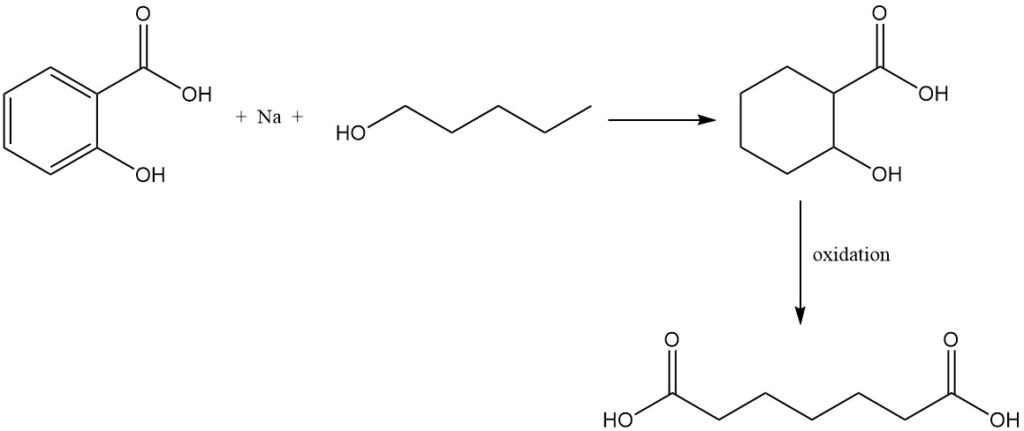
La reducción del ácido salicílico con sodio y alcohol amílico forma ácido tetrahidrosalicílico que, tras la oxidación, produce ácido pimélico.
La hidrogenación catalítica de ésteres de ácido salicílico utilizando níquel Raney produce ésteres de ácido cis-trans-2-hidroxiciclohexanocarboxílico.
Las reacciones de sustitución electrofílica favorecen la posición 5 menos obstaculizada del anillo aromático. Esta regioselectividad permite la síntesis directa de derivados del ácido salicílico 5-sustituidos o 3,5-disustituidos.
Ejemplos de sustitución electrófila del ácido salicílico incluyen nitración, sulfonación, halogenación, alquilación, acilación y acoplamiento con sales de diazonio, que normalmente produce productos 5-sustituidos.
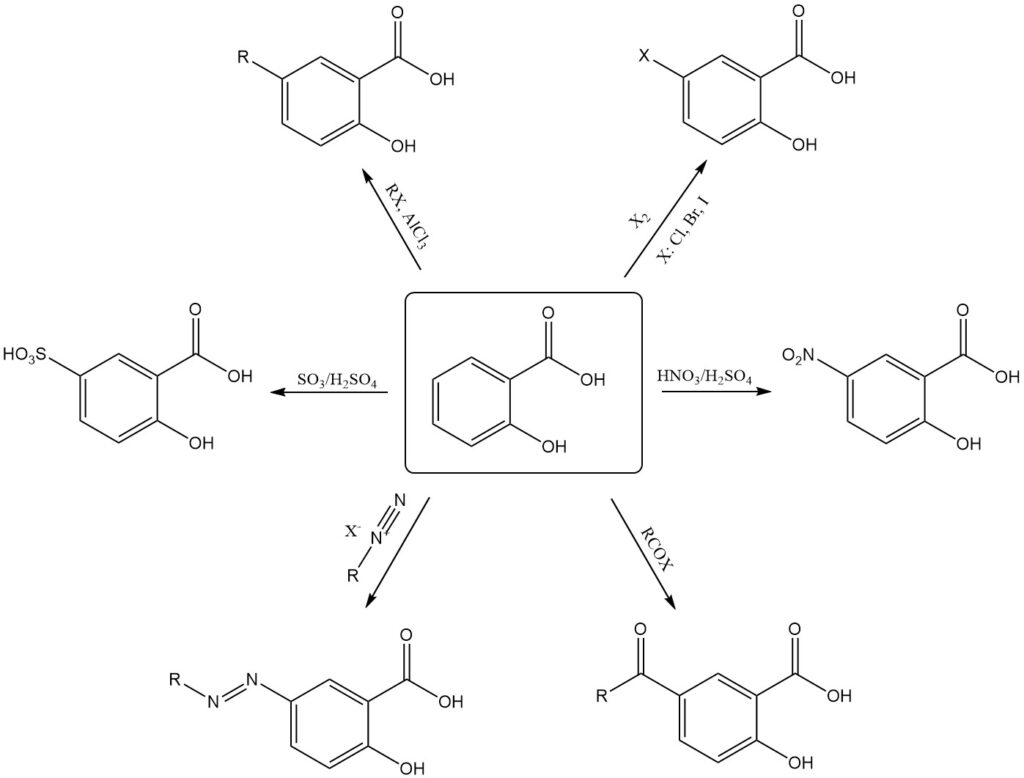
Los derivados salicílicos sustituidos en la posición 3 requieren métodos indirectos como la sustitución del ácido sulfosalicílico en la posición 5, seguida de la eliminación del grupo ácido sulfónico. Sin embargo, condiciones de reacción más duras pueden conducir a la descarboxilación.
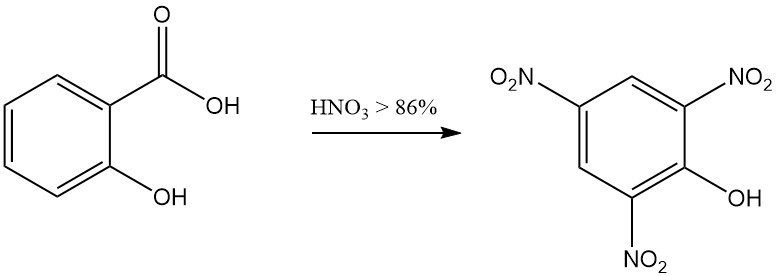
Por ejemplo, la reacción del ácido salicílico con ácido nítrico fumante da como resultado la formación de 2,4,6-trinitrofenol (ácido pícrico) y la reacción con bromo en presencia de agua produce tribromofenol.
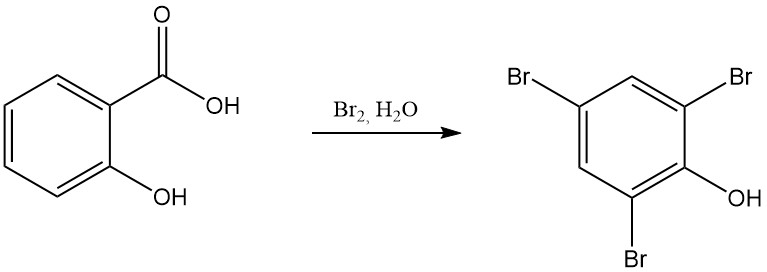
La descomposición térmica del ácido salicílico en o por encima de su punto de fusión da fenol y dióxido de carbono. En una atmósfera de dióxido de carbono a 230 °C, el producto principal es el salicilato de fenilo. A temperaturas más altas (250 °C), se forma xantona junto con el fenol.
3. Producción de ácido salicílico
3.1. Producción de ácido salicílico mediante síntesis de Kolbe-Schmitt
El ácido salicílico se prepara comercialmente mediante la reacción de Kolbe-Schmitt. Este proceso implica hacer reaccionar fenóxido de sodio seco con dióxido de carbono bajo presión (5 bar) y a temperaturas que oscilan entre 150 y 160 °C.
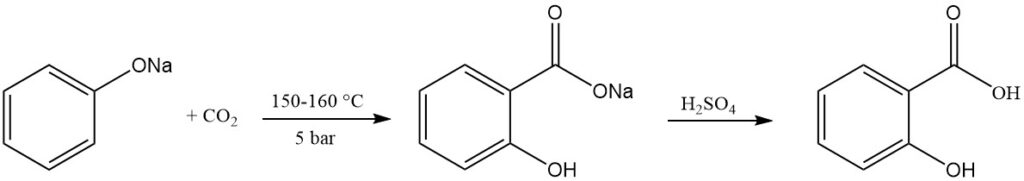
En 1884, Schmitt descubrió que el uso de presión mejoraba el rendimiento hasta alrededor del 90% en comparación con la reacción original de Kolbe en 1874, que arrojaba sólo alrededor del 50% a presión normal. Sin presión, se forman salicilato disódico y fenol en cantidades iguales.
El mecanismo exacto de la reacción de Kolbe-Schmitt sigue siendo un tema de discusión. Se han propuesto muchas sugerencias en la literatura, tales como:
- El ácido 4-hidroxiisoftálico puede actuar como intermediario, liberando CO2 o sometiéndose a carboxilación del fenolato para formar ácido salicílico.
- La formación de complejos entre fenol, CO2 y un metal alcalino podría facilitar la sustitución electrofílica en el fenóxido.
La temperatura, el tipo de metal alcalino utilizado y la presión del CO2 afectan significativamente la reactividad y selectividad del anión fenóxido.
En la Figura 1 se presenta una descripción general simplificada de la síntesis industrial de ácido salicílico.
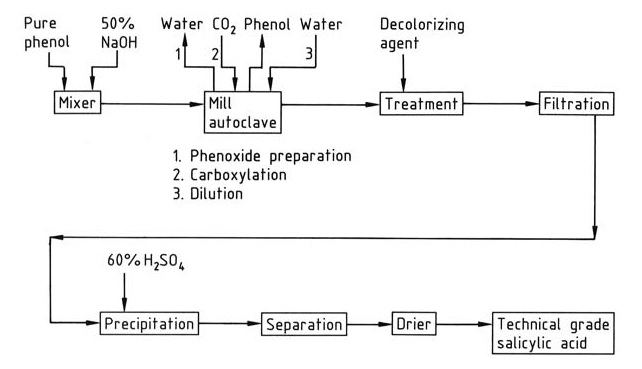
La carboxilación se produce en autoclaves equipados con agitadores o dispositivos de molienda. La mezcla de reacción debe estar finamente molida y rigurosamente libre de agua para garantizar un rendimiento óptimo. El agua reduce el rendimiento al convertir el fenóxido en fenol y promover la formación de carbonato.
Se utiliza un ligero exceso molar (1-2%) de hidróxido de sodio para preparar fenóxido de sodio. Grandes cantidades de sosa cáustica provocan la formación de agua. El fenóxido de sodio anhidro se prepara mediante la evaporación de una solución acuosa de fenóxido de sodio dentro del propio mezclador del autoclave, aplicando vacío después de alcanzar la presión normal o utilizando un equipo de secado exclusivo.
El dióxido de carbono utilizado en la reacción debe tener un contenido mínimo de oxígeno (<0,1%) para evitar la decoloración y la formación de alquitrán.
La reacción exotérmica de carboxilación convierte el fenóxido de sodio en ácido salicílico. El salicilato de sodio crudo resultante se disuelve en agua, se trata con un agente decolorante (por ejemplo, carbón activado, aluminio o zinc en polvo) y luego se precipita con ácido sulfúrico.
El fenol sin reaccionar se recupera de la mezcla de salicilato de sodio en bruto mediante destilación.
Como alternativa, el proceso continuo utiliza una solución de fenóxido anhidro en un disolvente adecuado, como el propio fenol, alcoholes superiores, dialquilcetonas o nitrobenceno.
3.2. Producción de ácido salicílico mediante otros procesos
Se han explorado otros métodos alternativos para producir ácido salicílico:
- Oxidación al aire de o-cresolato a 230 °C con un catalizador a base de cobre o benzoato de cobre a 175-215 °C.
- Calentar benzoato de cobre alcalino directamente puede producir salicilato.
- La hidrólisis del ácido 2-benzoiloxibenzoico, un intermedio en el proceso Dow para la producción de fenol, conduce a la formación de ácido salicílico.
- La fermentación de compuestos aromáticos policíclicos como la naftaleno por parte de ciertos microorganismos puede producir ácido salicílico.
4. Usos del ácido salicílico
El ácido salicílico se utiliza principalmente como precursor del ácido acetilsalicílico (aspirina), el fármaco más dispensado a nivel mundial. Además, los ésteres, amidas y sales del ácido salicílico son materiales de partida para otros productos farmacéuticos.
El ácido salicílico de grado técnico se utiliza como intermediario en la producción de agroquímicos, tintes y colorantes, productos de caucho y resinas fenólicas.
El propio ácido salicílico posee efectos terapéuticos en el tratamiento de enfermedades reumáticas. Normalmente se administra en forma de sal de sodio altamente soluble para este fin.
Debido a sus propiedades queratolíticas (capacidad de descomponer la queratina), el ácido salicílico se utiliza en diversos productos para el cuidado de la piel para limpiar y eliminar escamas.
El ácido salicílico es un bactericida que se utiliza en algunos desinfectantes o conservantes. Sin embargo, está prohibido su uso en productos alimenticios.
Recientemente, se ha utilizado como regulador del crecimiento y la floración de las plantas y contra diversos estreses abióticos y bióticos.
El ácido acetilsalicílico representa aproximadamente el 55% del mercado total del ácido salicílico, seguido de los ésteres y sales (18%), resinas (10%) y tintes y colorantes (10%).
La introducción de analgésicos más nuevos que compiten directamente con la aspirina ha impactado el mercado del ácido salicílico, lo que ha provocado una disminución en el consumo de aspirina. Sin embargo, el posible descubrimiento de nuevas aplicaciones del ácido salicílico podría estabilizar el mercado en el futuro.
5. Derivados del ácido salicílico
El ácido salicílico forma sales fácilmente al reaccionar con carbonatos metálicos. Para evitar la decoloración, se recomienda mantener las soluciones salinas acuosas ligeramente ácidas. Las sales se obtienen en forma sólida concentrando sus soluciones.
5.1. Salicilato de Sodio
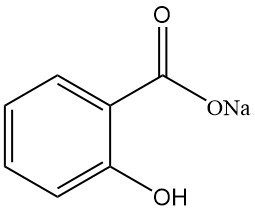
- Fórmula: NaC7H5O3
- Número CAS: 54-21-7
- Masa molar: 160,11 g/mol
- Apariencia: Escamas cristalinas blancas, inodoros y brillantes
- Solubilidad:
- Agua: 125 g/100 ml (25 °C)
- Etanol: 17 g/100 ml (15 °C)
El salicilato de sodio de calidad técnica se produce mediante la evaporación de una solución de salicilato de sodio, y el salicilato de sodio de calidad farmacéutica se prepara mediante la doble cristalización de salicilato de sodio hexahidrato a partir de una solución acuosa al 45 % a 10 °C.
Se utiliza como agente analgésico, antipirético y antineurálgico.
Existen muchas otras sales de salicilato, incluidas las de amonio, magnesio, calcio y aluminio, así como el salicilato de morfolina. Muchas de estas sales están disponibles con varios nombres comerciales.
5.2. Salicilato de metilo
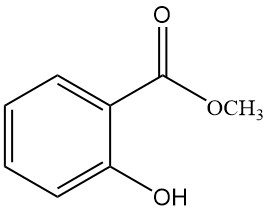
- Fórmula: C8H8O3
- Número CAS: 119-36-8
- Masa molar: 152,15 g/mol
- Apariencia: Líquido aceitoso incoloro con un olor característico
- Punto de fusión: -9 °C
- Punto de ebullición: 222 °C
- Densidad: 1,184 g/mL
El salicilato de metilo se produce calentando una mezcla de ácido salicílico y metanol con ácido sulfúrico.
Se utiliza en el tratamiento de neuralgias y reumatismos, estimulando la circulación sanguínea capilar, como insecticida, protector solar, como fragancia e intermediario sintético.
5.3. Salicilato de bencilo
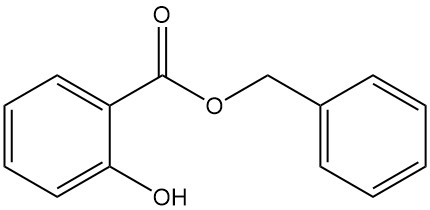
- Fórmula: C14H12O3
- Número CAS: 118-58-1
- Masa molar: 228,25 g/mol
- Apariencia: Líquido transparente o masa cristalina de incolora a opaca con un olor característico
- Punto de fusión: 24 °C
- Punto de ebullición: 318 °C
- Densidad: 1,180 g/mL (a 15 °C)
El salicilato de bencilo se produce por la reacción entre el salicilato de sodio y el cloruro de bencilo o por la transesterificación del salicilato de metilo con alcohol bencílico.
Se encuentra en los aceites de ylang-ylang y clavel y se utiliza como aditivo en jabones, detergentes y perfumes.
5.4. Salicilato de isoamilo
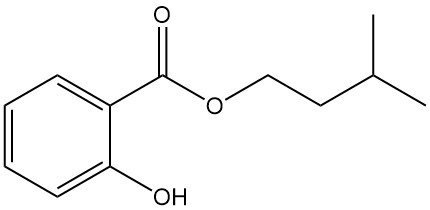
- Fórmula: C12H16O3
- Número CAS: 87-20-7
- Masa molar: 208,26 g/mol
- Apariencia: Líquido incoloro con fragancia de orquídeas
- Punto de ebullición: 270 °C
- Densidad: 1,050 g/mL (a 20 °C)
El salicilato de isoamilo se utiliza como estabilizador de fragancias en perfumería y como agente antirreumático tópico.
5.5. Salicilato de fenilo
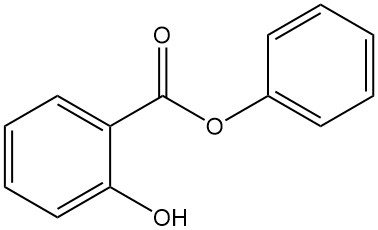
- Fórmula: C13H10O3
- Número CAS: 118-55-8
- Masa molar: 241,22 g/mol
- Apariencia: polvo cristalino incoloro
- Punto de fusión: 43 °C
- Punto de ebullición: 172 °C (a 16 mbar)
El salicilato de fenilo se prepara mediante la reacción entre el ácido salicílico y el fenol con ácido sulfúrico o mediante la transesterificación del salicilato de metilo con fenóxido de sodio.
Se utiliza como antiséptico, conservante, en protectores solares, como fotoprotector general para productos sintéticos y como emoliente.
5.6. Ácido acetilsalicílico (aspirina)
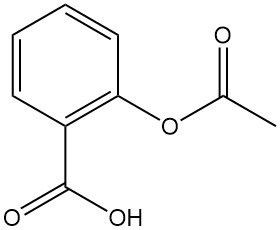
El ácido acetilsalicílico, también conocido por el nombre comercial de aspirina, es un derivado clave del ácido salicílico. A continuación se desglosan sus propiedades y aplicaciones:
Propiedades físicas:
- Fórmula: C9H8O4
- Masa molar: 180,15 g/mol
- Apariencia: Agujas incoloras o polvo cristalino (dependiendo del disolvente de cristalización)
- Punto de fusión: 143–144 °C
- Solubilidad: baja en agua (0,25 g/100 ml a 15 °C), pero más soluble en etanol (20 g/100 ml a 25 °C)
- Constante de disociación (K): 2,8 x 10-4 (a 25 °C)
El ácido acetilsalicílico se sintetiza haciendo reaccionar anhídrido acético con ácido salicílico a temperaturas inferiores a 90 °C. En el proceso se pueden utilizar diversos disolventes y catalizadores (ácidos o aminas terciarias).
El ácido acetilsalicílico es un conocido agente antipirético (reductor de fiebre), analgésico, antiinflamatorio y antirreumático. También posee propiedades antitrombóticas y anticoagulantes, que reducen la formación de coágulos sanguíneos.
6. Toxicología del ácido salicílico
El ácido salicílico y sus derivados se absorben fácilmente a través de la piel y las membranas mucosas. Las formas éster del ácido salicílico sufren hidrólisis en el cuerpo debido a la acción de enzimas llamadas esterasas.
La vía de eliminación del ácido salicílico depende del pH de la orina:
- Orina ácida: el ácido salicílico se oxida a ácido gentísico.
- Orina alcalina: el ácido salicílico se elimina por los riñones como ácido salicilurético o salicilato de glucurónido.
Dado que la absorción puede ser más rápida que la eliminación, la acumulación de ácido salicílico en el cuerpo puede ocurrir bajo ciertas condiciones.
Efectos biológicos
El ácido salicílico tiene actividad queratolítica, lo que significa que promueve la muda de la capa más externa de la piel. También puede irritar los tejidos de la piel, particularmente en el estómago, donde afecta las células productoras de moco. El uso prolongado de salicilatos puede retardar la coagulación sanguínea al reducir la agregación plaquetaria.
El ácido salicílico y sus derivados inhiben la síntesis de prostaglandinas, contribuyendo a sus propiedades antiinflamatorias. Estos compuestos presentan efectos analgésicos y antipiréticos.
El ácido salicílico y sus derivados pueden actuar como fungicidas y agentes bacteriostáticos.
Se conocen reacciones de hipersensibilidad cutánea y pulmonar a los salicilatos, aunque no siempre son verdaderas alergias. Puede estar implicada una síntesis reducida de prostaglandinas. Se ha observado sensibilización cruzada entre diferentes formas de salicilato, como el salicilato de metilo y la aspirina.
Toxicidad
Las dosis únicas de ácido salicílico que superan los 10 gramos pueden ser mortales. La principal preocupación es la alteración del equilibrio ácido-base del cuerpo. Los síntomas incluyen delirio, temblores, problemas respiratorios, sudoración, deshidratación, fiebre y coma.
La intoxicación menos grave se presenta con hiperventilación, zumbidos en los oídos, náuseas, vómitos, problemas de visión o audición, mareos y alteraciones del sistema nervioso.
El uso crónico puede provocar problemas digestivos, dolor estomacal e intestinal y, en ocasiones, hemorragias graves y ocultas. También puede ocurrir anemia inducida por salicilatos, debido a la deficiencia de hierro por sangrado oculto. En pacientes de edad avanzada, la intoxicación crónica puede manifestarse como confusión y agitación.
A pesar del posible daño tisular, la administración crónica de ácido salicílico puro no se ha relacionado con problemas hepáticos o renales.
Los estudios en animales sugieren que las dosis altas de ácido salicílico y sus derivados pueden presentar riesgos de defectos de nacimiento. Sin embargo, esto no se ha confirmado en humanos y se cree que unas condiciones de trabajo e higiene adecuadas reducen estas preocupaciones.
Referencias
- Salicylic Acid; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a23_477
- Analgesics (N02); Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/9783527306732.a02_269.pub4
- Salicylic Acid: A Regulator of Plant Growth and Development
- Salicylic Acid. – https://www.sciencedirect.com/science/article/abs/pii/B9780080552323625759
