Aminophenol: Produktion, Reaktionen und Verwendungen

Aminophenole haben eine erhebliche kommerzielle Bedeutung erlangt, sowohl als eigenständige Substanzen als auch als entscheidende Komponenten in der Chemie- und Farbstoffbranche.
Diese Verbindungen besitzen amphotere Eigenschaften, die die Eigenschaften schwacher Säuren oder schwacher Basen aufweisen, wobei der basische Charakter typischerweise vorherrscht.
Insbesondere 2-Aminophenol und 4-Aminophenol können leicht oxidiert werden, eine Eigenschaft, die zu ihrer primären Verwendung als fotografische Entwickler beiträgt. Allerdings bleibt 3-Aminophenol an der Luft relativ stabil und oxidiert nicht.
Inhaltsverzeichnis
1. Physikalische Eigenschaften von Aminophenolen
Die grundlegenden Aminophenolstrukturen liegen in drei verschiedenen isomeren Konfigurationen vor, die durch die räumliche Anordnung der Hydroxyl- und Aminogruppen neben dem Benzolring bestimmt werden. Diese Verbindungen verfestigen sich typischerweise bei normaler Raumtemperatur zu kristallinen Strukturen.
Die auf dem Markt erhältlichen Aminophenolverbindungen sind aufgrund einer möglichen Kontamination durch Oxidationsnebenprodukte häufig unrein. Infolgedessen können sie Farbtöne aufweisen, die von gelbbraun bis rosaviolett reichen, wobei das 2- und 4-Aminophenol im Vergleich zum 3-Isomer anfälliger für diese Farbveränderung ist.
1.1. Physikalische Eigenschaften von 2-Aminophenol
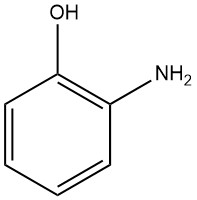
2-Aminophenol, auch bekannt als 2-Hydroxyanilin oder 2-Amino-1-hydroxybenzol, hat die chemische Formel C6H7NO und eine Molmasse von 109,13 g/mol. Wenn es aus Wasser oder Benzol kristallisiert, bildet es weiße orthorhombische bipyramidale Nadeln.
Der Schmelzpunkt dieser Kristalle liegt bei 174 °C und ihre Dichte beträgt etwa 1,328 g/cm3 (in einigen Quellen wird auch 1,29 g/cm3 erwähnt). Unter reduziertem Druck (1,47 kPa) sublimiert 2-Aminophenol schnell bei 153 °C ohne Zersetzung.
Bezüglich seiner Säure-Base-Eigenschaften lauten die Dissoziationskonstanten wie folgt: pK1 beträgt 4,72 bei 21 °C in Wasser und 4,66 bei 25 °C in einer Lösung von 1 % Ethanol in Wasser; pK2 beträgt 9,66 bei 15 °C und 9,71 bei 22 °C in Wasser.
Die Verbindung kann verschiedene Salze bilden, darunter das Hydrochloridsalz, das als Nadeln erscheint und einen Schmelzpunkt von 207 °C hat; das Formiatsalz, das bei 120°C schmilzt; das Oxalatsalz, das sich bei 167,5°C zersetzt; und das Acetatsalz, das bei 150°C schmilzt.
2-Aminophenol ist in Aceton, Acetonitril, Dimethylsulfoxid, Ethanol und Ethylacetat sehr gut löslich, in heißem Wasser und Diethylether löslich und in Chloroform, Benzol, Toluol und kaltem Wasser schwer löslich.
1.2. Physikalische Eigenschaften von 3-Aminophenol

3-Aminophenol, auch 3-Hydroxyanilin oder 3-Amino-1-hydroxybenzol genannt, hat die chemische Formel C6H7NO mit einer Molmasse von 109,13 g/mol. Diese Verbindung bildet bei der Kristallisation aus Wasser oder Toluol weiße Prismen und ihr Schmelzpunkt liegt zwischen 122 und 123 °C.
Die orthorhombischen Kristalle weisen eine tetramolekulare Anordnung auf und besitzen eine Dichte von etwa 1,195 g/cm3 (alternative Werte von 1,206 und 1,269 wurden ebenfalls angegeben). Unter vermindertem Druck (1,47 kPa) siedet 3-Aminophenol bei 164 °C unter leichter Zersetzung.
Bezüglich seiner Säure-Base-Eigenschaften lauten die Dissoziationskonstanten wie folgt: pK1 beträgt 4,17 bei 21 °C in Wasser und 4,31 bei 25 °C in einer Lösung, die 1 % wässriges Ethanol enthält; pK2 beträgt 9,87 bei 22 °C in Wasser.
3-Aminophenol kann verschiedene Salze bilden, darunter das Hydrochloridsalz, das die Form von Prismen annimmt und bei 229 °C schmilzt; das Hydrobromidsalz, ebenfalls prismatisch, mit einem Schmelzpunkt von 224°C; das Hydroiodidsalz, ebenfalls prismatisch, mit einem Schmelzpunkt von 209°C; das Sulfatsalz liegt in Form von Plättchen oder Nadeln vor und schmilzt bei 152 °C; und das Oxalatsalz mit einem Schmelzpunkt von 275°C.
3-Aminophenol ist in Aceton, Acetonitril, Dimethylsulfoxid, Ethanol, Ethylacetat und heißem Wasser sehr gut löslich, in kaltem Wasser und Diethylether löslich und in Chloroform, Benzol und Toluol schwer löslich.
1.3. Physikalische Eigenschaften von 4-Aminophenol
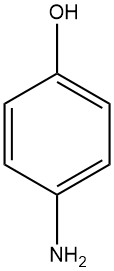
4-Aminophenol, bekannt als 4-Hydroxyanilin oder 4-Amino-1-hydroxybenzol, hat die chemische Formel C6H7NO mit einem Molekulargewicht von 109,13 g/mol. Bei der Kristallisation aus Wasser nimmt es die Form weißer Plättchen an und hat einen Schmelzbereich von 189 bis 190 °C (Zersetzung tritt ein).
Die Kristalle existieren in zwei unterschiedlichen Formen. Die stabilere „α“-Form (erhalten aus Alkohol, Wasser oder Ethylacetat) hat eine orthorhombische Pyramidenstruktur mit vier Molekülen in jeder Elementarzelle. Es hat eine Dichte von etwa 1,290 g/cm3 (alternativ wird auch 1,305 g/cm3 angegeben).
Die weniger stabile „β“-Form (Kristallisation aus Aceton) präsentiert sich als nadelförmige Kristalle, die sich mit der Zeit in die „α“-Form umwandeln. Die Kristalle der „β“-Form sind orthorhombisch-bipyramidal oder pyramidenförmig und weisen eine hexamolekulare Anordnung auf.
Bei reduziertem Druck (40 Pa) sublimiert 4-Aminophenol bei 110 °C unter leichter Zersetzung. Die Siedepunkte unter verschiedenen Drücken sind wie folgt: 284 °C (101,3 kPa), 174 °C (1,47 kPa), 167 °C (1,07 kPa), 150 °C (0,4 kPa) und 130,2 °C (0,04 kPa). wobei es in der Regel zu Zersetzung kommt.
Die Säure-Base-Dissoziationskonstanten für diese Verbindung sind wie folgt: pK1 beträgt 5,50 bei 21 °C in Wasser, 4,86 bei 30 °C in Wasser und 5,48 in einer Lösung mit 1 % wässrigem Ethanol bei 25 °C; pK2 beträgt 10,30 bei 22 °C in Wasser und 10,60 bei 30 °C in Wasser.
Es können verschiedene Salze von 4-Aminophenol gebildet werden, darunter das Hydrochloridsalz, das als Prismen vorliegt und bei Erreichen von 306 °C zerfällt; das Hydrosulfatsalz, das als Nadeln mit einem Schmelzpunkt von 272 °C erscheint; das Oxalatsalz, das bei 183°C schmilzt; das Acetatsalz, schmelzend bei 183°C; das Chloracetatsalz bildet Nadeln mit einem Schmelzpunkt von 148°C; und das Trichloracetatsalz in Form von Nadeln mit einem Schmelzpunkt von 166 °C.
4-Aminophenol ist in Dimethylsulfoxid sehr gut löslich, in Aceton, Acetonitril, Ethylacetat und heißem Wasser und Diethylether löslich, in Ethanol, Diethylether, Toluol und kaltem Wasser schwer löslich und in Benzol und Chloroform unlöslich.
2. Chemische Reaktionen von Aminophenolen
Detaillierte Diskussionen über die chemischen Eigenschaften und Reaktionen von Aminophenolen sind ausführlich in etablierten Referenzen auf diesem Gebiet dokumentiert. Einen kompakten Überblick finden Sie hier.
Das Vorhandensein einer Aminogruppe im Benzolring unterdrückt den Säuregehalt von Phenolen, wobei 4-Aminophenol den stärksten Effekt zeigt. Aminophenole wirken als schwache Basen und bilden sowohl mit organischen als auch mit anorganischen Säuren Salze.
Aminophenole sind Ampholyte ohne Zwitterionenstruktur. Abhängig vom pH-Wert der Lösung liegen sie als neutrale Moleküle, Ammoniumkationen oder Phenolatanionen vor.

Abweichungen von den theoretischen Säure-Base-Titrationskurven haben jedoch zur Hypothese von Halbsalzkomplexkationen B2+ geführt, die durch die Assoziation eines Ammoniumkations, B+, mit einem neutralen Molekül, B, entstehen. Dieses Phänomen ist besonders bei 4-Aminophenol auffällig und ist es auch auch bei anderen Isomeren nachgewiesen.
Aminophenole sind chemisch reaktiv und nehmen an Reaktionen teil, an denen sowohl die aromatische Aminogruppe als auch die phenolische Hydroxylgruppe beteiligt sind, sowie an der Substitution des Benzolrings.
Oxidation führt zur Entwicklung leuchtend gefärbter polymerer Chinoidstrukturen. 2-Aminophenol durchläuft eine Reihe von Cyclisierungsreaktionen.
2.1. Alkylierung von Aminophenolen
Es können alle mono-, di- und trimethylierten Aminophenole gebildet werden. Die Monoalkylierung erfolgt durch Erhitzen des Aminophenols mit einem geeigneten Alkylhalogenid, einem Alkohol in Gegenwart von Raney-Nickel oder Aldehyden und Ketonen als Alternativen zu Alkohol.
Die direkte Alkylierung der Hydroxylgruppe zur Herstellung von Methoxyanilinen (Anisidinen) oder Ethoxyanilinen (Phenetidinen) ist aufgrund der Reaktivität der Aminogruppe kompliziert und führt häufig zu gemischten alkylierten Produkten.
Die Methylierung von 3-Aminophenol unter alkalischen Bedingungen ergibt 3-Methoxyanilin, obwohl ein häufigerer Ansatz den Schutz einer Aminogruppe gefolgt von der Methylierung von 3-Acetylanilinen und anschließender Hydrolyse beinhaltet.
Andere Anisidine und Phenetidine werden typischerweise indirekt durch Reduktion von Nitroanalogen hergestellt:

2.2. Acylierung von Aminophenolen
Die Acylierung von Aminophenolen unter Verwendung von Essigsäureanhydrid in Alkali oder Pyridin, Acetylchlorid und Pyridin in Toluol oder Keten in Ethanol führt im Allgemeinen zu N-acylierten Produkten. Übermäßiger Reagenzienverbrauch, insbesondere bei 2-Aminophenol, führt zu O,N-diacylierten Produkten.
Aminophenylcarboxylate (O-acylierte Aminophenole) werden typischerweise durch Reduktion entsprechender Nitrophenylcarboxylate hergestellt, ein Prozess, der für 4-Aminophenol-Derivate von besonderer Bedeutung ist.
Eine Wanderung der Acylgruppe von der O- zur N-Position wird sowohl in 2- als auch 4-Aminophenol-acylierten Produkten beobachtet.
Ein Beispiel für eine Umlagerung ist die Bildung von 2-Hydroxyphenylcarbamat durch langsame Behandlung von 2-Aminophenylethylcarbonat in verdünnter Säure. Die para-Derivate zeigen keine Transformation.

2.3. Diazoniumsalzbildung
Die aromatischen Aminogruppen von Aminophenolen können durch Behandlung mit Natriumnitrit unter sauren wässrigen Bedingungen in Diazoniumsalze umgewandelt werden. Bei leicht oxidierbaren oder schwerlöslichen Aminophenolen können Probleme auftreten.
Kristalline Diazoniumsalze werden unter Verwendung von Hydrochlorid- oder Sulfatformen des entsprechenden Aminophenols unter wasserfreien Bedingungen isoliert. Diese Diazo-Derivate finden weitverbreitete Verwendung in der Farbstoffindustrie.
2.4. Cyclisierungsreaktionen von Aminophenolen
Aufgrund der engen Nachbarschaft der Amino- und Hydroxylgruppen in 2-Aminophenol ist dieses Isomer besonders anfällig für Cyclisierungs- und Kondensationsreaktionen. Durch Oxidation durch Eisen(III)-chlorid, Enzyme, Licht oder Autoxidation an Siliziumdioxid-Dünnschichtplatten entsteht 2-Aminophenoxazin-3-on (4).
Durch anschließende Oxidation mit Eisen(III)-cyanid oder Erhitzen mit Kaliumhydroxid in Ethanol entsteht eine Fünfringstruktur, Triphenoxdioxazin (Benzoxazinophenoxazin) (5).

2-Aminophenol und seine Derivate dienen als wertvolle Ausgangsmaterialien für die Synthese von Phenoxazonen, Phenoxazinen, Benzoxazolen und Thiobenzoxazolen, wobei die meisten dieser Reaktionen das Erhitzen auf 200–300 °C mit einem geeigneten Katalysator erfordern.
2.5. Kondensationsreaktionen
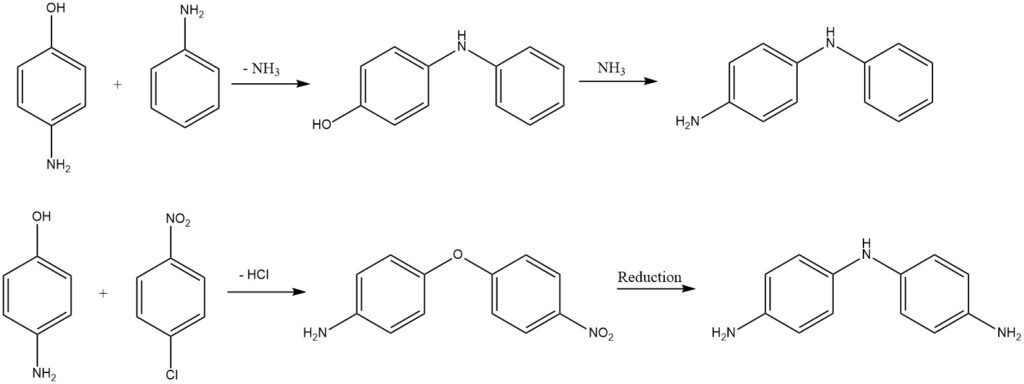
Substituierte Diphenylamine oder Diphenylether werden aus Aminophenolen durch Abspaltung von Ammoniak oder Chlorwasserstoff gewonnen.
2.6. Reaktionen des Benzolrings
Sowohl Amino- als auch Hydroxylgruppen fungieren als elektronenspendende Einheiten und führen zur Bildung verschiedener substituierter Derivate. Durch kontrollierte Wechselwirkungen zwischen Aminophenolen und Chlor oder Brom in Eisessig entsteht ein Spektrum an halogenierten Produkten.
Konzentrierte Schwefelsäure oder Oleum erzeugen mit oder ohne Hitze aromatische Sulfonsäuren. Die Sulfonsäuregruppe tritt vorwiegend in ortho- oder para-Stellung zur Hydroxylgruppe ein. Die weitere Behandlung mit Oleum führt zu disulfonierten Verbindungen.
Durch Carboxylierung von m-Aminophenol entsteht p-Aminosalicylsäure.
3. Produktion von Aminophenolen
Aminophenole werden hauptsächlich auf zwei Wegen synthetisiert: Reduktion von Nitrophenolen oder Substitutionsreaktionen. Die Reduktion kann mit Eisen oder Wasserstoff in Gegenwart eines Katalysators erreicht werden. Letzteres Verfahren ist heute die bevorzugte Methode zur Herstellung von 2- und 4-Aminophenol.
3.1. Reduzierung von Nitroverbindungen
3.1.1. Eisenreduktion
Die Reduktion von Nitrophenolen mittels Eisenspänen erfolgt in einer leicht sauren Lösung oder Suspension. Nach der Reduktion wird der Eisen-Eisenoxid-Schlamm von der Lösung abgetrennt. Um die Wasserlöslichkeit zu verbessern, wird Natriumhydroxid zugesetzt, wodurch Natriumaminophenolat entsteht.
Aufgrund der Oxidationsanfälligkeit in wässriger Lösung werden verschiedene Reinigungsmethoden empfohlen. Anschließend werden Aminophenole aus sauren Lösungen durch Basenneutralisation ausgefällt, häufig werden dabei Reduktionsmittel eingearbeitet.
Allerdings entstehen bei der Reduktion von 2-Nitrophenol mit Eisen unlösliche Farbseen als Nebenprodukte, die die Ausbeute verringern. Daher ist die industrielle Bedeutung der Eisenreduktion für 2-Nitrophenol begrenzt.
3.1.2. Katalytische Reduktion
Die katalytische Reduktion erfolgt hauptsächlich in Lösung, Emulsion oder Suspension in Autoklaven oder Druckbehältern. Nach der Katalysatorzugabe wird unter Druck stehender Wasserstoff in den Behälter eingeleitet. Bevorzugte Lösungsmittel umfassen Wasser und Methanol, wobei Wasser durch Alkalihydroxid, Alkalicarbonat oder Säure ergänzt wird.
Zum Einsatz kommen Katalysatoren wie Nickel – insbesondere Raney-Nickel – oder geträgerte Edelmetalle wie Platin oder Palladium auf Aktivkohle bzw. deren Oxide.
Die Zugabe nicht mischbarer organischer Lösungsmittel zu Wasser kann die Lebensdauer des Katalysators verlängern, den Verbrauch senken und die Produktqualität verbessern.
Typischerweise ist ein Wasserstoffdruck von 2 MPa optimal, obwohl auch atmosphärische oder höhere Drücke bis zu 6 MPa verwendet werden können. Die Reaktionstemperaturen bleiben unter 100 – 110 °C.
3.1.3. Nitrobenzol-Reduktion
Die Reduktion von Nitrobenzol in einem sauren Medium ergibt 2- und 4-Aminophenol durch Umlagerung des Zwischenprodukts Phenylhydroxylamin. Das Hauptprodukt ist 4-Aminophenol, neben den Nebenprodukten 2-Aminophenol, Anilin und 4,4′-Diaminodiphenylether.
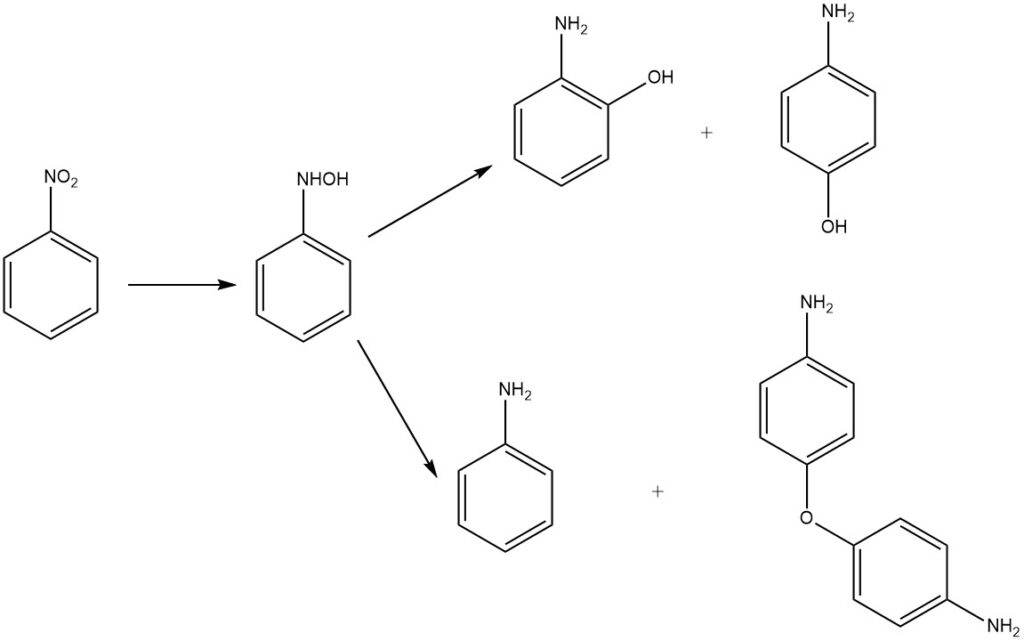
Historisch gesehen dienten Metalle in verdünnter Schwefelsäure als Reduktionsmittel. Derzeit werden Wasserstoff und Edelmetallkatalysatoren wie Palladium oder Platin eingesetzt. Weitere Katalysatoren sind Molybdän und Platinsulfid sowie ein Platin-Ruthenium-Mischkatalysator, oft in Oxidform oder auf Aktivkohle geträgert.
Verdünnte wässrige Mineralsäure fungiert als Reaktionsmedium, und ein zweistufiger Prozess mit Raney-Kupfer reduziert Nitrobenzol selektiv zu Phenylhydroxylamin, das sich bei Zugabe von verdünnter Schwefelsäure in 4-Aminophenol umlagert.
Netzmittel, insbesondere quartäre Ammoniumsalze mit großen Alkylgruppen, erhöhen die Aminophenolausbeute. Typischerweise findet die Reaktion unter 100 °C statt und kann bei atmosphärischem oder höherem Druck erfolgen. Die Zugabe von Wasserstoff erfolgt nach Verbrauch, und inerte organische Lösungsmittel können die Ausbeute steigern.
Bei einer alternativen Methode stoppt die Nitrobenzolreduktion bei 88 %, wodurch ein Zweiphasengemisch entsteht, das nicht umgesetztes Nitrobenzol und den Edelmetallkatalysator enthält. Zur Aufarbeitung genügt eine Phasentrennung, wobei die Nitrobenzolphase zurückgeführt wird.
Die wässrige Schwefelsäurephase enthält 4-Aminophenol und Anilin, das nach der Neutralisation gestrippt wird. Reinigung und Kristallisation ergeben 4-Aminophenol.
3.1.4. Elektrolytische Reduktion
Die elektrolytische Reduktion bietet eine weniger umweltschädliche Alternative zu Metall-Säure-Systemen, die industrielle Umsetzung bleibt jedoch begrenzt. Die Elektrolyse von Nitrobenzol, Phenylhydroxylamin oder Azoxybenzol in sauren Lösungen ergibt insbesondere 4-Aminophenol.
3.2. Auswechslung
Der Ersatz verschiedener anderer Gruppen durch Amino- oder Hydroxylgruppen ist für die Herstellung von 2- und 4-Aminophenol nicht von nennenswerter industrieller Bedeutung. Diese Art von Reaktion findet jedoch Anwendung bei der Synthese von Derivaten von 2- und 4-Aminophenol.
Umgekehrt führt der direkte Reduktionsweg nicht ohne weiteres zu 3-Aminophenol. Seine Herstellung erfolgt hauptsächlich durch die Reaktion zwischen 3-Aminobenzolsulfonsäure und Natriumhydroxid oder die Reaktion von Resorcin mit Ammoniak.
Die Substitution der Sulfonsäuregruppe in 3-Aminobenzolsulfonsäure wird durch einen Natronlauge-Fusionsprozess (Dauer 5 bis 6 Stunden bei 240 bis 245 °C) erreicht, gefolgt von einer Vakuumdestillation zur Reinigung des Produkts.
Eine alternative Methode beinhaltet die Reaktion von Resorcin mit Ammoniak, möglicherweise in Gegenwart von Diammoniumphosphat und Arsenpentoxid oder Ammoniumsulfit, was zur Bildung von 3-Aminophenol führt.
Darüber hinaus kann 3-Aminophenol durch Hydrolyse von 3-Aminoanilin gewonnen werden.
3.3. Reinigung von Aminophenolen
Aminophenole werden durch Sublimation bei erhöhten Temperaturen und reduziertem Druck gereinigt.
Für 3-Aminophenol ist die Vakuumdestillation eine geeignete Reinigungsmethode, bei der die Zugabe von Schwefeldioxid während der Destillation oder das Sammeln des Destillats unter einer Schicht einer inerten Flüssigkeit geringerer Dichte, wie z. B. Wasser, dazu beiträgt, ein farbloses Produkt zu erhalten.
Ein alternativer Reinigungsansatz besteht darin, die wässrigen Lösungen von Aminophenolen mit Aktivkohle zu behandeln. Während dieses Prozesses dient die Zugabe von Substanzen wie Natriumsulfit, Natriumdithionit oder Dinatriumethylendiaminotetraacetat dazu, die Qualität und Stabilität der Produkte zu verbessern und gleichzeitig Schwermetallionen zu chelatisieren, die die Oxidation erleichtern könnten.
Auch bei der Fällung bzw. Kristallisation von Aminophenolen empfiehlt sich der Zusatz von Natriumdithionit, Hydrazin oder Natriumhydrosulfit.
Bei Aminophenolen, insbesondere 4-Aminophenol, das durch katalytische Reduktion hergestellt wird, können Verunreinigungen häufig durch den Einsatz verschiedener Verfahren verringert oder beseitigt werden.
Zu diesen Methoden gehören die Behandlung mit 2-Propanol, aliphatischen, cycloaliphatischen oder aromatischen Ketonen, aromatischen Aminen, Toluol oder niedermolekularen Alkylacetaten sowie die Verwendung von Phosphorsäure, Hydroxyessigsäure, Hydroxypropionsäure oder Zitronensäure.
Auch die Extraktion mit Methylenchlorid, Chloroform oder Nitrobenzol kann zur Milderung oder Entfernung von Verunreinigungen wirksam sein.
4. Verwendung von Aminophenolen
Sowohl 2-Aminophenol als auch 4-Aminophenol sind starke Reduktionsmittel, was sie als fotografische Entwickler wertvoll macht, bekannt unter Handelsnamen wie Atomal und Ortol für 2-Aminophenol sowie Activol, Azol, Certinal, Citol, Paranol, Rodinal, Unal und Ursol P für 4-Aminophenol.
Diese Stoffe finden entweder einzeln oder in Verbindung mit Hydrochinon Anwendung. Die Oxalatform von 4-Aminophenol wird unter dem Handelsnamen Kodelon vermarktet.
Die Vielseitigkeit von Aminophenolen macht sie zu unverzichtbaren Zwischenprodukten bei der Synthese nahezu aller Arten von Flecken und Farbstoffen. Darüber hinaus wird 2-Aminophenol gezielt zur Verstärkung der Farbtöne von Leder, Fell und Haaren eingesetzt, die von Grau- und Brauntönen bis hin zu gelblich-braunen Tönen reichen.
3-Aminophenol dient für verschiedene Zwecke als Haarfärbemittel und Haftvermittler in Haarfärbeformulierungen. Mittlerweile ist 4-Aminophenol ein wesentlicher Bestandteil der pharmazeutischen Synthese, trägt zur Produktion von Holzbeizen bei, die dem Holz einen rosafarbenen Farbton verleihen, und fungiert als Färbemittel für Fell und Federn.
Aufgrund der unmittelbaren Nähe der Amino- und Hydroxylgruppen am Benzolring und ihrer Neigung zur Kondensation mit geeigneten Reaktanten ist 2-Aminophenol ein wichtiger Vorläufer bei der Synthese heterozyklischer Systeme wie Oxychinoline, Phenoxamine und Benzoxazole, die als Entzündungshemmer eingesetzt werden Inhibitoren.
Im Hinblick auf 3-Aminophenol umfassen seine Anwendungen die Stabilisierung von chlorhaltigen Thermoplasten, obwohl seine Hauptaufgabe darin besteht, ein Zwischenprodukt für die Herstellung von 4-Amino-2-hydroxybenzoesäure, einem Tuberkulostatika, zu sein.
Ebenso sind Derivate stickstoffsubstituierter 4-Aminophenole seit langem für ihre fiebersenkenden und analgetischen Eigenschaften bekannt, die erheblich zur Nutzung von 4-Aminophenol beitragen.
5. Toxikologie von Aminophenolen
Aminophenole werden als Reizstoffe eingestuft. Ihre Toxizitätsbewertung reicht von leicht bis mäßig; Allerdings kann eine längere oder wiederholte Exposition zu verschiedenen Nebenwirkungen führen, darunter allgemeiner Juckreiz, Hautsensibilisierung, Dermatitis und allergische Reaktionen.
Die Exposition gegenüber 2- und 4-Aminophenol kann zur spontanen Produktion immunogener Konjugate führen. Ein weiteres potenzielles Problem ist die Bildung von Methämoglobin, was zu Zyanose führt.
Das Einatmen von 4-Aminophenol kann diese Reaktion auslösen und auch zu Asthma bronchiale führen. Bemerkenswert ist, dass 3-Aminophenol im Vergleich zu den anderen Isomeren eine geringere Gefahr darstellt. Die durch sulfonierte Derivate verursachte Reizung ist im Vergleich zu nicht sulfonierten Verbindungen milder.
2-Aminophenol hat neuroaktive Eigenschaften und löst bei der Einführung in den Großhirnventrikel von Ratten Spitzenentladungen aus. Andererseits ist 4-Aminophenol nephrotoxisch und hemmt die proximale Tubulusfunktion erheblich.
In Rattennierenmitochondrien werden Atmung, oxidative Phosphorylierung und ATPase-Aktivität durch 4-Aminophenol gehemmt. Während 3-Aminophenol nicht so gefährlich ist, zeigen sowohl 2-Aminophenol als auch 4-Aminophenol bei Hamstern teratogene Wirkungen.
Die Wirkung von 4-Aminophenol erstreckt sich auf die Hemmung der DNA-Synthese und die Veränderung der DNA-Struktur in menschlichen Lymphoblasten. Darüber hinaus wurden Aminophenole als genotoxische Wirkstoffe identifiziert, was durch die Induktion von Schwesterchromatidaustauschen und Mikrokerntests nachgewiesen wurde.
Natürlich ist ein vorsichtiger Umgang mit diesen Verbindungen unerlässlich und eine längere Exposition sollte minimiert werden. Zu den empfohlenen Vorgehensweisen zählen das zügige Ausziehen kontaminierter Kleidung und das gründliche Waschen der betroffenen Stelle mit fließendem Wasser für mindestens 10 Minuten.
Verweise
- Aminophenols; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a02_099
- Aminophenols; Kirk-Othmer Encyclopedia of Chemical Technology. – https://onlinelibrary.wiley.com/doi/abs/10.1002/0471238961.0113091413092003.a01.pub2
