Triméthylamine : propriétés, réactions, production, utilisations et toxicologie
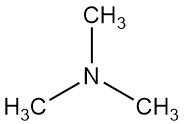
La triméthylamine est un composé organique de formule N(CH3)3. C’est un gaz incolore ou un liquide comprimé avec une forte odeur de poisson à faibles concentrations. À des concentrations plus élevées, l’odeur ressemble davantage à celle de l’ammoniac.
La triméthylamine est un composé naturel présent en petites quantités dans de nombreuses plantes et animaux. Il est également produit par la dégradation de matières organiques, comme le poisson et d’autres fruits de mer. Dans le corps humain, il est produit par les bactéries intestinales lorsqu’elles décomposent certains aliments.
Table des matières
1. Propriétés physiques de la triméthylamine
La triméthylamine a une odeur de poisson plus forte que les autres méthylamines (méthylamine et diméthylamine). Le nez humain peut détecter la triméthylamine à une faible concentration de <10 ppb produite par la décomposition des plantes et des animaux.
L’hydrate cristallin (CH3)3N·10 H2O est formé en refroidissant des solutions aqueuses saturées de triméthylamine. À pression atmosphérique, il forme des azéotropes à point d’ébullition minimum avec l’ammoniac et d’autres méthylamines.
La triéthylamine est soluble dans divers solvants organiques, notamment le méthanol, l’éthanol, le diméthylformamide et l’éthylène glycol, et ses solutions aqueuses peuvent dissoudre de nombreux composés inorganiques et organiques.
Certaines propriétés physiques de la triméthylamine sont répertoriées dans le Tableau 1.
| Propriété | Valeur |
|---|---|
| Poids moléculaire, g/mol | 59.11 |
| Point d'ébullition (101,33 kPa), °C | 2.8 |
| Point de fusion, °C | -117.1 |
| Densité (à 25 °C, liquide), g/cm3 | 0,6331 |
| pKa (à 25 °C) | 9,80 |
| Indice de réfraction à 0 °C | 1.3631 |
| Tension superficielle (25 °C), 10-3 N/m | 13h47 |
| Chaleur de vaporisation à 25 °C, kJ/mol | 22.864 |
| Chaleur de vaporisation au point d'ébullition, kJ/mol | 27.708 |
| Chaleur de fusion, kJ/mol | 6.548 |
| Chaleur standard de formation à 25 °C (liquide), kJ/mol | -45,80 |
| Chaleur standard de formation à 25 °C (gaz), kJ/mol | -23,86 |
| Chaleur de combustion, état standard à 25 °C, liquide, kJ/mol | -2422.60 |
| Capacité thermique, gaz parfait (25 °C), J K-1 mol-1 | 91,8 |
| Température critique, °C | 160,1 |
| Pression critique, MPa | 4.07 |
| Constante diélectrique (25 °C), liquide | 2.44 |
| Moment dipolaire dans le benzène (25 °C), D | 0,87 |
| Point d'éclair (coupelle fermée), °C | -71 |
| Température d'inflammation dans l'air, °C | 190 |
| Limite inférieure d'explosivité dans l'air, % vol | 2 |
| Limite supérieure d'explosivité dans l'air, % vol | 11.6 |
2. Réactions chimiques de la triméthylamine
La triméthylamine est une base faible qui forme des sels comme le chlorure de triméthylammonium avec l’acide chlorhydrique. Cette réaction implique la paire d’électrons libres sur l’atome d’azote.
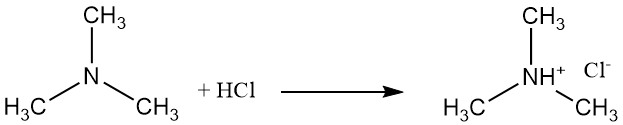
En phase gazeuse, la basicité des méthylamines augmente en fonction de la substitution du groupe méthyle, comme suit :
(CH3)3N > (CH3)2NH > CH3NH2 > NH3
Cependant, en solution aqueuse, la basicité de la triméthylamine est inférieure à celle de la diméthylamine et de la méthylamine. Ceci est attribué à une solvatation plus faible de l’ion triméthylammonium, (CH3)3NH+, qui ne dispose que d’un seul hydrogène disponible pour la liaison hydrogène avec les molécules d’eau.
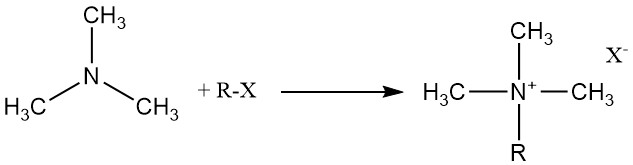
La triméthylamine réagit avec les acides organiques et inorganiques, les halogénures d’alkyle et les époxydes pour former des sels d’ammonium quaternaire.
La réaction de la triméthylamine avec l’oxyde d’éthylène produit de choline ou du chlorure de choline lorsque le chlorure de triméthylammonium est utilisé.

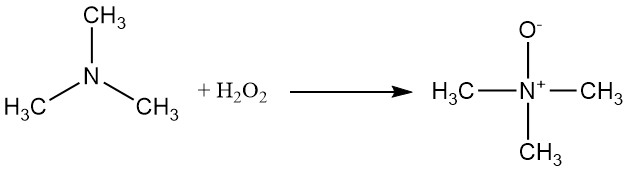
La triméthylamine peut être oxydée avec du peroxyde d’hydrogène ou un peracide pour produire de l’oxyde de triméthylamine.
3. Production industrielle de triméthylamine
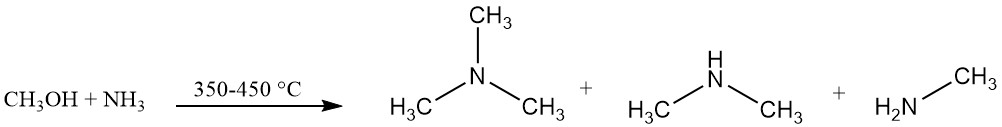
La triméthylamine est produite industriellement par la réaction de l’ammoniac et du méthanol en présence d’un catalyseur, généralement un catalyseur à base d’alumine, à 350-450 °C. Cette réaction produit de la triméthylamine avec de la diméthylamine et de la méthylamine.
L’équilibre réactionnel favorise la formation de triméthylamine, mais la demande du marché est plus élevée pour la monoéthylamine et surtout la diméthylamine.
L’utilisation de catalyseurs acides solides amorphes, notamment d’alumines, de silices et de phosphates, favorise la formation de triméthylamine contrairement aux zéolites à forme sélective qui sont sélectives pour la production de diméthylamine.
Le mélange résultant contient des matières n’ayant pas réagi (ammoniac, méthanol) ainsi que les produits souhaités (monoéthylamine, diméthylamine et triméthylamine), de l’eau générée au cours de la réaction et d’autres sous-produits.
Une série de quatre à cinq colonnes de distillation sépare et purifie les composants individuels. La triméthylamine anhydre pure est récupérée du mélange par distillation extractive avec de l’eau pour briser le mélange azéotropique formé avec les autres méthylamines.
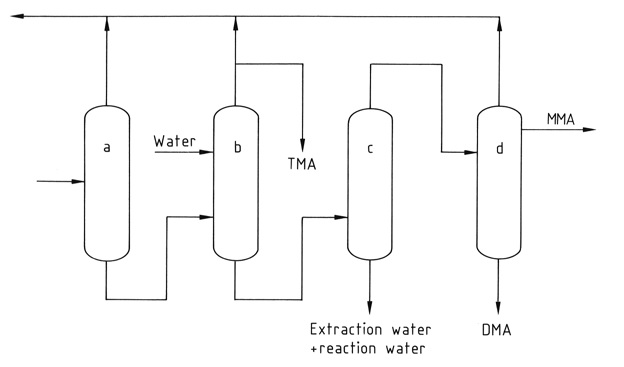
a) Colonne d'ammoniac ; b) Colonne de distillation extractive ; c) Colonne pour l'élimination de l'eau ; d) Colonne produits MMA et DMA
*MMA : méthylamine ; DMA : diméthylamine ; TMA ; triméthylamine
4. Utilisations de la triméthylamine
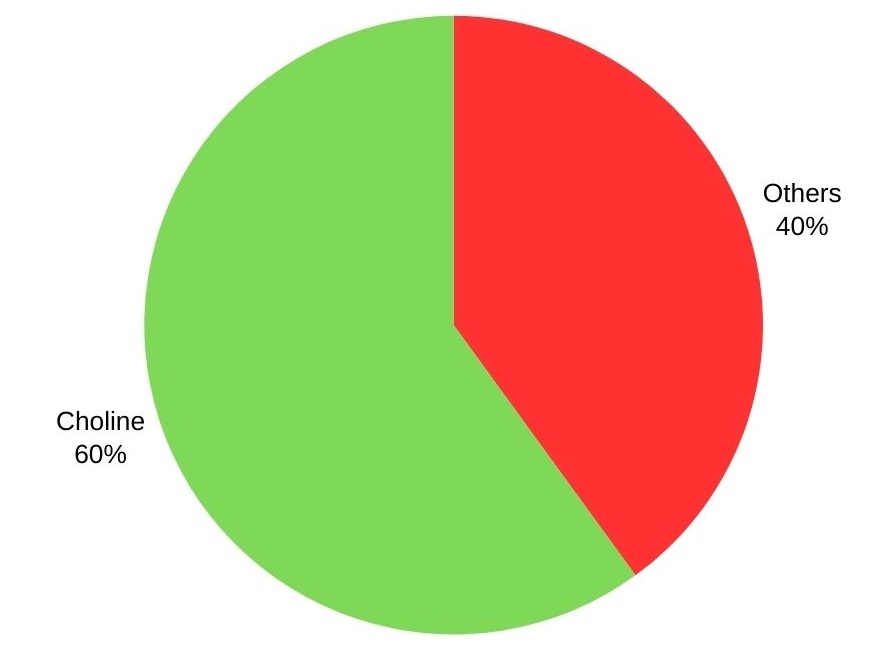
La triméthylamine est principalement utilisée pour produire la choline et ses sels, à plus de 60 %. D’autres applications incluent la fabrication d’amidons cationiques, de désinfectants, d’agents de flottation, d’édulcorants intenses et de résines échangeuses d’ions.
La triméthylamine est utilisée comme catalyseur dans la production d’hydroxydes et de sels d’ammonium quaternaire.
Il peut également être utilisé pour attirer les insectes, et il est ajouté au gaz naturel inodore comme mesure de sécurité pour détecter les fuites.
5. Toxicologie de la triméthylamine
La triméthylamine est un liquide ou un gaz hautement inflammable qui irrite la peau, les yeux et les voies respiratoires et provoque un œdème pulmonaire (accumulation de liquide dans les poumons).
Limites d’exposition
- Institut national pour la sécurité et la santé au travail (NIOSH) : 10 ppm (moyenne) et 15 ppm (à court terme)
- Conférence américaine des hygiénistes industriels gouvernementaux (ACGIH) : 5 ppm (en moyenne) et 15 ppm (à court terme)
Effets sur la santé
- Aigu (à court terme) : irritation de la peau et des yeux, irritation des voies respiratoires, toux, essoufflement. Une exposition grave peut entraîner un œdème pulmonaire.
- Chronique (à long terme) : Il n’existe aucune preuve concluante de cancérogénicité ou d’effets sur la reproduction. D’autres effets à long terme sur la santé ne sont pas encore entièrement caractérisés.
Manipulation et stockage
- Conserver à l’écart des agents oxydants, du mercure, de l’oxyde d’éthylène, des acides forts, des métaux et des bases fortes.
- Maintenez une zone de stockage fraîche et bien ventilée.
- Éliminez les sources d’inflammation telles que la fumée et les flammes nues.
- Mettez et collez les conteneurs métalliques pendant le transfert.
- Utilisez des outils et des équipements anti-étincelles.
Références
- Methylamines; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a16_535.pub4
- Methylamines; Kirk-Othmer Encyclopedia of Chemical Technology. – https://onlinelibrary.wiley.com/doi/10.1002/0471238961.1305200820211818.a01.pub2
- https://nj.gov/health/eoh/rtkweb/documents/fs/1927.pdf
