Production industrielle de crésols
Depuis 1965, la production synthétique de crésols a fortement augmenté, supplantant la récupération à partir du goudron de houille et des caustiques de raffinerie en raison de la demande croissante. Les crésols sont principalement produits par différents procédés tels que la fusion alcaline des toluènesulfonates, l’hydrolyse alcaline du chlorotoluène, la décomposition de l’hydroperoxyde de cymène et la méthylation en phase vapeur du phénol.
Les trois premiers procédés utilisent le toluène comme matière première et constituent des extensions des méthodes établies de synthèse du phénol. Cependant, la méthylation du phénol est une voie dédiée à la production de crésols et de xylénols.
Chaque procédé génère une distribution isomérique de crésols distincte, et chacun d’eux a son importance.
Table des matières
1. Production de crésol par fusion alcaline de toluènesulfonates
La fusion alcaline est une méthode industrielle importante, principalement utilisée pour la synthèse du p-crésol. Ce procédé comprend quatre étapes réactionnelles distinctes :
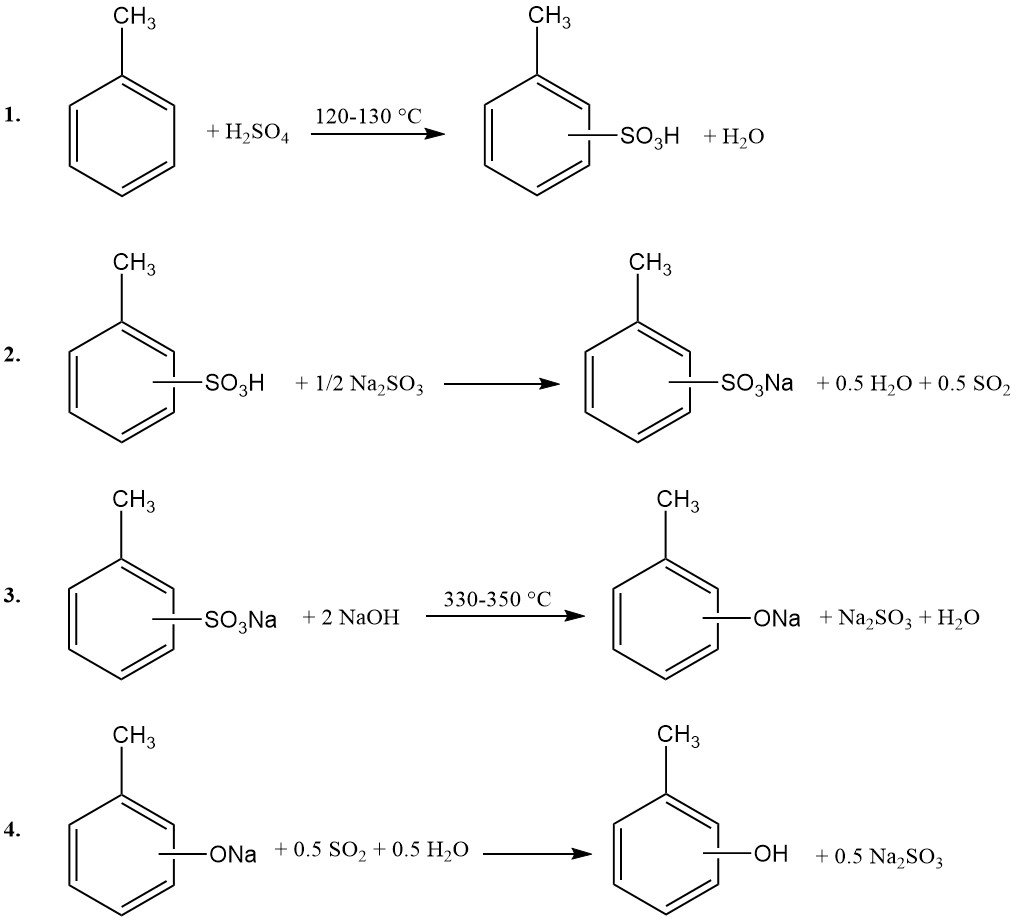
1. Sulfonation du toluène : Le toluène réagit avec de l’acide sulfurique concentré à 120–130 °C sous pression atmosphérique. Pour assurer la consommation complète de l’acide sulfurique, l’eau générée par la réaction est éliminée par voie azéotropique avec l’excès de vapeur de toluène.
2. Neutralisation : Le mélange d’acide toluènesulfonique obtenu est neutralisé avec du sulfite de sodium ou de l’hydroxyde de sodium.
3. Fusion alcaline : Le toluènesulfonate de sodium est ensuite fusionné avec un excès d’hydroxyde de sodium à 330–350 °C.
4. Acidification : Le produit fondu est dissous dans l’eau et le sulfite de sodium insoluble est filtré. La phase aqueuse est ensuite acidifiée avec du dioxyde de soufre (recyclé de l’étape 2) ou de l’acide sulfurique.
L’étape d’acidification produit une solution aqueuse de sulfite de sodium, recyclée vers l’unité de neutralisation, et une phase de crésol brut. Ce crésol brut est déshydraté par distillation azéotropique. La configuration de l’installation et du procédé est très similaire à celle utilisée précédemment pour la synthèse du phénol par fusion alcaline du benzènesulfonate de sodium.
La distillation fractionnée du crésol brut déshydraté produit du phénol, de l’o-crésol, un mélange m-/p-crésol, et un résidu contenant des ditolylsulfones, des xylénols et d’autres phénols supérieurs. Les ditolylsulfones sont des sous-produits de la sulfonation, tandis que les phénols et les xylénols se forment en quantités mineures lors de la fusion alcaline.
La distribution des isomères du crésol est principalement influencée par les conditions de sulfonation. Les compositions typiques comprennent 6 à 12 % d’o-crésol, 6 à 12 % de m-crésol et 80 à 85 % de p-crésol. Après élimination de l’o-crésol par distillation, on obtient du p-crésol d’une pureté d’environ 90 %.
Une purification plus poussée jusqu’à une teneur en m-crésol d’environ 1 % est possible par cristallisation à l’état fondu. Un rendement en crésol de 80 %, basé sur le toluène, est envisageable, bien que ce rendement diminue avec l’augmentation de la teneur en m-crésol.
Des conditions de sulfonation (douces) contrôlées cinétiquement, associées à une fusion alcaline douce, peuvent produire des mélanges de crésols à teneur réduite en m-crésol. Par exemple, la sulfonation par l’acide chlorosulfurique à 33–45 °C permet d’obtenir un produit sans m-crésol avec un rendement de 90 % et un rapport o-/p-crésol de 15:85.
De même, la sulfonation du toluène avec des mélanges de trioxyde de soufre et de dioxyde de soufre à 25–50 °C produit des mélanges d’acide toluènesulfonique pratiquement exempts d’isomère méta, avec des rapports isomère o/p aussi faibles que 3:97.
L’opération dans un réacteur en boucle à 0 °C avec du SO3 gazeux dilué par un gaz inerte (ou sous vide) peut réduire la teneur en isomères o et m à 0,5 %. La sulfonation avec de l’oléum ou de l’acide sulfurique dans un réacteur à film rotatif à temps de séjour court permet également une sulfonation sans méta, produisant principalement de l’acide p-toluènesulfonique.
En revanche, la sulfonation thermodynamiquement contrôlée (température élevée, temps de réaction prolongé, faible teneur en eau) génère un mélange à l’équilibre contenant environ 5 % d’acide o, 54 % de méta et 41 % d’acide p-toluènesulfonique. La fusion alcaline de ces mélanges produit ensuite une distribution isomérique d’environ 5 % d’o-crésol, 56 % de m-crésol et 39 % de p-crésol.
Le m-crésol de qualité technique peut être produit par réaction de vapeur d’eau à 165 °C avec un mélange d’acide toluènesulfonique riche en méta-isomères, obtenu dans des conditions thermodynamiques contrôlées (suivie d’une isomérisation pendant plusieurs heures à 190-200 °C).
Ce procédé hydrolyse sélectivement les acides ortho- et para-toluènesulfoniques en acide sulfurique et en toluène. Le toluène libéré est distillé à la vapeur d’eau, laissant de l’acide m-toluènesulfonique d’une pureté supérieure à 90 % aux côtés de l’acide sulfurique.
Les réactions secondaires lors de l’isomérisation et de l’hydrolyse peuvent être supprimées par l’ajout de 5 à 10 % molaires de sulfate de sodium au lot de sulfonation. Cet ajout facilite également l’élimination de l’acide sulfurique formé par hydrolyse, sous forme de phase inférieure, à 140–150 °C.
Le mélange d’hydrolyse peut être neutralisé avec une solution concentrée d’hydroxyde de sodium pour former du sulfate de sodium et du m-toluènesulfonate de sodium. La solution de m-toluènesulfonate de sodium obtenue est ensuite mise à réagir avec une masse fondue d’hydroxyde de sodium (contenant 10–15 % d’hydroxyde de potassium) à une température initiale de 330 °C, puis portée à 340 °C pour la fusion.
La distillation de la phase crésol brute obtenue après acidification produit du m-crésol d’une pureté allant jusqu’à 98 %, avec un rendement d’environ 65 % par rapport au toluène réagi.
Le procédé de sulfonation du toluène pour le p-crésol est utilisé par PMC (États-Unis, environ 18 000 t/an), Inspec Fine Chemicals (Royaume-Uni, environ 12 000 t/an), Beraton (Russie, environ 3 000 t/an) et Konan Chemicals (Japon, environ 4 000 t/an).
Honshu Chemical Industry Co. (Japon) exploite une usine de réserve (environ 2 500 t/an) capable de produire du m-crésol ou du p-crésol. Une usine de Gujarat Aromatics en Inde, basée sur le procédé Honshu, produirait entre 3 000 et 5 000 t/an de p-crésol ou de m-crésol.
Bien que le procédé acide toluènesulfonique-crésol nécessite une usine relativement simple, son principal inconvénient est la production inévitable de sulfite de sodium aqueux.
2. Production de crésol par hydrolyse alcaline du chlorotoluène
Les crésols peuvent être produits industriellement par hydrolyse alcaline du chlorotoluène pour produire un mélange d’isomères à forte teneur en m-crésol. Bayer AG en Allemagne, l’un des principaux fabricants de crésol synthétique avec une capacité de production supérieure à 30 000 t/an, utilise ce procédé.
La première étape est la chloration du toluène. Une mole de toluène réagit avec une mole de chlore en présence de chlorure de fer(III) et de dichlorure de disulfure, produisant un mélange d’o- et de p-chlorotoluène. Selon le FeCl3 et le système de cocatalyseur, les rapports o/p peuvent varier de 3:1 à 1:2.
Ce mélange de chlorotoluène est ensuite hydrolysé avec un excès de solution d’hydroxyde de sodium (2,5–3,5 mol/mol de chlorotoluène). Cette réaction se produit à des températures (360–390 °C) et des pressions (280–300 bar, 28–30 MPa) élevées.
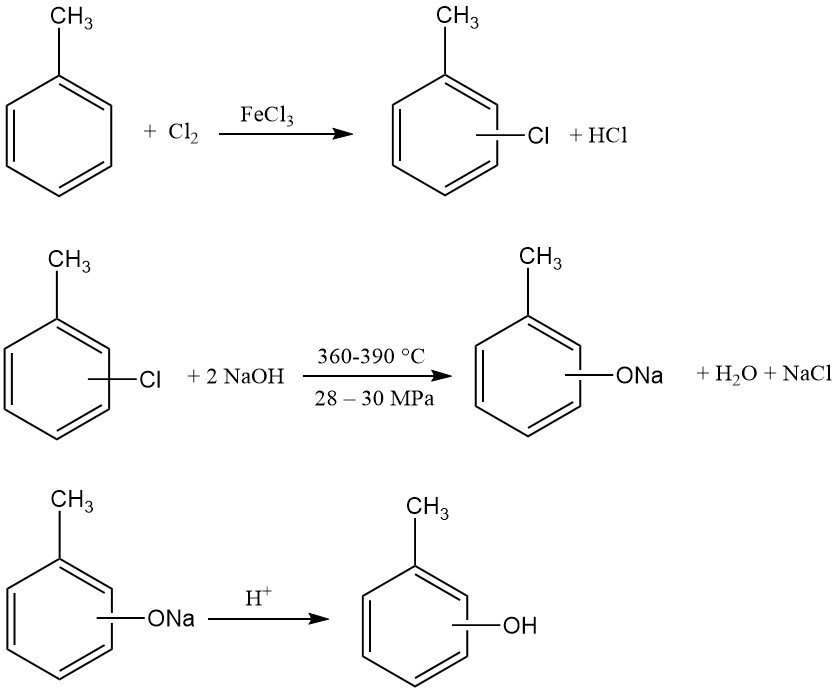
L’hydrolyse exothermique est réalisée en continu dans de longs tubes haute pression en acier nickelé pour résister à la corrosion du mélange réactionnel. La vitesse d’écoulement élevée et les changements fréquents de direction assurent l’homogénéité de la masse réactionnelle, empêchant ainsi la séparation des composants.
La solution de crésolate de sodium obtenue est ensuite neutralisée pour libérer les crésols. L’acide chlorhydrique généré lors de l’étape initiale de chloration peut être utilisé pour cette neutralisation. Le chlorure de sodium coproduit peut être recyclé vers une unité d’électrolyse chlore-alcali.
L’efficacité économique nécessite la colocalisation de la production de la matière première et de l’usine d’hydrolyse, permettant ainsi le transport par pipeline. La technologie sous-jacente de ce procédé ressemble beaucoup à celle de l’hydrolyse du chlorobenzène en phénol de Dow-Bayer. Cependant, la production de crésol génère davantage de sous-produits.
Ces sous-produits comprennent les éthers ditolyliques (éthers bis(méthylphényliques)), les tolylcrésols (méthyl(méthylphényl)phénols) et de faibles quantités de toluène, de phénol, d’acide benzoïque et de gaz de craquage (méthane, hydrogène). Le phénol, par exemple, peut être éliminé par distillation azéotropique avec du chlorotoluène.
Si la formation de tolylcrésol est difficile à contrôler, celle de l’éther ditolylique peut être gérée en ajustant la température, le temps de séjour et la concentration en hydroxyde de sodium. Le recyclage des éthers ditolyliques minimise également leur accumulation grâce à leur hydrolysabilité, bien qu’à un rythme plus lent que celui de l’éther diphénylique.
Un contrôle optimal de la réaction permet d’obtenir des rendements en crésol d’environ 80 % par rapport au chlorotoluène.
L’éther ditolylique étant un produit chimique précieux utilisé comme fluide caloporteur (par exemple, le Diphyl DT), comme isolant électrique (par exemple, le Baylectrol 4800, un substitut de PCB) et comme précurseur d’agents de tannage, il n’est souvent pas recyclé et les conditions du procédé peuvent même être ajustées pour améliorer sa formation sélective.
L’hydrolyse alcaline du chlorotoluène produit des crésols de haute pureté, avec un minimum d’autres composés.
Un apport 1:1 d’o/p-chlorotoluène produit généralement un rapport isomère o-, m- et p-crésol d’environ 1:2:1. Ce rapport modifié, par rapport à l’alimentation en chlorotoluène, suggère une isomérisation via des intermédiaires arynes dans des conditions d’hydrolyse sévères. Après distillation de l’o-crésol, on obtient un mélange m-/p-crésol contenant environ 70 % de m-crésol.
L’installation peut également fonctionner avec de l’o-chlorotoluène ou du p-chlorotoluène purs. L’hydrolyse du p-chlorotoluène produit un mélange m-/p-crésol 1:1, tandis que l’hydrolyse de l’o-chlorotoluène produit un mélange o-/m-crésol 1:1. Techniquement, le m-crésol pur peut être isolé de ce dernier par distillation de l’o-crésol.
L’hydrolyse du chlorotoluène sans isomérisation significative est possible dans des conditions plus douces (200–350 °C) en utilisant des hydroxydes de métaux alcalins, des carbonates de métaux alcalins, de l’hydroxyde d’ammonium ou des solutions d’acétate/propionate de métaux alcalins, en présence de cuivre ou de composés du cuivre.
Ces procédés alternatifs ne sont généralement pas viables industriellement en raison de rendements plus faibles à basse température.
3. Production de crésol par clivage de l’hydroperoxyde de cymène
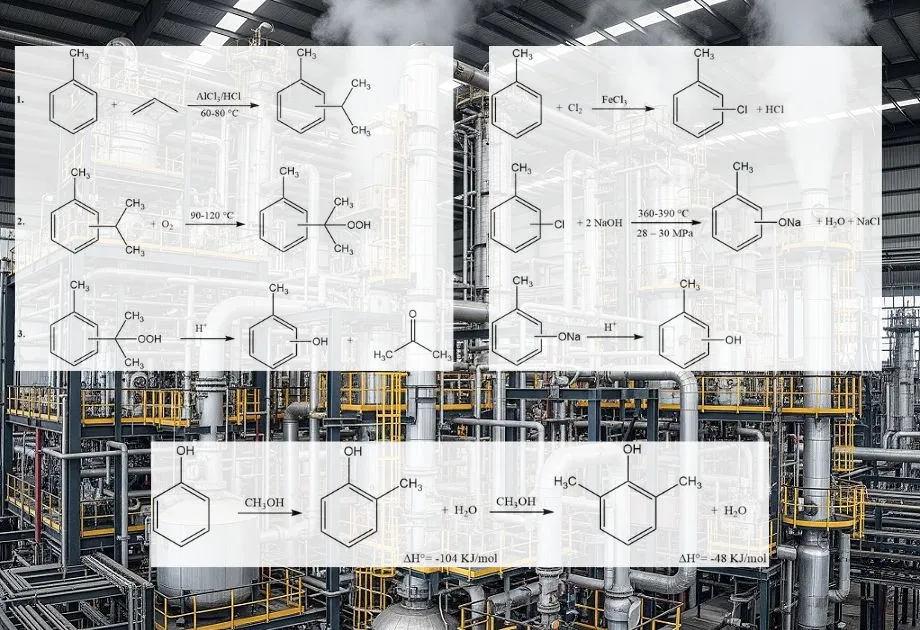
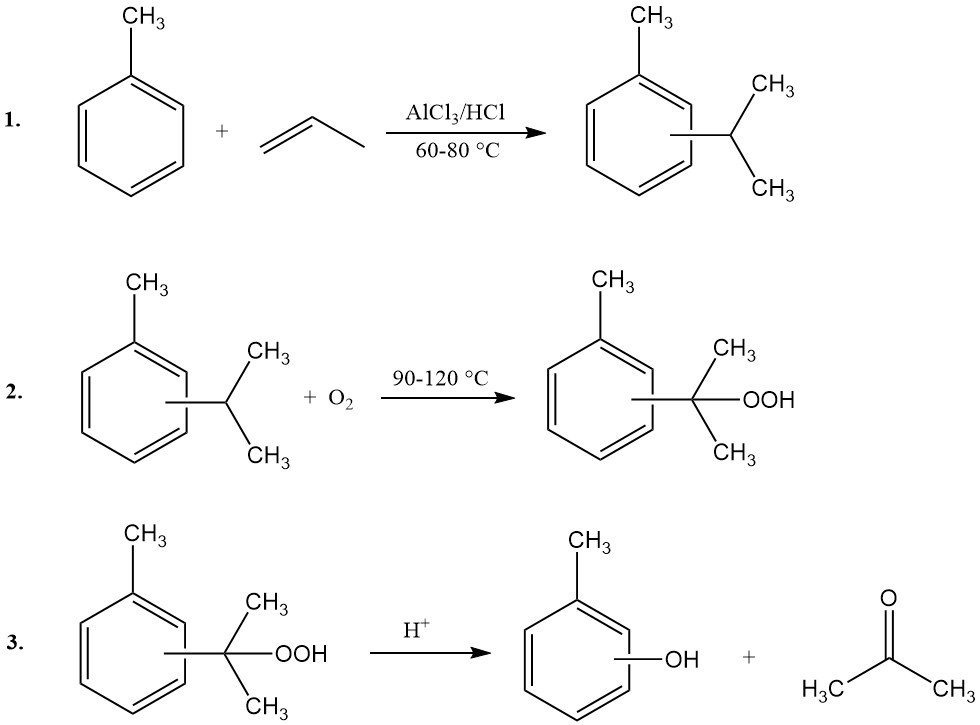
Le procédé cymène-crésol, également appelé synthèse par hydroperoxyde de cymène, permet la production de m- ou p-crésol à partir des isomères correspondants de l’isopropyltoluène (cymène). Cette méthode ne convient pas à la synthèse de l’o-crésol. Le procédé comprend trois étapes principales :
- Propylation du toluène et isomérisation du cymène : le toluène réagit avec le propène pour former des isomères de cymène, puis leur isomérisation permet d’obtenir la distribution isomérique souhaitée.
- Oxydation du cymène : le cymène est oxydé pour produire de l’hydroperoxyde de cymène.
- Clivage du peroxyde : l’hydroperoxyde de cymène subit un clivage acido-catalysé pour produire du crésol et de l’acétone.
Le procédé cymène-crésol présente plusieurs inconvénients opérationnels et économiques par rapport au procédé cumène de Hock. Parmi ceux-ci, on compte des rendements spatio-temporels plus faibles, des exigences de distillation complexes, une gestion des eaux usées complexe et des rendements de produits réduits (20 à 30 %).
Les principaux facteurs contribuant à ces limitations sont la distribution des isomères lors de la propylation, une cinétique d’oxydation sous-optimale, l’oxydation des groupes méthyles et les réactions secondaires au formaldéhyde, ainsi que la séparation complexe des sous-produits.
1. La propylation du toluène produit des isomères ortho-, méta- et para-cymène. L’ortho-cymène inhibe l’oxydation des autres cymènes et est lui-même peu oxydé. Maintenir une teneur en o-cymène inférieure à 10 % est essentiel pour une oxydation continue.
Pour y parvenir, des étapes rigoureuses de recyclage et d’isomérisation sont nécessaires, utilisant souvent du chlorure d’aluminium pour établir l’équilibre thermodynamique (par exemple, 3 % d’o-, 64 % de m- et 33 % de p-cymène). Les sous-produits du diisopropyltoluène sont également recyclés pour l’isomérisation.
2. Les taux d’oxydation du cymène sont plus lents que ceux du cumène, et la teneur maximale en peroxydes atteignable est plus faible (environ 20 % contre > 30 % pour le cumène). Cela nécessite des taux de recyclage plus élevés du cymène n’ayant pas réagi et conduit à une formation accrue de sous-produits (par exemple, le diméthyl(tolyl)méthanol, la méthylacétophénone) à des niveaux d’oxydation plus élevés.
3. L’oxydation du groupe méthyle du cymène est une réaction secondaire importante, produisant des peroxydes primaires moins stables et donnant des produits secondaires (par exemple, l’alcool isopropylbenzylique, l’acide cuminique). Le clivage acide ultérieur génère du formaldéhyde, qui peut réagir avec le crésol pour former des résines, réduisant considérablement le rendement en crésol et compliquant la purification du produit.
Les techniques permettant d’atténuer la formation de formaldéhyde ou ses effets comprennent la décomposition/hydrogénation sélective du peroxyde primaire, l’extraction ou la dissolution alcaline in situ des sous-produits acides.
4. Le mélange réactionnel post-clivage est très complexe et contient de nombreux sous-produits présentant des points d’ébullition et des tendances azéotropiques similaires. La séparation est donc coûteuse. L’hydrogénation sélective des peroxydes primaires, puis la réhydrogénation du mélange de clivage concentré, peuvent augmenter le rendement en crésol en reformant du cymène.
Des usines industrielles de cymène-crésol, utilisant des charges mixtes de cymène, sont opérationnelles depuis 1969 (par exemple, Sumitomo et Mitsui au Japon, avec une capacité de 22 000 t/an chacune). Elles produisent généralement du m-/p-crésol d’une pureté supérieure à 99,5 % et d’un rapport m/p de 60:40. De l’acétone de haute qualité est également produite.
L’utilisation de p- ou m-cymène pur comme matière première élimine le recyclage et l’isomérisation de l’o-cymène, simplifiant ainsi la production directe d’isomères purs. Parmi les exemples, on peut citer l’ancienne production de p-crésol à partir de terpènes naturels (Hercules Powder Co., États-Unis) et les installations actuelles utilisant le procédé Cymex d’UOP, qui isole sélectivement le p-cymène à l’aide de tamis moléculaires.
4. Production de crésol par méthylation du phénol
Les crésols synthétiques, en particulier l’o-crésol, et les xylénols sont principalement fabriqués par méthylation du phénol avec du méthanol. Ce procédé s’effectue en présence de divers catalyseurs. Le 2,6-xylénol est presque exclusivement produit par cette méthode.
Cette synthèse se déroule en une seule étape. Cependant, elle utilise du phénol, une matière première relativement coûteuse. De plus, la séparation des produits du mélange réactionnel est coûteuse en raison des points d’ébullition proches de plusieurs composants et des exigences de pureté strictes pour certains produits.
La réaction de méthylation peut être réalisée en phase vapeur ou liquide.
4.1. Méthylation du phénol en phase vapeur
La méthylation en phase vapeur du phénol par le méthanol est une voie industrielle majeure pour la production d’o-crésol et/ou de 2,6-xylénol de haute pureté, ce dernier étant presque exclusivement fabriqué de cette manière.
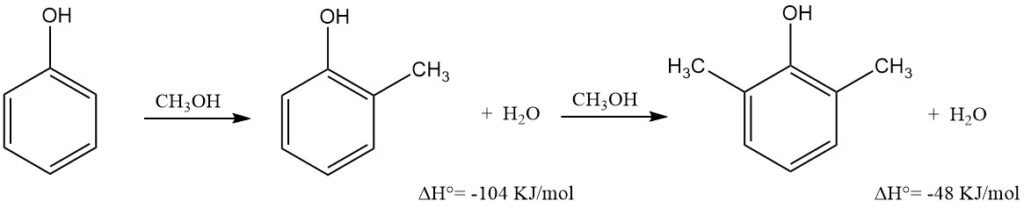
Le procédé consiste à faire passer un mélange surchauffé de vapeurs de phénol, de méthanol et d’eau sur un catalyseur à base d’oxyde métallique fixe dans un réacteur multitubulaire en acier inoxydable, à une température de 300 à 460 °C et à la pression atmosphérique ou légèrement supérieure.
La vitesse spatiale horaire du liquide (VSHL) est généralement comprise entre 1 et 2 h-1. La température de réaction dépend du catalyseur et peut être ajustée en fonction de la composition du produit souhaité. La chaleur de réaction est gérée par l’ébullition d’un milieu caloporteur organique, la circulation de sels fondus ou la production de vapeur haute pression.
La perte d’activité du catalyseur au fil du temps est compensée par des augmentations de température et l’élimination périodique des dépôts de carbone par combustion. La présence d’eau dans le mélange de charge inhibe la décomposition du méthanol, prolonge les cycles de régénération et prolonge la durée de vie du catalyseur.
L’effluent du réacteur échange de la chaleur avec la charge, puis se condense. Les produits de décomposition non condensables du méthanol (H2, CH4, CO2 et CO) sont utilisés comme gaz combustible pour la production de vapeur.
Le méthanol aqueux est distillé à partir du produit liquide et recyclé ; la séparation en méthanol, eau contenant du phénol et phénols peut s’effectuer dans une seule colonne de distillation ou par décantation suivie d’une adsorption des phénols sur résine.
L’eau restante est éliminée par distillation azéotropique avec du toluène ou sous forme d’azéotrope avec du phénol n’ayant pas réagi, ce qui nécessite dans ce dernier cas une extraction du phénol des eaux usées.
Le mélange déshydraté subit une distillation fractionnée sous vide continue dans des colonnes à haut rendement pour produire de l’éther de phénol, du phénol, de l’o-crésol de haute pureté (99,5 %) et du 2,6-xylénol. La fraction éther de phénol–phénol est recyclée.
Les résidus de distillation, contenant d’autres xylénols et des triméthylphénols, sont généralement utilisés comme combustible. Si le catalyseur présente une sélectivité ortho élevée, du 2,6-xylénol pur à 99,5 % est directement obtenu. Dans le cas contraire, ou dans des conditions difficiles, la fraction de 2,6-xylénol peut contenir du m- et du p-crésol, ce qui nécessite une purification supplémentaire.
Le rapport o-crésol/2,6-xylénol est contrôlable en ajustant le rapport méthanol/phénol ; le recyclage de l’o-crésol peut faire du 2,6-xylénol le seul produit obtenu. Le rendement global (sélectivité) en o-crésol et en 2,6-xylénol, basé sur le phénol ayant réagi, varie de 90 à 98 %.
La méthylation du phénol en phase vapeur utilise principalement des catalyseurs à base d’oxydes métalliques. Ces catalyseurs influencent la température de réaction, la distribution du produit et la sélectivité.
Les catalyseurs à base d’oxyde de magnésium offrent une orthosélectivité élevée et minimisent la formation de m- et p-crésols, même à des températures élevées (420–460 °C). Leurs performances peuvent être améliorées en les combinant avec d’autres oxydes métalliques (par exemple, métaux alcalins, manganèse, cuivre).
D’autres systèmes catalytiques permettent d’atteindre des températures de réaction plus basses. Les catalyseurs à base d’oxyde de manganèse ou d’oxyde de chrome fonctionnent autour de 390 °C, tandis que les catalyseurs à base d’oxyde de vanadium ou d’oxyde de fer sont utilisés entre 320 et 350 °C.
Ces catalyseurs sont souvent mélangés à divers autres oxydes (par exemple, cérium, aluminium, silicium) pour améliorer la conversion et la sélectivité pour le 2,6-xylénol/o-crésol. Ces systèmes d’oxydes mixtes contribuent également à prolonger la durée de vie du catalyseur et à réduire la décomposition du méthanol.
L’oxyde de γ-aluminium catalyse la réaction à 300–320 °C avec une décomposition minimale du méthanol et une bonne stabilité. Cependant, son recyclage est important en raison de la faible conversion du phénol pour contrôler la formation de sous-produits, et des étapes de purification complexes sont nécessaires pour le 2,6-xylénol.
Les catalyseurs à sites acides forts, tels que les oxydes d’aluminium, la silice-alumine, les zéolites, les phosphates d’aluminium et l’acide phosphorique-kieselguhr, favorisent l’isomérisation et la transméthylation. Ils produisent généralement des produits à teneur en m-crésol/p-crésol plus élevée, notamment à température élevée.
Les zéolites à sélectivité de forme (par exemple, de type HKY) et l’acide phosphorique-kieselguhr, réagissant à 250–300 °C, peuvent présenter une sélectivité élevée pour le p-crésol, donnant lieu à des mélanges de m-crésol/p-crésol contenant environ 77–85 % de p-crésol. Les zéolites Pentasil modifiées présentent également une para-sélectivité.
Les agents de méthylation alternatifs comprennent les méthylbenzènes, l’éther diméthylique, la méthylamine, le méthane, les mélanges monoxyde de carbone-hydrogène et formaldéhyde-hydrogène.
La méthylation en phase vapeur est utilisée dans le monde entier par des entreprises telles que General Electric Co. (États-Unis, Pays-Bas), Inspec Fine Chemicals (Royaume-Uni), Chemopetrol (République tchèque), Nippon Crenol (Japon), GEM Polymers (Japon), Mitsubishi Gas Chemical Company (Japon) et Honshu Chemical Industry Co. (Japon).
4.2. Méthylation du phénol en phase liquide
La méthylation en phase liquide offre une alternative aux méthodes en phase vapeur pour la synthèse des crésols et des xylénols. Ce procédé utilise généralement des catalyseurs à base d’oxyde, tels que le γ-Al2O3, suspendu dans un mélange phénol-méthanol dans un autoclave à 300–400 °C, ou sur un lit fixe dans un réacteur tubulaire (par exemple, 350 °C, 35 bars).
Un procédé industriel notable, utilisé par Chemisches Werk Lowi, fait réagir le phénol avec une quantité équimolaire de méthanol à 350–400 °C en utilisant du méthylate d’aluminium comme catalyseur. Cette méthode permet d’obtenir un rendement d’environ 80 % en crésols et en xylénols à partir d’environ 60 % de phénol converti.
Si l’o-crésol est le produit principal, d’autres isomères et des triméthylphénols sont également formés, les ratios de produits étant ajustables via les paramètres de réaction. La présence de bases augmente la conversion, tandis que les acides favorisent le p-crésol et le 2,4-xylénol.
Un autre procédé important, le procédé Biller (anciennement Union Rheinische Kraftstoff AG), utilisait des solutions aqueuses d’halogénure de zinc et d’halogénure d’hydrogène comme catalyseurs dans des conditions plus douces (200–240 °C, environ 25 bars).
Cette méthode a permis d’obtenir jusqu’à 98 % de crésol à partir du phénol converti, mais a produit de plus grandes quantités de p-crésol et de 2,4-xylénol, le p-crésol étant quasiment exempt de m-crésol dans des conditions optimales.
Ce procédé nécessitait des matériaux hautement résistants à la corrosion en raison du système catalytique.
Les deux procédés en phase liquide présentent des défis, notamment le coût des matières premières (phénol) et la complexité de la séparation des produits en raison de points d’ébullition similaires et d’exigences de pureté strictes.
4.3. Transméthylation et isomérisation
Les procédés de transméthylation et d’isomérisation permettent de convertir des sous-produits et résidus de méthylphénol moins recherchés en isomères de crésol plus valorisables, notamment l’o-crésol et les mélanges m-/p-crésol.
Ces réactions se produisent généralement par ajout de phénol à des résidus de méthylphénol (issus de la méthylation du phénol ou d’autres sources) ou à des xylénols non utilisés. Le procédé se déroule en phase vapeur ou liquide, à des températures comprises entre 400 et 500 °C.
Les catalyseurs couramment utilisés dans ces réactions comprennent l’oxyde d’aluminium, l’oxyde de chrome-oxyde d’aluminium, la silice-alumine, l’oxyde métallique-oxyde de fer et l’oxyde de magnésium-oxyde de tungstène.
Pour le 2,6-xylénol, la transméthylation et l’isomérisation qui l’accompagne peuvent se produire sans catalyseur. Cette conversion non catalytique peut être réalisée en phase vapeur à 550-600 °C ou en discontinu en phase liquide à 420-470 °C. Ces méthodes permettent d’améliorer le rendement global en o-crésol issu de la méthylation du phénol.
Chiyoda Chemical Engineering Construction Co. a développé un procédé d’isomérisation-transalkylation pour les mélanges d’isomères de crésol. Ce procédé consiste à faire réagir des mélanges de crésol avec du phénol sur des catalyseurs silice-alumine à 400 °C sous pression normale.
Le mélange obtenu peut être rectifié pour isoler l’o-crésol pur, tous les autres composants phénoliques étant recyclés.
Historiquement, les tentatives d’isomérisation de l’o-crésol en m- et p-crésol (en raison de la fluctuation de la demande) à l’aide de catalyseurs tels que le chlorure d’aluminium, le fluorure d’aluminium, le trifluorure de bore, les silicates d’aluminium ou l’oxyde d’aluminium se sont révélées largement insatisfaisantes. Ces méthodes entraînaient souvent des réactions secondaires indésirables, telles que la résinification et la dismutation en phénol et en diméthylphénols.
Cependant, une isomérisation sans dismutation substantielle est réalisable grâce aux zéolites silice-alumine du groupe ZSM. À environ 400 °C, avec des conversions d’o-crésol de 40 à 50 %, ces catalyseurs permettent d’atteindre des sélectivités m-/p-crésol de 90 % et un rapport m:p de 7:3.
5. Autres procédés de production de crésols
Au-delà des principales méthodes industrielles, plusieurs synthèses alternatives de crésols ont été explorées, visant souvent la sélectivité isomérique. Ces procédés ne sont généralement pas encore utilisés à l’échelle industrielle.
5.1. Oxychloration Gulf
Ce procédé consiste à oxychlorer le toluène avec de l’acide chlorhydrique aqueux et de l’oxygène, catalysé par de l’acide nitrique et un sel de palladium ou de cuivre, à environ 100 °C. Il produit principalement de l’o- et du p-chlorotoluène avec une sélectivité élevée.
L’hydrolyse subséquente en phase vapeur du chlorotoluène produit du crésol, l’acide chlorhydrique libéré étant recyclé. Bien qu’efficace et offrant une conversion et une sélectivité élevées, ce procédé d’oxychloration du toluène exige un recyclage important et des matières végétales résistantes à la corrosion.
5.2. Décarboxylation oxydative des acides méthylbenzoïques
Les acides méthylbenzoïques peuvent être décarboxylés en crésols par passage d’un mélange air-vapeur à travers leur masse fondue à 200-240 °C, catalysé par des sels de cuivre et de magnésium.
L’oxydation en phase vapeur avec des mélanges oxygène-azote sur des catalyseurs mixtes à environ 300 °C donne de meilleurs résultats, l’acide méta-méthylbenzoïque produisant sélectivement du m-crésol. Cette méthode est plus complexe que la production de phénol et présente des difficultés liées à la formation de goudron et à la génération de sous-produits.
5.3. Oxydation de Baeyer-Villiger du p- ou o-méthylbenzaldéhyde
Cette voie produit spécifiquement du p-crésol à partir du p-méthylbenzaldéhyde (ou de l’o-crésol à partir de l’o-méthylbenzaldéhyde). Elle implique la réaction du méthylbenzaldéhyde avec l’acide performique (produit à partir de peroxyde d’hydrogène et d’acide formique) pour former un formiate de tolyle, qui est ensuite hydrolysé en crésol et en acide formique. Ce procédé offre des rendements élevés, l’acide formique étant largement recyclé.
5.4. Hydroxylation du noyau du toluène
Ce procédé implique l’hydroxylation directe du toluène (ou du xylène) à l’aide de divers oxydants (par exemple, oxygène, peroxyde d’hydrogène, peroxydes organiques) et systèmes catalytiques (par exemple, catalyseurs de Friedel-Crafts, composés de métaux de transition, micro-organismes).
Bien que largement étudié, l’isolement des crésols à partir de solutions diluées et la nécessité d’un recyclage important d’auxiliaires coûteux constituent des défis. Par exemple, certains micro-organismes peuvent produire du p-crésol de manière régiosélective, et certains systèmes utilisant du peroxyde d’hydrogène avec des acides forts ou des zéolites modifiées au titane produisent des mélanges d’o- et de p-crésol.
5.5. Méthylation oxydative du toluène
Ce procédé implique l’oxydation adiabatique du toluène avec de l’oxygène, du méthane et de la vapeur à haute température (700–750 °C) dans un réacteur tubulaire. Il produit un mélange d’aromatiques comprenant de l’éthylbenzène, du styrène, du benzène, du phénol et du crésol, ce qui suggère un potentiel de production de crésol à l’échelle pétrochimique.
5.6. Réaction de Hock des dérivés du toluène
Comme pour le procédé cymène-crésol, d’autres dérivés du toluène peuvent subir une peroxydation et un clivage pour produire du crésol et un composé carbonylé correspondant. L’éthylidènebis(p-méthylbenzène) et le 4-méthylcyclohexylbenzène, par exemple, peuvent être adaptés pour produire du p-crésol.
L’oxydation du xylène en présence d’acide acétique peut également produire de l’acétate de crésyle, qui est ensuite hydrolysé en crésol.
5.7. Hydrogénation des N,N’-dialkylaminométhylphénols
Cette méthode implique la réaction du phénol avec du paraformaldéhyde et une amine secondaire (par exemple, la pipéridine) pour former des aminométhylphénols, qui sont ensuite hydrogénés sur un catalyseur palladium-carbone. On obtient ainsi généralement de l’o-crésol et du p-crésol dans un rapport molaire de 1:2, avec des rendements élevés basés sur le phénol converti.
5.8. Cycle de Diels-Alder de l’isoprène et de l’acétate de vinyle
Cette voie de synthèse en trois étapes produit sélectivement du p-crésol. L’isoprène réagit avec l’acétate de vinyle lors d’une cycloaddition de Diels-Alder pour former de l’acétate de 1-méthylcyclohexén-4-yle, qui est ensuite saponifié. Le 1-méthylcyclohexén-4-ol ainsi obtenu est ensuite déshydrogéné par catalyse en p-crésol.
Références
- Cresols and Xylenols; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/abs/10.1002/14356007.a08_025
- Methylation of phenols. – https://patents.google.com/patent/US3446856A/en
- Synthesis method of o-cresol and m-cresol. – https://patents.google.com/patent/CN103992210A/en
