Méthodes de production d’hydrazine
La majorité des voies potentielles d’obtention de l’hydrazine sont limitées en raison de la disponibilité des matières premières et des coûts de production. L’azote et l’ammoniac se distinguent comme les seuls matériaux de départ viables pour un processus plus simple.
Une évaluation de la variation d’énergie libre standard ΔF°(g) (298 K) au sein du système gazeux H2-N2-NH3-N2H4 indique que la synthèse directe d’hydrazine à partir d’azote et d’hydrogène est énergétiquement défavorable. L’énergie libre de formation favorise fortement la production d’ammoniac.
Malgré les efforts en cours, il n’existe actuellement aucune solution pratique ou rentable pour réduire sélectivement l’azote. Par conséquent, l’ammoniac reste la seule source d’azote valable pour la production d’hydrazine.
Sur le papier, le couplage de deux molécules d’ammoniac avec production simultanée d’hydrogène semble être un processus attrayant. Cependant, il est à la fois endothermique et très inefficace.
Par exemple, diverses méthodes telles que la décharge électrique, la photolyse ou la radiolyse utilisées pour décomposer l’ammoniac ne produisent que de faibles quantités d’hydrazine. Une approche alternative consiste à oxyder les atomes d’hydrogène séparés de l’ammoniac.
Dans l’industrie, seuls trois oxydants sont significatifs : le chlore, l’oxygène et le peroxyde d’hydrogène.
Un défi supplémentaire découle du fait que l’hydrazine, un agent réducteur beaucoup plus puissant que l’ammoniac, peut également réagir avec l’agent oxydant.
Le chlore a été largement utilisé dans le procédé Raschig, qui est toujours en activité. Pour empêcher une oxydation supplémentaire de l’hydrazine par le chlore, des conditions fortement diluées doivent être utilisées, ce qui donne des rendements ne dépassant pas 60 %.
L’hydrolyse des azines dérivées de l’acétone et de la méthyléthylcétone sous pression offre un moyen de produire de l’hydrazine tout en régénérant la cétone.
Bayer a considérablement amélioré les rendements en introduisant de l’acétone dans le procédé Raschig.
Dans les années 1970, PCUK (aujourd’hui Atochem) a développé un nouveau procédé efficace et respectueux de l’environnement basé sur l’oxydation de l’ammoniac par le peroxyde d’hydrogène en présence d’une cétone. Actuellement, la majeure partie de l’hydrazine est produite par le procédé de la kétazine, impliquant l’oxydation de l’ammoniac par le chlore ou le peroxyde d’hydrogène.
Table des matières
1. Processus de Raschig
Dans le procédé Raschig, l’oxydation de l’ammoniac est réalisée à l’aide d’hypochlorite de sodium, qui est obtenu en faisant réagir du chlore avec de l’hydroxyde de sodium.
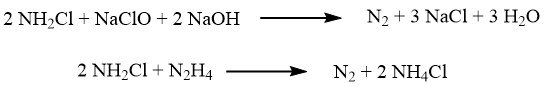
L’oxydation se déroule en deux étapes. Dans la première étape, réalisée à environ 5 °C, une réaction rapide forme de la chloramine :
Par la suite, le mélange réactionnel est combiné avec un excès important d’ammoniac (avec un rapport de 40:1), et une réaction lente qui conduit à l’hydrazine a lieu à des températures comprises entre 130 et 150 °C, sous une pression de 3,0 MPa :
Plusieurs réactions secondaires notables peuvent survenir, notamment :
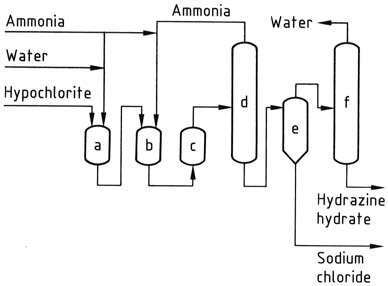
A la sortie du réacteur, la solution réactionnelle contient environ 1 % d’hydrate d’hydrazine et environ 4 % de chlorure de sodium. La pression est ensuite réduite aux niveaux atmosphériques à l’aide d’une série d’évaporateurs.
L’ammoniac est condensé, concentré et recyclé. La solution recueillie en bas des colonnes de stripping subit un dessalage dans un évaporateur de salage à circulation forcée classique. Le distillat résultant est encore concentré pour obtenir 100 % d’hydrate d’hydrazine.
Pour obtenir des rendements raisonnables dans ce processus, il est important d’utiliser des solutions diluées et de maintenir un rapport élevé d’ammoniac à l’hypochlorite. Cependant, les coûts associés à l’évaporation restent élevés, même avec des économies potentielles de vapeur.
2. Processus d’Olin Raschig
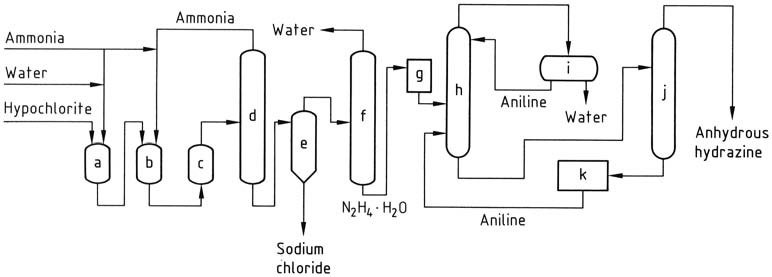
Dans le procédé Olin Raschig, pour la production d’hydrazine anhydre dans des applications aérospatiales, un contrôle précis est exercé sur la génération d’hypochlorite de sodium. Une basse température est employée pour empêcher la décomposition et la formation de chlorate, tout en maintenant un excès minimal d’hydroxyde de sodium.
La solution d’hypochlorite de sodium est combinée avec trois fois la quantité d’ammoniac à 5 ° C pour créer de la chloramine. Cette chloramine est ensuite rapidement introduite dans un excès de 30 fois d’ammoniac anhydre sous pression (20-30 MPa) et chauffée à 130 °C.
Le mélange réactionnel résultant, contenant 1 à 2 % d’hydrate d’hydrazine, subit un traitement similaire au procédé Raschig classique afin d’obtenir de l’hydrate d’hydrazine. L’hydrazine anhydre est obtenue par élimination de l’eau par distillation azéotropique avec de l’aniline dans une colonne fonctionnant à pression atmosphérique.
La condensation de la vapeur produit un distillat à deux couches, dans lequel la phase aqueuse est éliminée et la phase aniline est refluée au sommet de la colonne. L’hydrazine anhydre est récupérée en mélange avec l’aniline, qui peut ensuite être séparée par distillation.
3. Procédé d’urée
L’urée peut servir de source alternative d’ammoniac dans le procédé Raschig. Bien qu’elle ne soit pas actuellement employée pour la production commerciale d’hydrate d’hydrazine, cette approche a été utilisée à une échelle commerciale.
Au départ, il s’est avéré être la méthode la plus rentable pour les petits volumes de production. Cependant, à mesure que les plantes grandissaient, le procédé Raschig traditionnel est devenu plus favorable, rendant la méthode à base d’urée obsolète.
Depuis 1990, des quantités importantes d’hydrazodicarbonamide ont été fabriquées en Asie en utilisant le mélange réactionnel brut d’urée et d’hypochlorite de sodium comme source d’hydrazine.
Cependant, ce procédé particulier implique la génération substantielle de sous-produits et nécessite un traitement coûteux des effluents. En conséquence, il est susceptible de devenir obsolète avec le temps.
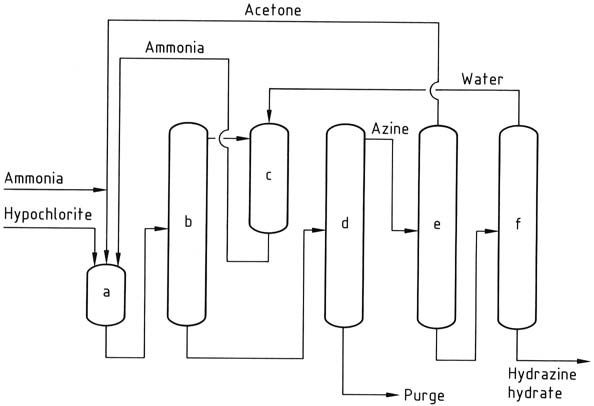
4. Procédé Kétazine de Bayer
Le procédé Bayer est une version modifiée du procédé Raschig qui implique la réaction de la chloramine avec de l’ammoniac en présence d’acétone à un pH compris entre 12 et 14 :
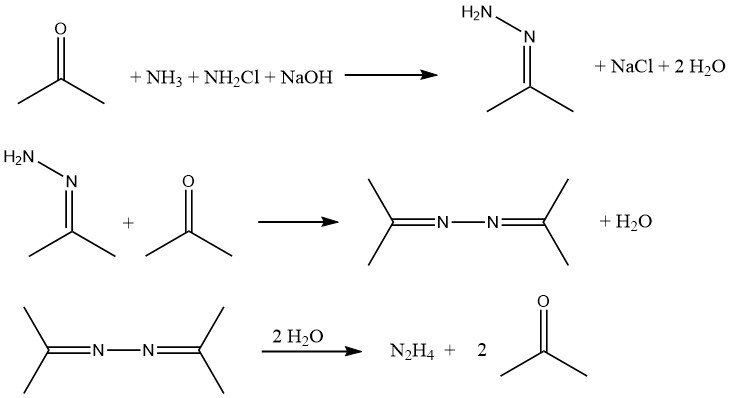
Simultanément et en continu, de l’hypochlorite de sodium, de l’acétone et une solution aqueuse à 20 % d’ammoniac (dans un rapport molaire de 1:2:20, respectivement) sont introduits dans un réacteur à environ 35 °C et 200 kPa.
L’ammoniac en excès est éliminé du mélange réactionnel par rectification, puis trempé avec de l’eau et recyclé vers le réacteur sous forme de solution aqueuse.
La solution aqueuse résultante contenant de la diméthylcétazine, avec de l’acétone résiduelle, du chlorure de sodium et des impuretés organiques, est introduite dans une colonne de distillation. Dans cette colonne, la diméthylcétazine est récupérée sous forme d’un azéotrope aqueux (constitué de 55 % de diméthylcétazine) à pression atmosphérique (point d’ébullition de 95 °C à 101,3 kPa).
L’introduction d’acétone dans la colonne de distillation est destinée à éviter une hydrolyse prématurée de la cétazine. Le sous-produit obtenu à partir de l’alambic est une solution de chlorure de sodium qui contient des traces d’hydrazine et de composés organiques. Cette solution nécessite un traitement avant élimination ou recyclage vers l’électrolyse.
Ensuite, la diméthylcétazine subit une hydrolyse dans une colonne de distillation sous pression (fonctionnant à 0,8-1,2 MPa), produisant de l’acétone, qui est recyclée vers le réacteur, et une solution aqueuse à 10 % d’hydrazine. La solution d’hydrazine est ensuite concentrée jusqu’à une teneur en hydrazine de 64 %.
5. Processus Fisons
Le processus, initialement mis en œuvre par Whiffen and Sons, a été développé par Fisons et est devenu opérationnel dans les années 1960. Dans ce procédé, la méthyléthylcétone a été utilisée à la place de l’acétone pour capturer l’hydrazine, et l’étape d’hydrolyse impliquait l’utilisation d’acide sulfurique.
Cependant, ce processus particulier n’est plus en vigueur.
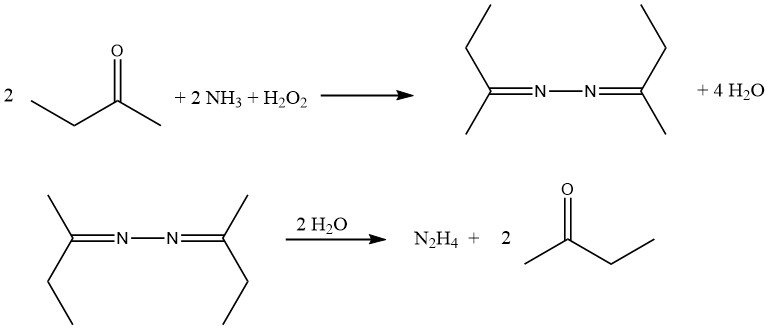
6. Processus de peroxyde
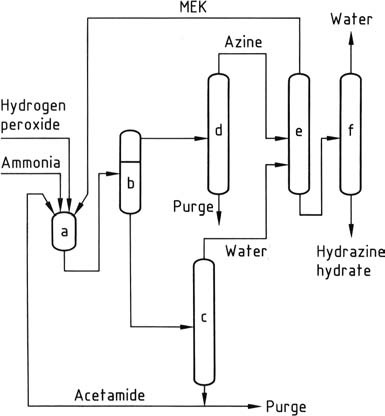
Le procédé à l’hydrazine le plus récent, développé par PCUK et actuellement utilisé par ATOFINA en France et Mitsubishi Gas au Japon, utilise le peroxyde d’hydrogène comme agent oxydant. La réaction a lieu à pression atmosphérique et à 50 °C en présence de méthyléthylcétone (MEK), avec un rapport H2O2:MEK:NH3 de 1:2:4.
Pour activer le peroxyde d’hydrogène, l’acétamide et l’hydrogénophosphate disodique sont employés par ATOFINA, tandis que Mitsubishi Gas utilise un composé d’arsenic. La réaction globale conduit à la formation de méthyléthylcétazine avec un rendement élevé.
Le mécanisme de réaction implique l’activation à la fois de l’ammoniac et du peroxyde d’hydrogène puisque ces deux réactifs ne réagissent pas naturellement l’un avec l’autre, contrairement à l’ammoniac et à l’hypochlorite dans le procédé Bayer. La réaction se déroule par la formation d’un intermédiaire oxaziridine, qui est capable d’oxyder l’ammoniac en un dérivé d’hydrazine.
En raison de l’insolubilité de la méthyléthylcétazine dans le mélange réactionnel, elle peut être facilement séparée par décantation. La cétazine séparée est ensuite purifiée par distillation. Sous pression (0,8-10 MPa), la cétazine purifiée est hydrolysée, ce qui donne de l’hydrazine aqueuse concentrée et de la méthyléthylcétone, qui est recyclée.
La phase aqueuse contenant l’activateur est concentrée pour éliminer l’eau et ensuite recyclée vers les réacteurs après élimination des impuretés solubles dans l’eau par une purge. Le procédé au peroxyde offre plusieurs avantages par rapport aux autres méthodes, notamment l’absence de sous-produits salins, des rendements élevés, une faible consommation d’énergie, un excès molaire minimal et aucune exigence de traitement des effluents aqueux.
Référence
- Hydrazine; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a13_177
