La mayoría de las vías potenciales para obtener hidrazina son limitadas debido a la disponibilidad de materias primas y los costos de producción. El nitrógeno y el amoníaco destacan como los únicos materiales de partida viables para un proceso más sencillo.
Una evaluación de la variación estándar de energía libre ΔF°(g) (298 K) dentro del sistema gaseoso H2-N2-NH3-N2H4 indica que la síntesis directa de hidracina a partir de nitrógeno e hidrógeno es energéticamente desfavorable. La formación de energía libre favorece fuertemente la producción de amoníaco.
A pesar de los esfuerzos en curso, actualmente no existe una solución práctica o rentable para reducir selectivamente el nitrógeno. Por tanto, el amoníaco sigue siendo la única fuente valiosa de nitrógeno para la producción de hidracina.
Sobre el papel, el acoplamiento de dos moléculas de amoníaco con la producción simultánea de hidrógeno parece ser un proceso atractivo. Sin embargo, es a la vez endotérmico y altamente ineficiente.
Por ejemplo, diversos métodos, como la descarga eléctrica, la fotólisis o la radiólisis, utilizados para descomponer el amoníaco, producen sólo pequeñas cantidades de hidracina. Un enfoque alternativo implica oxidar los átomos de hidrógeno separados del amoníaco.
En un entorno industrial, sólo tres oxidantes son importantes: cloro, oxígeno y peróxido de hidrógeno.
Un desafío adicional surge del hecho de que la hidracina, un agente reductor mucho más fuerte que el amoníaco, también puede reaccionar con el agente oxidante.
El cloro se ha utilizado ampliamente en el proceso Raschig, que todavía está en funcionamiento. Para evitar una mayor oxidación de la hidracina por el cloro, se deben utilizar condiciones altamente diluidas, lo que da como resultado rendimientos no superiores al 60%.
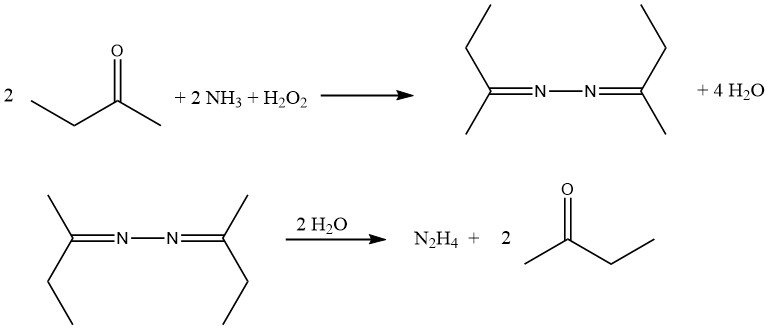
La hidrólisis de azinas derivadas de acetona y metiletilcetona bajo presión ofrece un medio para producir hidrazina mientras se regenera la cetona.
Bayer ha mejorado significativamente los rendimientos mediante la introducción de acetona en el proceso Raschig.
En la década de 1970, PCUK (ahora Atochem) desarrolló un proceso nuevo, eficiente y respetuoso con el medio ambiente basado en la oxidación de amoníaco mediante peróxido de hidrógeno en presencia de una cetona. Actualmente, la mayor parte de la hidracina se produce mediante el proceso de ketazina, que implica la oxidación del amoníaco mediante cloro o peróxido de hidrógeno.
Tabla de contenido
1. Proceso de Raschig
En el proceso Raschig, la oxidación del amoníaco se consigue utilizando hipoclorito de sodio, que se obtiene haciendo reaccionar cloro con hidróxido de sodio.
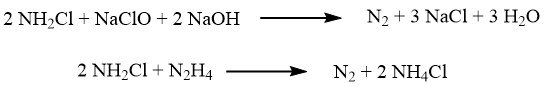
La oxidación se produce en dos pasos. En el primer paso, realizado a aproximadamente 5 °C, se forma una reacción rápida de cloramina:
Posteriormente, la mezcla de reacción se combina con un exceso importante de amoníaco (en una proporción de 40:1), y la lenta reacción que da lugar a la hidracina se produce a temperaturas entre 130 y 150 °C, bajo una presión de 3,0 MPa:
Pueden ocurrir varias reacciones secundarias notables, que incluyen:
Al salir del reactor, la solución de reacción contiene aproximadamente un 1% de hidrato de hidrazina y aproximadamente un 4% de cloruro de sodio. Luego, la presión se reduce a niveles atmosféricos utilizando una serie de evaporadores.
El amoníaco se condensa, concentra y recicla. La solución recogida en el fondo de las columnas de extracción se elimina de la sal en un evaporador de sal de circulación forzada convencional. El destilado resultante se concentra adicionalmente para obtener 100% de hidrato de hidrazina.
Para lograr rendimientos razonables en este proceso, es importante utilizar soluciones diluidas y mantener una proporción alta de amoníaco e hipoclorito. Sin embargo, los costos asociados con la evaporación siguen siendo altos, incluso con posibles ahorros de vapor.
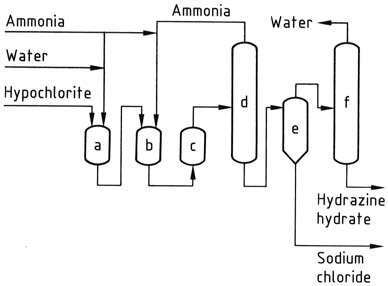
a) Reactor de cloramina; b), c) reactores de hidracina; d) evaporador de amoníaco; e) Hidracina – separador de cloruro de sodio; f) Concentrador de hidrato de hidracina
2. Proceso de Olin Raschig
En el proceso Olin Raschig, para la producción de hidracina anhidra en aplicaciones aeroespaciales, se ejerce un control preciso sobre la generación de hipoclorito de sodio. Se emplea una temperatura baja para evitar la descomposición y la formación de clorato, manteniendo al mismo tiempo un exceso mínimo de hidróxido de sodio.
La solución de hipoclorito de sodio se combina con tres veces la cantidad de amoníaco a 5 °C para crear cloramina. Luego, esta cloramina se introduce rápidamente en un exceso de 30 veces de amoníaco anhidro bajo presión (20-30 MPa) y se calienta a 130 °C.
La mezcla de reacción resultante, que contiene 1-2% de hidrato de hidrazina, se somete a un tratamiento similar al proceso Raschig convencional para obtener hidrato de hidrazina. La hidracina anhidra se obtiene eliminando agua mediante destilación azeotrópica con anilina en una columna que funciona a presión atmosférica.
La condensación del vapor produce un destilado con dos capas, en el que se elimina la fase acuosa y la fase de anilina se devuelve a reflujo a la parte superior de la columna. La hidrazina anhidra se recupera como una mezcla con anilina, que luego se puede separar mediante destilación.
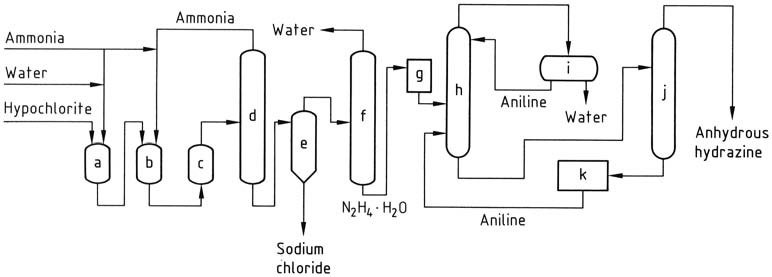
a) Reactor de cloramina; b), c) reactores de hidracina; d) evaporador de amoníaco; e) Hidracina – separador de cloruro de sodio; f) concentración de hidrato de hidracina; g) almacenamiento de hidrato de hidracina; h) deshidratación del hidrato de hidracina; i) Anilina – decantación de agua; j) Destilación de hidracina anhidra; k) Almacenamiento de anilina
3. Proceso de urea
La urea puede servir como fuente alternativa de amoníaco en el proceso Raschig. Si bien actualmente no se emplea para la producción comercial de hidrato de hidracina, este enfoque se ha utilizado a escala comercial.
Al principio demostró ser el método más rentable para volúmenes de producción más pequeños. Sin embargo, a medida que las plantas crecieron en tamaño, el proceso tradicional de Raschig se volvió más favorable, dejando obsoleto el método basado en urea.
Desde 1990, se han fabricado cantidades importantes de hidrazodicarbonamida en Asia utilizando la mezcla de reacción bruta de urea e hipoclorito de sodio como fuente de hidrazina.
Sin embargo, este proceso particular implica la generación sustancial de subproductos y requiere un tratamiento costoso de los efluentes. Como resultado, es probable que quede obsoleto con el tiempo.
4. Proceso de Bayer Ketazina
El proceso Bayer es una versión modificada del proceso Raschig que implica la reacción de cloramina con amoníaco en presencia de acetona en un rango de pH de 12 a 14:
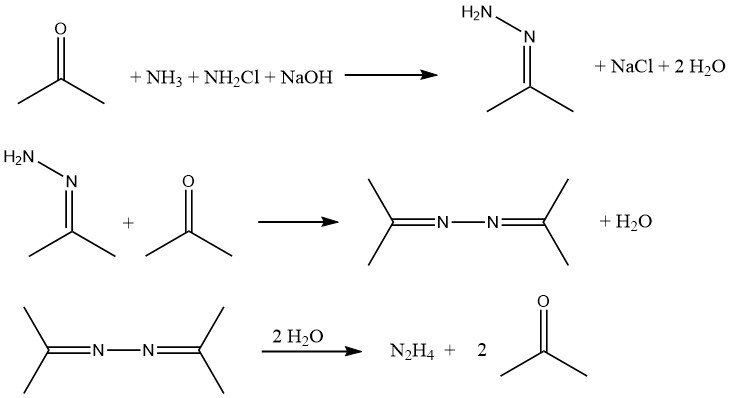
Simultáneamente y de forma continua, se introducen en un reactor hipoclorito de sodio, acetona y una solución acuosa de amoniaco al 20% (en una relación molar de 1:2:20, respectivamente) a aproximadamente 35 °C y 200 kPa.
El exceso de amoníaco se elimina de la mezcla de reacción mediante extracción, luego se enfría con agua y se recicla de nuevo al reactor como una solución acuosa.
La solución acuosa resultante que contiene dimetilcetazina, con acetona residual, cloruro de sodio e impurezas orgánicas, se alimenta a una columna de destilación. En esta columna, la dimetilcetazina se recupera como un azeótropo acuoso (que consta de 55 % de dimetilcetazina) a presión atmosférica (punto de ebullición de 95 °C a 101,3 kPa).
La introducción de acetona en la columna de destilación tiene como objetivo evitar la hidrólisis prematura de la ketazina. El subproducto que se obtiene del alambique es una solución de cloruro de sodio que contiene trazas de hidracina y compuestos orgánicos. Esta solución requiere tratamiento antes de su eliminación o reciclaje para electrólisis.
A continuación, la dimetilcetazina se hidrólisis en una columna de destilación presurizada (que funciona a 0,8-1,2 MPa), produciendo acetona, que se recicla de nuevo al reactor, y una solución acuosa de hidrazina al 10%. A continuación se concentra la solución de hidracina hasta un contenido de hidracina del 64%.
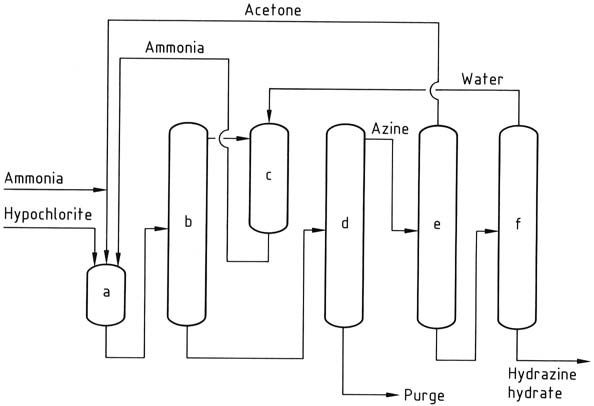
a) Reactor de azina; b) Decapado de amoníaco; c) enfriamiento con amoníaco; d) destilación de azina; e) hidrólisis de azina; f) Concentración de hidrato de hidracina
5. Proceso de fisonismo
El proceso, implementado inicialmente por Whiffen and Sons, fue desarrollado aún más por Fisons y entró en funcionamiento en la década de 1960. En este proceso, se empleó metiletilcetona en lugar de acetona para capturar la hidrazina, y el paso de hidrólisis implicó el uso de ácido sulfúrico.
Sin embargo, este proceso en particular ya no está en funcionamiento.
6. Proceso de peróxido
El proceso de hidracina más reciente, desarrollado por PCUK y actualmente empleado por ATOFINA en Francia y Mitsubishi Gas en Japón, utiliza peróxido de hidrógeno como agente oxidante. La reacción tiene lugar a presión atmosférica y 50 °C en presencia de metiletilcetona (MEK), con una relación H2O2:MEK:NH3 de 1:2:4.
Para activar el peróxido de hidrógeno, ATOFINA emplea acetamida e hidrógeno fosfato disódico, mientras que Mitsubishi Gas utiliza un compuesto de arsénico. La reacción global conduce a la formación de metil etil cetazina con alto rendimiento.
El mecanismo de reacción implica la activación tanto del amoníaco como del peróxido de hidrógeno, ya que estos dos reactivos no reaccionan naturalmente entre sí, a diferencia del amoníaco y el hipoclorito en el proceso Bayer. La reacción procede mediante la formación de un intermedio de oxaziridina, que es capaz de oxidar el amoníaco a un derivado de hidrazina.
Debido a la insolubilidad de la metil etil cetazina en la mezcla de reacción, se puede separar fácilmente mediante decantación. La ketazina separada luego se purifica mediante destilación. Bajo presión (0,8-10 MPa), la ketazina purificada se hidroliza, dando como resultado hidrazina acuosa concentrada y metiletilcetona de cabeza, que se recicla.
La capa acuosa que contiene el activador se concentra para eliminar el agua y posteriormente se recicla de nuevo a los reactores después de eliminar las impurezas solubles en agua mediante una purga. El proceso de peróxido ofrece varias ventajas sobre otros métodos, incluida la ausencia de subproductos salinos, altos rendimientos, bajo consumo de energía, exceso molar mínimo y no requiere tratamiento de efluentes acuosos.
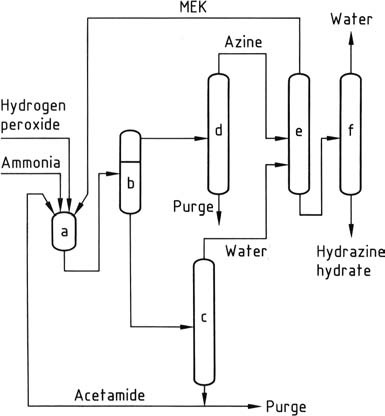
a) Reactor de azina; b) Separador de fases; c) concentración de la fase acuosa; d) purificación de azina; e) hidrólisis de azina; f) Concentración de hidrato de hidracina
Referencia
- Hydrazine; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a13_177

