Méthanol: production, réactions et utilisations
Le méthanol, également connu sous le nom d’alcool de bois, est un composé chimique de formule CH3OH. C’est un liquide incolore et inflammable avec une odeur alcoolique distinctive. Le méthanol est l’alcool le plus simple et l’alcool le plus important industriellement.
Le méthanol est une matière première chimique clé utilisée dans la production d’une large gamme de produits, notamment les plastiques, les peintures et les produits pharmaceutiques. Il est également utilisé comme combustible et source d’énergie.
Le méthanol a été isolé pour la première fois au XVIIe siècle, mais ce n’est qu’au début du XXe siècle qu’il a commencé à être produit à l’échelle commerciale. Aujourd’hui, le méthanol est produit à l’aide de divers procédés, mais la méthode la plus courante consiste à faire réagir du monoxyde de carbone et de l’hydrogène en présence d’un catalyseur à base d’oxyde de cuivre.
Le méthanol est une molécule très polyvalente et peut être convertie en un large éventail d’autres produits chimiques par diverses réactions chimiques. Par exemple, le méthanol peut être utilisé pour produire du formaldéhyde, de l’acide acétique et du méthacrylate de méthyle.
Le méthanol est également utilisé comme carburant et source d’énergie. Il peut être mélangé à de l’essence pour réduire les émissions, et peut également être utilisé dans les piles à combustible pour produire de l’électricité.
Table des matières
1. Propriétés physiques du méthanol
Le méthanol est un liquide incolore à haute polarité et à pression de vapeur moyenne. C’est un solvant polyvalent qui peut dissoudre un large éventail de substances, notamment l’eau, les alcools et d’autres solvants organiques. Il est miscible dans une mesure limitée aux huiles et aux graisses.
Le méthanol possède les propriétés physiques présentées dans le tableau suivant :
| Propriété | Valeur |
|---|---|
| État physique | Liquide |
| Couleur | Incolore |
| Odeur | Légèrement sucré, alcoolisé |
| Point de fusion | −97,6 °C (−143,7 °F ; 175,6 K) |
| Point d'ébullition | 64,7 °C (148,5 °F ; 337,8 K) |
| Densité | 0,792 g/cm³ |
| Solubilité dans l'eau | Miscible |
| Pression de vapeur | 160 mmHg à 20 °C (68 °F) |
| Point d'éclair | 11 °C (52 °F) |
| Limites d'inflammabilité | 6,7 à 36 % en volume dans l'air |
| Température d'auto-inflammation | 455 °C (851 °F) |
2. Réactions chimiques du méthanol
Le méthanol est l’alcool le plus simple et sa réactivité est déterminée par le groupe hydroxyle. Le méthanol réagit en clivant la liaison C-O ou O-H, et le groupe hydrogène ou hydroxyle peut être substitué. Contrairement aux alcools supérieurs, le méthanol ne peut pas subir de bêta-élimination pour former une liaison multiple.
Les réactions industrielles importantes du méthanol comprennent :
- Déshydrogénation et déshydrogénation oxydative
- Carbonylation
- Estérification avec des acides organiques ou inorganiques et des dérivés acides
- Ethérification
- Addition aux liaisons insaturées
- Remplacement des groupes hydroxyles
1. Combustion du méthanol : le méthanol peut subir une combustion, qui est une réaction chimique impliquant la combinaison du méthanol avec de l’oxygène gazeux (O2) pour produire du dioxyde de carbone (CO2), de l’eau (H2O) et de l’énergie.
2CH3OH + 3O2 → 2CO2 + 4H2O + énergie
Cette réaction est exothermique et produit beaucoup de chaleur, faisant du méthanol un carburant utile.
2. Estérification : Le méthanol peut réagir avec les acides carboxyliques pour produire des esters, qui sont des composés organiques ayant une odeur sucrée caractéristique. Cette réaction est catalysée par un catalyseur acide, tel que l’acide sulfurique ou l’acide chlorhydrique.
RCOOH + CH3OH → RCOOCH3 + H2O
3. Déshydratation : Le méthanol peut subir une déshydratation, qui est une réaction chimique qui implique l’élimination des molécules d’eau du méthanol pour produire de l’éther diméthylique (DME). Cette réaction est catalysée par un catalyseur acide, tel que l’alumine ou la zéolithe.
2CH3OH → CH3OCH3 + H2O
4. Oxydation : Le méthanol peut être oxydé pour produire du formaldéhyde (HCHO), qui est un composé intermédiaire utile dans la production de divers produits chimiques.
2CH3OH + O2 → 2HCHO + 2H2O
Cette réaction est généralement catalysée par un catalyseur métallique, tel que le cuivre ou l’argent.
5. Méthylation : Le méthanol peut être utilisé comme source de groupes méthyles (-CH3) dans diverses réactions chimiques, telles que la méthylation des phénols pour produire des méthylphénols.
C6H5OH + CH3OH → C6H4(OCH3)OH + H2O
3. Production de méthanol
Le méthanol est actuellement produit à l’échelle industrielle en utilisant une conversion catalytique du gaz de synthèse à basse pression. Ce procédé présente des coûts d’investissement et de production inférieurs, une fiabilité opérationnelle améliorée et une plus grande flexibilité que les autres méthodes.
La production de méthanol peut être divisée en trois étapes principales :
- Production de gaz de synthèse
- Synthèse du méthanol
- Traitement du méthanol brut
3.1. Production de gaz de synthèse
Le gaz de synthèse peut être produit à partir de diverses matières carbonées, notamment le charbon, le coke, le gaz naturel, le pétrole et les fractions pétrolières. Le gaz naturel est la matière première la plus courante pour la production de gaz de synthèse à grande échelle pour la synthèse du méthanol.
La composition du gaz de synthèse nécessaire à la synthèse du méthanol est caractérisée par le nombre stoechiométrique S, qui est défini comme suit :
S = (H2 – CO2)/(CO + CO2)
Le nombre de stœchiométrie doit être d’au moins 2,0 pour le mélange gazeux de synthèse. Les valeurs supérieures à 2,0 indiquent un excès d’hydrogène, tandis que les valeurs inférieures à 2,0 indiquent un déficit en hydrogène.
Un déficit en hydrogène réduira la sélectivité en méthanol, tandis qu’un excès d’hydrogène augmentera la taille de la boucle de synthèse. Par conséquent, une composition de gaz de synthèse avec un nombre stoechiométrique légèrement supérieur à 2,0 est optimale pour la synthèse du méthanol.
3.1.1. Gaz de synthèse à partir du gaz naturel
La majeure partie du méthanol produit dans le monde provient du gaz naturel, qui peut être craqué par reformage à la vapeur, reformage autothermique, une combinaison de ceux-ci ou par oxydation partielle.
Reformage à la vapeur
Dans le reformage à la vapeur, la charge de gaz naturel est craquée catalytiquement en l’absence d’oxygène avec ajout de vapeur et éventuellement de dioxyde de carbone. Cela produit un gaz de synthèse avec un nombre stoechiométrique bien supérieur à 2,0.
Le nombre stoechiométrique peut être ajusté à la valeur souhaitée légèrement supérieure à 2,0 en ajoutant du CO2 en amont ou en aval du reformeur à vapeur. La chaleur nécessaire à la réaction est fournie de l’extérieur.
Reformage autothermique
Dans le reformage autothermique, la charge de gaz naturel est convertie par oxydation partielle avec de l’oxygène et réaction sur un catalyseur à base de Ni. La chaleur nécessaire à la réaction est fournie par la réaction d’oxydation partielle exothermique.
Le gaz de synthèse obtenu est caractérisé par un déficit en hydrogène, il faut donc ajouter de l’hydrogène avant son acheminement vers la boucle de synthèse du méthanol.
Combinaison de reformage à vapeur et autothermique
Dans une combinaison des deux procédés, seule une partie du flux de gaz naturel est soumise au reformage à la vapeur. Le reste est introduit avec le gaz de reformage à la vapeur dans un reformeur autothermique (ATR) rempli de catalyseur à base de Ni.
Dans l’ATR, le gaz naturel est partiellement oxydé par l’oxygène. L’indice stoechiométrique du gaz de synthèse peut être ajusté légèrement au-dessus de 2,0 en ajustant la répartition entre le reformage à la vapeur et le reformage autothermique et en sélectionnant les paramètres de processus appropriés.
Oxydation partielle
En oxydation partielle, la charge de gaz naturel est craquée sans catalyseur par oxydation directe avec de l’oxygène. Cela génère de la chaleur pour la réaction.
3.1.2. Gaz de synthèse à partir d’autres matières premières
Hydrocarbures
Les hydrocarbures supérieurs, tels que le gaz de pétrole liquéfié, les gaz de raffinerie et le naphta, peuvent également être utilisés comme matières premières pour la production de gaz de synthèse pour les usines de méthanol. Ils sont traités principalement par reformage à la vapeur.
Pétrole brut, pétrole lourd, goudron et asphalte
Le pétrole brut, le pétrole lourd, le goudron et les produits asphaltiques peuvent également être convertis en gaz de synthèse, mais cela est plus difficile qu’avec le gaz naturel. Leur teneur en soufre est considérablement plus élevée (0,7-1,5 % H2S et COS) et doit être diminuée.
Le gaz de synthèse produit contient également un excès de monoxyde de carbone et doit donc être soumis à une conversion de vitesse avec de l’eau. L’excès de dioxyde de carbone qui en résulte est éliminé du gaz. L’épuration des gaz et l’élimination du dioxyde de carbone peuvent être réalisées, par exemple, dans le cadre d’un procédé Rectisol.
Charbon
Le charbon peut être converti en gaz de synthèse avec de la vapeur et de l’oxygène par divers procédés à différentes pressions (0,5 à 8 MPa) et températures (400 à 1 500 °C). Le gaz de synthèse à base de charbon doit être désulfuré et soumis à une conversion de déplacement pour obtenir la stœchiométrie requise.
3.2. Synthèse du méthanol
Le méthanol est synthétisé à partir du gaz de synthèse dans un réacteur à 200-300 °C et 5-10 MPa. La réaction est exothermique, il faut donc évacuer la chaleur pour éviter une surchauffe du réacteur.
Le gaz sortant du réacteur est refroidi et le méthanol est condensé. Le gaz restant est recyclé vers le réacteur, avec le gaz de synthèse frais. Cela est nécessaire car seulement 50 à 80 % du gaz de synthèse est converti en méthanol en un seul passage.
Le méthanol brut est ensuite purifié et distillé. Le gaz de purge provenant de la boucle de recyclage est utilisé pour chauffer le reformeur.
Développement de la technologie
Jusqu’en 1997, la principale différence entre les procédés industriels de méthanol à basse pression résidait dans la conception du réacteur. La capacité maximale des usines de méthanol était de 2 500 à 3 000 t/j.
En 1997, Lurgi a introduit le procédé MegaMéthanol, qui combine différents types de réacteurs avec une usine de production de gaz de synthèse à grande échelle. Cela a ouvert la voie à des usines de méthanol d’une capacité allant jusqu’à 10 000 t/j par train.
Il existe aujourd’hui diverses technologies de synthèse du méthanol, chacune présentant ses propres avantages et inconvénients. Les principaux fournisseurs de technologie sont Lurgi, JM/Davy, Topsøe, MGC, JM/Uhde, JM/Jacobs, JM/Others et JM/Toyo.
Toutes ces technologies sont basées sur des concepts hautement intégrés qui incluent toutes les étapes depuis la gazéification et l’épuration des gaz jusqu’à la synthèse et le traitement. Cela permet d’obtenir des efficacités énergétiques et carbone élevées allant respectivement jusqu’à 67 % et 83 %.
3.2.1. Conception du réacteur
Le méthanol est produit à l’échelle industrielle depuis les années 1960, et plusieurs modèles de réacteurs de base différents sont encore utilisés aujourd’hui. La meilleure conception pour une centrale particulière dépendra des exigences spécifiques, telles que la source de carbone, la disponibilité des services publics et l’intégration de la chaleur.
Réacteurs adiabatiques
Les réacteurs adiabatiques n’évacuent pas de chaleur pendant la réaction, donc la température augmente progressivement le long de l’axe du réacteur. Ceci peut être atténué en éteignant la réaction avec du gaz froid en plusieurs points, ou en utilisant une série de lits de réacteurs avec des refroidisseurs intermédiaires.
Réacteurs quasi-isothermes
Les réacteurs quasi-isothermes maintiennent une température relativement constante dans tout le réacteur. Cela se fait généralement en utilisant un réacteur tubulaire refroidi par eau bouillante. Il existe également des réacteurs refroidis au gaz, dans lesquels la chaleur de réaction est transférée au gaz de réaction.
Conceptions de réacteurs spécifiques
Certaines conceptions spécifiques de réacteurs au méthanol comprennent :
- Réacteur quasi-isotherme standard : Ce réacteur utilise un réacteur tubulaire avec refroidissement par eau bouillante.
- Réacteur Variobar : ce réacteur utilise un réacteur à coque et tubes enroulé sur plusieurs niveaux, avec des tubes de refroidissement intégrés dans le garnissage du catalyseur.
- Réacteur refroidi au gaz : ce réacteur est doté d’un lit de catalyseur côté coque et le gaz de synthèse s’écoule à travers le lit de catalyseur dans une direction axiale, radiale ou axiale-radiale.
- Superconvertisseur : Ce réacteur utilise des tubes à double paroi remplis de catalyseur dans l’espace annulaire. Le gaz de synthèse circule d’abord à travers le tube interne pour le réchauffer, puis dans le sens inverse à travers le lit catalytique pour libérer la chaleur de réaction.
3.2.2. Conceptions de boucles de synthèse de méthanol à grande échelle
Le méthanol est un bon vecteur énergétique pour les zones reculées car il peut être facilement transporté. Toutefois, pour être économiques, les usines de production de méthanol doivent être à grande échelle. Cela signifie que le taux de conversion du gaz de synthèse en méthanol doit être élevé, afin que la quantité de gaz circulant dans la boucle soit minimisée.
Une conception pour une usine de synthèse de méthanol à conversion élevée est la synthèse de méthanol à convertisseur combiné Lurgi (Figure 1). Ce procédé utilise deux réacteurs en parallèle : un réacteur à eau bouillante quasi-isotherme et un réacteur refroidi au gaz.
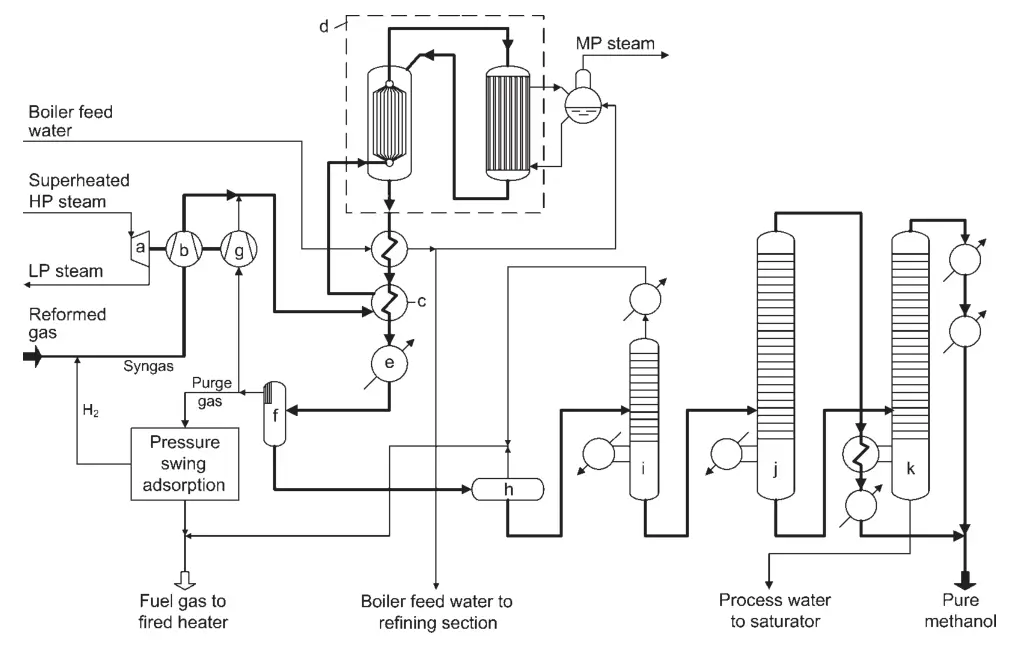
a) Turbine pour gaz de synthèse et compresseur de recyclage ; b) Compresseur de gaz de synthèse ; c) Garniture chauffante ; d) Système de conversion combiné ; e) Refroidisseur final ; f) Séparateur de méthanol ; g) Compresseur de gaz de recyclage ; h) Vase d'expansion ; i) Colonne aux extrémités légères ; j) Colonne sous pression de méthanol pur ; k) Colonne de méthanol atmosphérique
Le réacteur quasi-isotherme convertit la partie la plus réactive du gaz de synthèse, tandis que le réacteur refroidi au gaz convertit le gaz restant. La chaleur de réaction provenant du réacteur refroidi au gaz est utilisée pour préchauffer le gaz d’entrée du réacteur pour le réacteur quasi-isotherme.
Une autre conception pour une usine de synthèse de méthanol à haute conversion est la technologie en boucle en série de Davy Process Technology (Figure 2). Ce procédé utilise deux réacteurs en série, avec le même gaz de circulation utilisé deux fois. La force motrice de la réaction est maintenue par la condensation du méthanol entre les deux réacteurs.
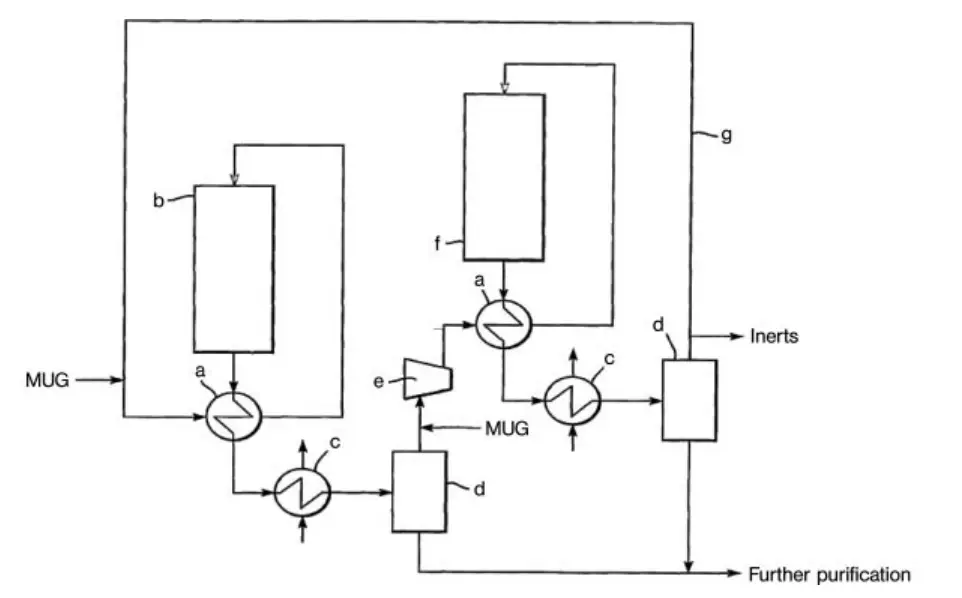
a) Interchangeur ; b) Réacteur ; c) Condenseur ; d) Séparateur gaz-liquide ; e) Circulateur ; f) Réacteur final ; g) Conduite de gaz de recyclage
3.3. Voies de synthèse alternatives du méthanol
3.3.1. CO2 en méthanol
La valorisation chimique du CO2 par hydrogénation en méthanol est étudiée depuis le début des années 1990. Cependant, ce n’est qu’au cours des dernières années qu’il a suscité un intérêt commercial en raison de la prise de conscience croissante de la nécessité de réduire les émissions de CO2 et du développement de politiques gouvernementales telles que les taxes sur le carbone et les programmes de plafonnement et d’échange.
Plusieurs entreprises ont développé des systèmes de catalyseurs et des concepts de processus pour la production de CO2 en méthanol. Cependant, les résultats à l’échelle pilote sont rares et les seuls projets de démonstration à l’échelle sont ceux de Mitsui Chemicals et Carbonrecycling, en Islande.
Les connaissances de base sur la technologie de transformation du CO2 en méthanol sont déjà disponibles, mais les véritables défis sont la production d’hydrogène renouvelable et la production économique de CO2 propre à partir des flux de gaz résiduaires.
Les facteurs politiques, écologiques et économiques décideront si et quand cette technologie sera commercialisée.
3.3.2. Synthèse du méthanol en phase liquide
Le méthanol peut également être produit en convertissant le monoxyde de carbone (CO) avec de l’hydrogène dans une phase liquide, généralement du méthanol. En utilisant des conditions de réaction appropriées et des systèmes catalytiques contenant des composants alcalins, des productivités significatives allant jusqu’à 1,3 kg kgcat⁻¹ h⁻¹ peuvent être atteintes.
Le mécanisme réactionnel en phase liquide est différent de celui en phase gazeuse. Cela implique la carbonylation du méthanol (ou d’un alcool supérieur) en ester méthylique respectif, suivie d’une hydrogénolyse en alcool et méthanol respectifs.
À la fin des années 1990, une usine de démonstration de synthèse de méthanol en phase liquide a été mise en service par le ministère américain de l’Énergie (DOE), en collaboration avec Eastman et Air Products. Cependant, il a été constaté que les durées de vie des catalyseurs sont inférieures à celles des procédés conventionnels (meilleur cas : 0,17 %/j à 215 °C). L’eau et le CO2 ont un effet négatif sur les performances du catalyseur.
Malgré ces défis, les recherches sur la synthèse du méthanol en phase liquide se poursuivent. Ce concept est prometteur car il pourrait être plus efficace et moins coûteux que la synthèse conventionnelle de méthanol en phase gazeuse.
3.3.3. Oxydation directe du méthane
L’oxydation directe du méthane en méthanol est une réaction hautement souhaitable, mais elle est également très difficile. En effet, la réaction est défavorable à la fois cinétiquement et thermodynamiquement.
La plupart des systèmes catalytiques pour l’oxydation directe du méthane en méthanol donnent soit une faible conversion (<10 %), soit une faible sélectivité (<80 %). Cependant, certaines entreprises affirment avoir développé des procédés simples et efficaces pour cette réaction, principalement pour de petites sources de gaz.
Un système catalytique prometteur est constitué par les catalyseurs hétérogènes Pt-CTF (covalent triazine-based framework) dans un milieu acide sulfurique. Il a été démontré que ce système atteint une conversion et une sélectivité élevées pour l’oxydation directe du méthane en méthanol.
3.4. Distillation du méthanol brut
Le méthanol brut quittant le réacteur contient de l’eau et d’autres impuretés, notamment des fractions légères et lourdes. La quantité et la composition de ces impuretés dépendent des conditions de réaction, du gaz d’alimentation et du catalyseur.
Pour purifier le méthanol brut, il est d’abord rendu légèrement alcalin par l’ajout de petites quantités de soude caustique aqueuse pour neutraliser les acides carboxyliques inférieurs et hydrolyser partiellement les esters. Ensuite, les extrémités légères sont supprimées dans une colonne d’extrémités légères. Enfin, le méthanol pur est distillé en tête dans une ou plusieurs colonnes de distillation.
Si les colonnes de distillation fonctionnent à des pressions différentes, la chaleur de condensation des vapeurs de la colonne fonctionnant à une pression plus élevée peut être utilisée pour chauffer la colonne à une pression plus basse.
Si l’eau de traitement contient de légères impuretés, un soutirage latéral ou une colonne supplémentaire de purification est nécessaire.
Certains composants forment des mélanges azéotropiques avec le méthanol, tels que l’acétone, le formiate d’éthyle, l’acétate de méthyle, l’acétate d’éthyle et le propionate de méthyle.
4. Utilisations du méthanol
Le méthanol a diverses utilisations dans diverses industries. Pour des informations détaillées, consultez cet article : Utilisations du méthanol →
5. Toxicologie du méthanol
Le méthanol est un alcool toxique qui peut être absorbé par la bouche, la peau et les poumons. Il est métabolisé en acide formique, ce qui peut provoquer une acidose et d’autres problèmes de santé.
Les symptômes d’une intoxication au méthanol comprennent des douleurs abdominales, des nausées, des maux de tête, des vomissements, de la lassitude, une vision floue, une ophtalmalgie, une photophobie et une xanthopsie. Dans les cas graves, une intoxication au méthanol peut entraîner le coma et la mort.
La dose mortelle de méthanol se situe entre 30 et 100 ml/kg de poids corporel. La sensibilité au méthanol varie considérablement.
Le traitement de l’intoxication au méthanol comprend :
- Administration d’éthanol pour inhiber l’oxydation du méthanol en acide formique
- Lavage gastrique
- Hémodialyse
- Traitement aux alcalis pour contrôler l’hyperacidité du sang
- Administration de stimulants du SNC
- Boire de plus grandes quantités de liquide
- Bandage oculaire pour protéger les yeux de la lumière
- Garder le patient au chaud
Le méthanol peut également provoquer une intoxication chronique, caractérisée par des lésions des systèmes visuel et nerveux central.
Référence
- Methanol; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a16_465.pub3
